Слайд 2
СТРУКТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
20 аминокислот входят в
состав белков (протеиногенные аминокислоты).
Это α-аминокислоты, в которых функциональные
амино- и карбоксильная группы находятся у одного и того же α -углеродного атома.
α-Аминокислоты отличаются друг от друга структурой R-группы.
Слайд 3
По структуре боковой группы R аминокислоты подразделяются на:
моноаминомонокарбоновые
алифатические (глицин, аланин, валин, лейцин, изолейцин);
моноаминодикарбоновые и их амиды
(аспарагиновая кислота и аспарагин, глутаминовая кислота и глутамин);
диаминомонокарбоновые (аргинин, лизин)
гидроксиаминокислоты (серин, треонин);
серосодержащие (цистеин, метионин);
ароматические (фенилаланин, тирозин, триптофан);
гетероциклические (пролин, гистидин).
Слайд 5
*Тирозин, или гидроксифенилаланин – ароматическая, гидрофильная, полярная аминокислота.
Слайд 6
Протеиногенные аминокислоты делятся на:
незаменимые – не могут синтезироваться
в организме человека
(треонин, метионин, валин, лейцин, изолейцин, фенилаланин,
триптофан, лизин),
частично заменимые – аргинин и гистидин
заменимые – могут синтезироваться в организме.
Слайд 7
α-Аминоксилоты (кроме глицина) имеют в структуре хиральные (асимметричные)
атомы С.
Это обусловливает существование двух энантиомеров –
L- и
D-форм аминокислот.
Все аминoкиcлoты, входящие в состав белков, oтноcятcя к L-ряду.
Аминокислоты, относящиеся к D-ряду, встречаются в некодируемых пептидах.
Слайд 8
Химические свойства аминокислот
декарбоксилирования (образование аминов) и дезаминирования (образование
карбоновых кислот);
переаминирования с α-кетокислотами;
α-аминокислота + α-кетокислота ↔
↔
α-кетокислота’ + α-аминокислота’
образование пептидной связи между α-СООН- и
α-NH2-группами двух аминокислот (полимеризация аминокислот с образованием пептидов):
серин цистеин серилцистеин
Слайд 9
образования амидов и сложных эфиров;
взаимодействие аминогрупп с альдегидами
(образование шиффовых оснований);
образование N-гликозидов (при взаимодействии с углеводами через
аминогруппу);
образование О-гликозидов (при взаимодействии с углеводами через карбоксильную группу);
окисление SH-групп (образование дисульфидных соединений, например, димера цистеина - цистина);
фосфорилирование гидроксиаминокислот (образование сложных фосфорных эфиров);
окисление гуанидиновой группы аргинина.
Слайд 10
Универсальной качественной реакцией на α-аминокислоты, является их взаимодействие
с нингидрином, сопровождающееся образованием окрашенного продукта фиолетового цвета (пурпура
Руэмана).
Слайд 12
Амфотерные свойства аминокислот
α-Аминокислоты в водных растворах существуют преимуществненно
в виде биполярных, или цвиттер-ионов:
Слайд 13
Степень диссоциации ионогенных групп зависит от рН.
Значение рН
раствора, при котором суммарный заряд молекулы аминокислоты равен «0»,
называется изоэлектрической точкой рI и определяется по формуле:
рI=(pK1+pK2)/2
pK1 – константа диссоциации α-карбоксильных групп;
pK2 – константа диссоциации α-аминогрупп.
Если аминокислота содержит дополнительные ионогенные группы, то при расчете рI учитывается
их вклад.
Слайд 14
Значение рН водного раствора химически чистой аминокислоты называется
изоионной точкой.
Значения изоэлектрической и изоионной точек в разбавленных
растворах приблизительно равны.
Слайд 15
Заряд аминокислоты в растворе зависит от его рН
Аминокислоты
в растворах при любых значениях рН (кроме рI) ведут
себя как сильные электролиты, проявляя амфотерные свойства.
Слайд 16
Аминокислотные остатки в молекуле белка соединены пептидными связями.
Длина пептидной связи = 0,132 нм
длина одинарной С–N
связи = 0,146 нм;
длина двойной С=N связи = 0,127 нм.
Слайд 17
Свойства пептидной связи:
пептидная группа жесткая планарная (плоская) структура
и вращение вокруг пептидной связи невозможно;
пептидная связь имеет транс-конфигурацию
(только остатки пролина образуют пептидную связь в цис-конфигурации);
для пептидной группировки характерна кето-енольная таутомерия.
Слайд 18
По числу аминокислотных остатков:
олигопептиды (до 10 аминокислотных остатков);
полипептиды (от 10 до 50 аминокислотных остатков).
По составу
пептиды подразделяются на:
простые (гомомерные) – состоят только из аминокислотных остатков;
сложные (гетеромерные) – дополнительно включены не аминокислотные компоненты (углеводы, липиды, металлы и др.).
Слайд 19
Полипептиды, состоящие более, чем из 50 аминокислотных остатков,
относятся к белкам, или протеинам.
В структуре белковой молекулы
выделяют
4 уровня организации.
Слайд 22
В зависимости от степени асимметрии молекулы белка, имеющие
пространственную структуру (конформацию), подразделяются на:
- глобулярные
(при
соотношении длинной оси к короткой 3:5);
- фибриллярные
(при соотношении осей 80:150).
Слайд 23
Формирование третичной структуры приводит к образованию функционально активной,
или нативной, белковой структуры.
Слайд 24
Физико-химические свойства белков
Большинство белков – это водорастворимые вещества.
В растворах белки проявляют коллоидные свойства и отличаются:
- высокой
вязкостью;
- способностью к образованию гелей;
- неспособностью проходить через
полупроницаемые мембраны.
Слайд 25
Белки способны взаимодействовать и с катионами, и с
анионами.
Способность белков взаимодействовать с различными заряженными веществами может
приводить к их осаждению, т.к. происходит изменение заряда молекулы.
Слайд 26
Денатурация – изменение пространственной структуры, которая происходит в
связи с разрывом связей, поддерживающих и образующих пространственную структуру.
Происходит нарушение четвертичного, третичного и вторичного уровней организации белка.
Факторы денатурации:
физические (механические воздействия, высокие и низкие температуры, ультразвук, радиация и др.);
химические (концентрированные неорганические и органические кислоты, концентрированные щелочи, органические растворители и т.д.).
Процесс, обратный денатурации, называется ренатурация.
Слайд 27
КЛАССИФИКАЦИЯ БЕЛКОВ
В зависимости от состава белки делятся
на простые
и сложные.
Простые белки состоят только из аминокислот.
Альбумины и
глобулины – глобулярные транспортные и запасные белки.
Протамины – основные белки.
Гистоны – ядерные основные белки.
Проламины, глютелины – кислые растительные белки.
Слайд 28
Сложные белки кроме белковой части имеют
структуры небелковой
природы.
Хромопротеины –окрашенные белки: гемопротеины, флавопротеины, родопсин и др.
Фосфопротеины
– содержат остатки фосфорной кислоты.
Гликопротеины – содержат ковалентно связанные моно- и олигосахариды.
Нуклеопротеины – содержат белок и нековалентно связанные остатки нуклеиновых кислот.
Липопротеины – гидрофобные белки, содержащие нековалентно связанные липиды.
Металлопротеины – сложные белки, содержащие атомы (ионы) металлов.
Слайд 29
Функции белков
Каталитическая функция.
Структурная функция.
Транспортная функция
Защитная функция.
Регуляторная функция.
Двигательная функция.
Слайд 30
ФЕРМЕНТЫ
Ферменты - природные биокатализаторы белковой природы.
Слайд 31
СВОЙСТВА ФЕРМЕНТОВ
Общие со всеми катализаторами:
1. способность катализировать только
термодинамически возможные процессы.
2. ускорение наступления состояния равновесия обратимого процесса,
без смещения равновесия в сторону прямой или обратной реакции.
3. не расходуются и не модифицируются в процессе катализа.
Слайд 32
Специфические свойства:
1. более высокая активность ферментов по сравнению
с неорганическими катализаторами.
2. высокую специфичность действия ферментов.
3. способность
реагировать на различные регуляторные воздействия.
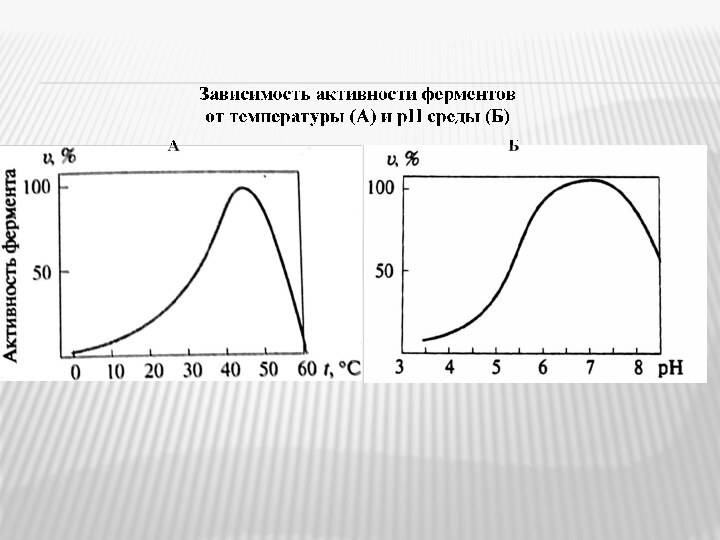
4. свойства, обусловленные белковой природой абсолютного большинства ферментов (термолабильность, зависимость активности от величины рН среды и др.).
Слайд 33
СТРУКТУРА ФЕРМЕНТОВ
Простые ферменты – однокомпонентные, состоят только из
полипептидной части;
Сложные ферменты (холофермент) – двухкомпонентные, кроме полипептида (апофермента)
содержат дополнительный компонент небелковой природы (кофактор).
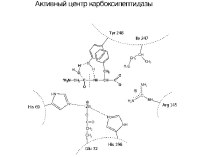
Область фермента, в которой происходит связывание и превращение субстрата, называется активным центром.
Слайд 35
Единицы и формы выражения
активности ферментов
1 катал (каt)
– количество фермента, которое катализирует превращение 1 моль субстрата
за 1 сек при 25оС.
1 международная единица (МЕ) – количество фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при 25оС.
Удельная активность - число единиц активности фермента, приходящихся на 1 мг белка.