- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Металлы
Содержание
- 2. МЕТАЛЛЫ — это вещества, обладающие высокой электропроводностью и теплопроводностью, ковкостью, пластичностью и металлическим блеском.
- 5. Металлы - это химические элементы, атомы которых
- 6. Радиус атома - это расстояние от ядра
- 7. Металлическая связь – вид химической связи между положительно заряженными
- 9. Взаимодействие с простыми веществамиС кислородом большинство металлов образует оксиды
- 10. Отношение металлов к кислотамОбразующиеся в этом процессе
- 11. Скачать презентацию
- 12. Похожие презентации
МЕТАЛЛЫ — это вещества, обладающие высокой электропроводностью и теплопроводностью, ковкостью, пластичностью и металлическим блеском.









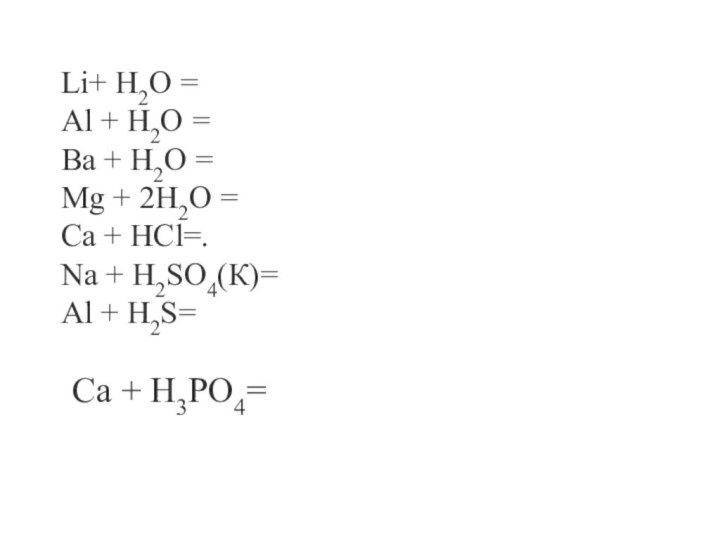
Слайд 2 МЕТАЛЛЫ — это вещества, обладающие высокой электропроводностью и теплопроводностью, ковкостью, пластичностью и
металлическим блеском.
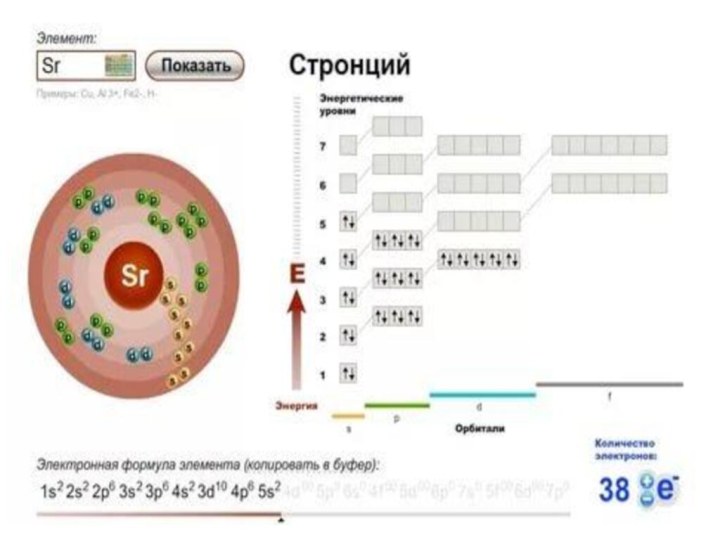
Слайд 5 Металлы - это химические элементы, атомы которых отдают
электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в
положительные ионы. Металлы – восстановители.Слайд 6 Радиус атома - это расстояние от ядра атома
до его внешнего энергетического уровня.
В периоде уменьшается, в
группе увеличивается.Слайд 7 Металлическая связь – вид химической связи между положительно заряженными ионами
(катионами) в кристаллической решётке металлов, осуществляемая за счёт притяжения
подвижных электронов.
Слайд 9
Взаимодействие с простыми веществами
С кислородом большинство металлов образует оксиды :
4Li
+ O2 = 2Li2O,
4Al + 3O2 = 2Al2O3.
Щелочные металлы, за исключением
лития, образуют пероксиды:2Na + O2 = Na2O2.
С галогенами металлы образуют соли галогеноводородных кислот, например,
Cu + Cl2 = CuCl2.
С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления -1.
2Na + H2 = 2NaH.
С серой металлы образуют сульфиды – соли сероводородной кислоты:
Zn + S = ZnS.
С азотом некоторые металлы образуют нитриды, реакция протекает при нагревании:
3Mg + N2 = Mg3N2.
С углеродом образуются карбиды:
4Al + 3C = Al3C4.
С фосфором – фосфиды:
3Ca + 2P = Ca3P2.
Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы.
Слайд 10
Отношение металлов к кислотам
Образующиеся в этом процессе ионы
водорода H+ выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие
протекает по схеме:Me + HCl - соль + H2↑
2 Al + 6 HCl → 2 AlCl3 + 3 H2↑
2│Al0 – 3e- → Al3+ - окисление
3│2H+ + 2e- → H2 – восстановление





























