- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Металлоорганические соединения непереходных металлов
Содержание
- 2. Лекция 2 Характерные типы и энергетика связей металл-углерод Основные синтетические подходы к металлоорганическим соединениям
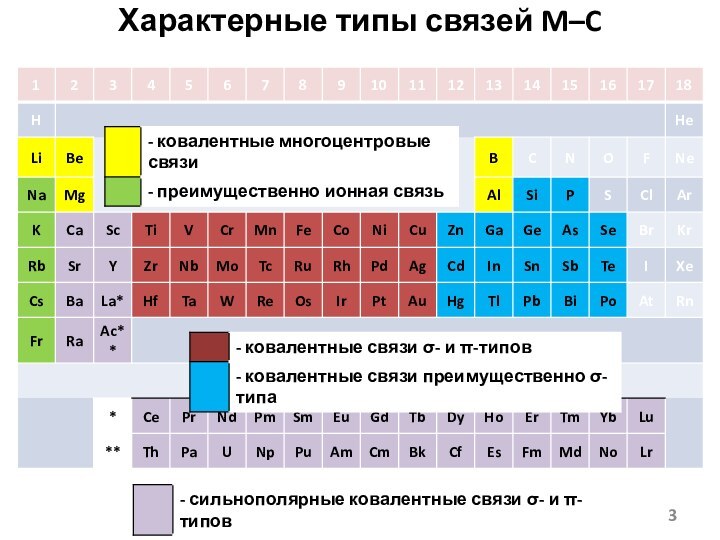
- 3. Характерные типы связей M–C
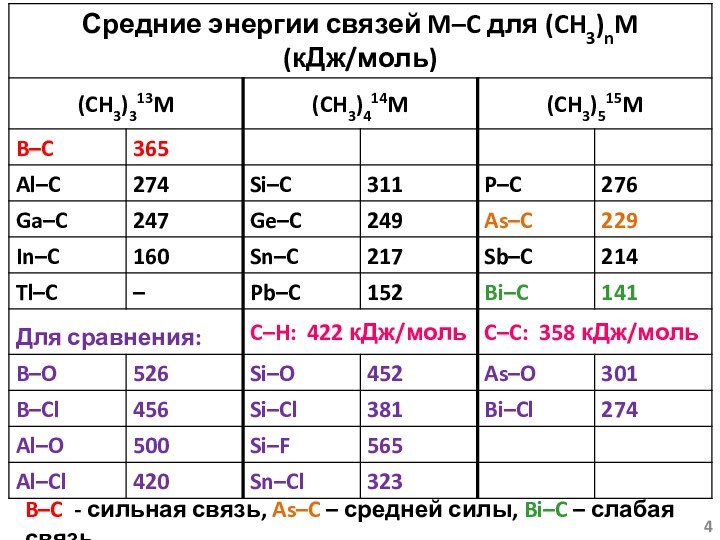
- 4. B–C - сильная связь, As–C – средней силы, Bi–C – слабая связь
- 5. Условность величины средней энергии связи!!!(CH3)2Hg CH3Hg
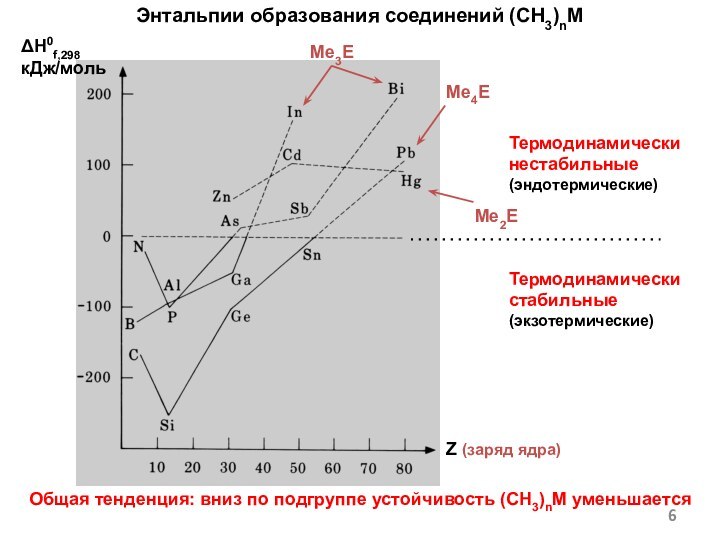
- 6. Энтальпии образования соединений (CH3)nMОбщая тенденция: вниз по подгруппе устойчивость (CH3)nM уменьшается ΔH0f,298кДж/мольMe3EZ (заряд ядра)Me4EMe2EТермодинамически нестабильные(эндотермические)Термодинамически стабильные(экзотермические)
- 8. Обзор методов синтеза металлоорганических соединений(для металлов главных подгрупп)
- 9. Основа подхода – окисление металла галогенуглеводородами 2M
- 10. Подход [1], примерыМетод [1a] - «прямой синтез»
- 11. Метод [1б] - «смешаннометаллический» - смесь металла-восстановителя
- 12. Метод [1в] – окисление металлов в промежуточной
- 13. Трансметаллирование (подход [2])Основа подхода – восстановление металлоорганического
- 14. Обмен металлов (подход [3])Основа подхода – вывод
- 15. Метатезис (подход [4])(нуклеофильное замещение галогена на R)Движущая
- 16. Замещение галогена на металл в реакции арилгалогенидов
- 17. Металлирование C–H кислот (подход [6]) Пример:Кислотно-основное равновесие. Образуется «соль» более сильной кислоты.
- 18. pKa органических CH-кислот и некоторых неорганических кислот
- 19. Ацетилены и циклопентадиен являются довольно сильными кислотами.
- 20. Металлирование C–H кислот (подход [6])Возможные проблемы:в некоторых
- 21. Меркурирование C–H кислот (подход [7])(особый случай металлирования!)Первая
- 22. Гидрометаллирование (подход [8]) Пример:Способность к присоединению увеличивается в ряду:
- 23. Карбометаллирование (подход [9])Аналогично гидрометаллированию, но с присоединением углеводородного радикала. Пример:Только для щелочных металлов и алюминия!
- 24. Внедрение карбенов (подход [10])Примеры:Обычно карбены внедряются по
- 25. Декарбоксилирование (подход [11])Примеры:Важно!!!Радикалы R должны быть сильноакцепторными:C6F5,
- 26. Скачать презентацию
- 27. Похожие презентации
Лекция 2 Характерные типы и энергетика связей металл-углерод Основные синтетические подходы к металлоорганическим соединениям





![Металлоорганические соединения непереходных металлов Подход [1], примерыМетод [1a] - «прямой синтез» - металл + галогенуглеводород 2Li +](/img/tmb/13/1271950/ccddd58fa9553f466258889175631d99-720x.jpg)
![Металлоорганические соединения непереходных металлов Метод [1б] - «смешаннометаллический» - смесь металла-восстановителя + металл, соединение которого вы](/img/tmb/13/1271950/8e61d260748641636eed37b02704da51-720x.jpg)
![Металлоорганические соединения непереходных металлов Метод [1в] – окисление металлов в промежуточной степени окисления: PbI2 + CH3I](/img/tmb/13/1271950/ac057bb8e2d3ebe5da60eecdfda83f26-720x.jpg)
![Металлоорганические соединения непереходных металлов Трансметаллирование (подход [2])Основа подхода – восстановление металлоорганического соединения менее электроположительного металла более](/img/tmb/13/1271950/351ca446ff86d32865ae8db74ecc5e1c-720x.jpg)
![Металлоорганические соединения непереходных металлов Обмен металлов (подход [3])Основа подхода – вывод одного из продуктов в другую](/img/tmb/13/1271950/307bf4e5ed210646df34730aedfb1d22-720x.jpg)
![Металлоорганические соединения непереходных металлов Метатезис (подход [4])(нуклеофильное замещение галогена на R)Движущая сила – образование галогенида электроположительного](/img/tmb/13/1271950/4d45dbab55d98ab28dbc11d3e08ed62d-720x.jpg)
![Металлоорганические соединения непереходных металлов Замещение галогена на металл в реакции арилгалогенидов с алкиллитием (подход [5]) RLi +](/img/tmb/13/1271950/b9a9602328ac20a30935891a32447124-720x.jpg)
![Металлоорганические соединения непереходных металлов Металлирование C–H кислот (подход [6]) Пример:Кислотно-основное равновесие. Образуется «соль» более сильной кислоты.](/img/tmb/13/1271950/644f1e62469c75c7492bd750dc06c158-720x.jpg)
![Металлоорганические соединения непереходных металлов Металлирование C–H кислот (подход [6])Возможные проблемы:в некоторых случаях депротонирование в органических средах](/img/tmb/13/1271950/5fa61684aca9e443435913c9719183dc-720x.jpg)
![Металлоорганические соединения непереходных металлов Меркурирование C–H кислот (подход [7])(особый случай металлирования!)Первая стадия – легко, вторая требует](/img/tmb/13/1271950/83754ca6e8ff744d1332dfadb660cd88-720x.jpg)
![Металлоорганические соединения непереходных металлов Гидрометаллирование (подход [8]) Пример:Способность к присоединению увеличивается в ряду:](/img/tmb/13/1271950/0dce7023baf79d41cd4e8c4642d1cc63-720x.jpg)
![Металлоорганические соединения непереходных металлов Карбометаллирование (подход [9])Аналогично гидрометаллированию, но с присоединением углеводородного радикала. Пример:Только для щелочных металлов и алюминия!](/img/tmb/13/1271950/b7e3c7403395baaa7b64517810e23754-720x.jpg)
![Металлоорганические соединения непереходных металлов Внедрение карбенов (подход [10])Примеры:Обычно карбены внедряются по связи M–H и M–X, внедрение](/img/tmb/13/1271950/7872feb531cc51f8aee5383f8a5e91a4-720x.jpg)
![Металлоорганические соединения непереходных металлов Декарбоксилирование (подход [11])Примеры:Важно!!!Радикалы R должны быть сильноакцепторными:C6F5, CF3, CCl3, и т.п.Металлоорганические гидриды](/img/tmb/13/1271950/37354607f1f712c0a2d5a6de6aa8ff76-720x.jpg)
![Металлоорганические соединения непереходных металлов Арилирование через соли диазония (подход [12])Примеры:Применение метода очень ограничены. Особое значение имеет, пожалуй, только для мышьякорганики.](/img/tmb/13/1271950/6fd2f79aef0fc60b1a322fb9b3920fd5-720x.jpg)
Слайд 5
Условность величины средней энергии связи!!!
(CH3)2Hg CH3Hg +
CH3 D1(Hg – C) = 214 кДж/моль
(CH3)Hg Hg +
CH3 D2(Hg – C) = 29 кДж/мольСреднее значение – Dср(Hg – C) = 121.5 кДж/моль!!!
Слайд 6
Энтальпии образования соединений (CH3)nM
Общая тенденция: вниз по подгруппе
устойчивость (CH3)nM уменьшается
ΔH0f,298
кДж/моль
Me3E
Z (заряд ядра)
Me4E
Me2E
Термодинамически нестабильные
(эндотермические)
Термодинамически стабильные
(экзотермические)
Слайд 9
Основа подхода – окисление металла галогенуглеводородами
2M +
nRX RnM + MXn
M0 – ne– Mn+
R1+
+ 2e– R–Окислительное присоединение (подход [1])
Слайд 10
Подход [1], примеры
Метод [1a] - «прямой синтез» -
металл + галогенуглеводород
2Li + C4H9Br C4H9Li + LiBr
Mg + C6H5Br C6H5MgBrРеакции экзотермичны в случае наиболее электроположитель-ных металлов, образующих ионные и сильные ковалентные связи М–С.
Метод неприемлем в случае металлов, образующих слабые связи М–С (Tl, Pb, Bi, Hg).
Растворители: простые эфиры, циклические эфиры, алканы
Слайд 11 Метод [1б] - «смешаннометаллический» - смесь металла-восстановителя +
металл, соединение которого вы хотите получить:
2Na + Hg
+ 2CH3Br (CH3)2Hg + 2NaBrH0298 = – 530 кДж/моль
H0f,298 (NaBr) = – 361 кДж/моль
Удобен, если есть возможность использовать сплавы
4Na/Pb + 4C2H5Cl (C2H5)4Pb +3Pb + 4NaCl
Подход [1], примеры
Слайд 12 Метод [1в] – окисление металлов в промежуточной степени
окисления:
PbI2 + CH3I (CH3)PbI3
Подход [1], примеры
Pb2+ –
2e– Pb4+(CH3)+ + 2e– (CH3) –
Слайд 13
Трансметаллирование (подход [2])
Основа подхода – восстановление металлоорганического соединения
менее электроположительного металла более электроположительным
M + RM’ RM
+ M’Пример:
Zn + (CH3)2Hg (CH3)2Zn + Hg
H0298 = – 35 кДж/моль
Метод [2] применим для 1M; 2M; 3M; 13M = Al, Ga; 14M = Sn, Pb; 15M = Bi; 16M = Se, Te; 15M = Bi; 12M = Zn, Cd.
Слайд 14
Обмен металлов (подход [3])
Основа подхода – вывод одного
из продуктов в другую фазу (чаще, в осадок)
RM +
R’M’ R’M + RM’Пример:
4PhLi + (CH2=CH)4Sn 4(CH2=CH)Li + Ph4Sn
(в не- или малополярных апротонных растворителях)
Слайд 15
Метатезис (подход [4])
(нуклеофильное замещение галогена на R)
Движущая сила
– образование галогенида электроположительного металла
nRM + M’Xn RnM’
+ nMXПример:
3(CH3)Li + SbCl3 (CH3)3Sb + 3LiCl
Один из наиболее распространенных подходов!
Имеется возможность «играть» на нерастворимости галогенида металла.
Есть «подводные камни»: R - сильные восстановители
Слайд 16 Замещение галогена на металл в реакции арилгалогенидов с
алкиллитием (подход [5])
RLi + ArX RX + ArLi
Пример:
n-BuLi
+ PhX n-BuX + PhLi(X = Br, I очень редко Cl, но не F!)
Реакция замещения галогена на литий очень быстрая, поэтому метод может быть использован для замещенных арилов (NO2, CONR2, COOR, SiCl3), поскольку протекает при низкой температуре!
Механизм до конца не ясен. Подозревается, что он радикальный.
Слайд 17
Металлирование C–H кислот (подход [6])
Пример:
Кислотно-основное равновесие. Образуется «соль»
более сильной кислоты.
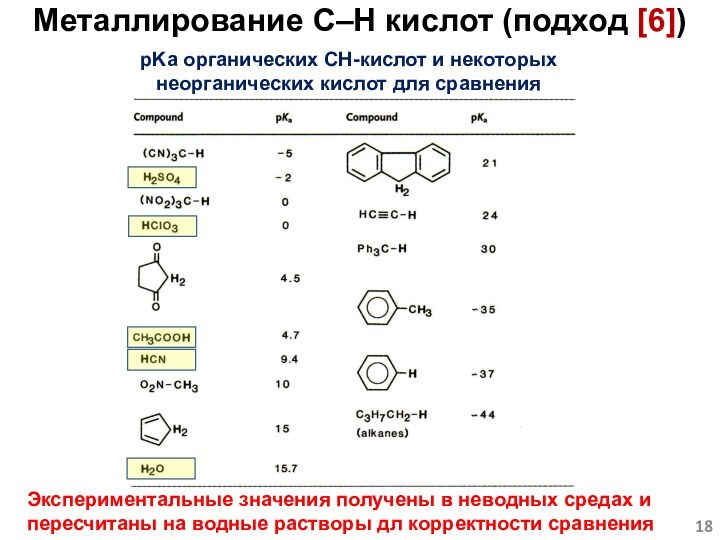
Слайд 18 pKa органических CH-кислот и некоторых неорганических кислот для
сравнения
Экспериментальные значения получены в неводных средах и пересчитаны на
водные растворы дл корректности сравненияМеталлирование C–H кислот (подход [6])
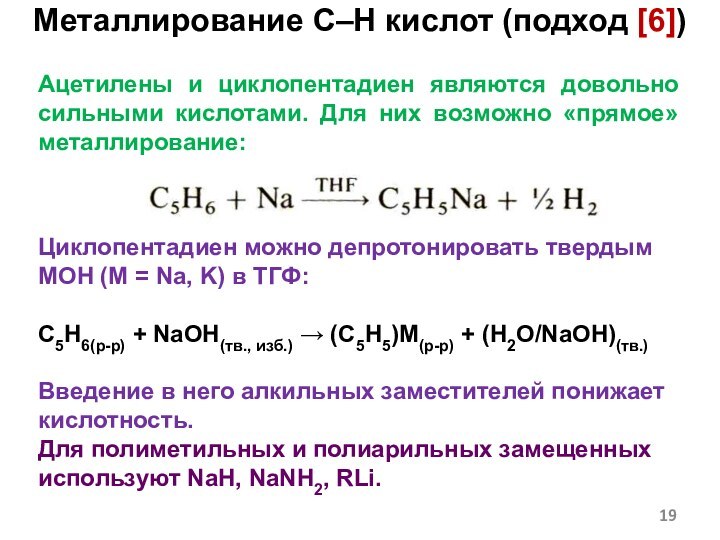
Слайд 19 Ацетилены и циклопентадиен являются довольно сильными кислотами. Для
них возможно «прямое» металлирование:
Циклопентадиен можно депротонировать твердым MOH (M
= Na, K) в ТГФ:C5H6(р-р) + NaOH(тв., изб.) (C5H5)M(р-р) + (H2O/NaOH)(тв.)
Введение в него алкильных заместителей понижает кислотность.
Для полиметильных и полиарильных замещенных используют NaH, NaNH2, RLi.
Металлирование C–H кислот (подход [6])
Слайд 20
Металлирование C–H кислот (подход [6])
Возможные проблемы:
в некоторых случаях
депротонирование в органических средах чрезвычайно заторможено!
Реакция выгодна термодинамически, но
чрезвычайно медленная. Добавлением TMEDA или t-BuO- удается увеличить скорость до разумной:





























