- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Метанол
Содержание
- 2. Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид
- 3. С воздухом в объёмных концентрациях 6,72—36,5 % образует
- 4. История Метанол был впервые обнаружен Боулем в
- 5. Получение Известно несколько способов получения метанола: сухая
- 6. Современный промышленный метод получения — каталитический синтез из оксида
- 7. Применение В органической химии метанол используется в
- 8. Благодаря высокому октановому числу, что позволяет увеличить
- 9. Физические свойстваТемпература кипения 64,7°.Теплота горения равна 170,6, Теплота образования 61,4 (Штоман, Клебер и Лангбейн).
- 10. Метанол смешивается во всех отношениях с водой,
- 11. Безводный метанол, растворяя небольшое количество медного купороса,
- 12. Метанол (в отличие от этанола) с водой
- 13. Скачать презентацию
- 14. Похожие презентации
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) — CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. Метанол — это первый представитель гомологического ряда одноатомных спиртов.











Слайд 2 Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) —
CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость.
ряда одноатомных спиртов.Слайд 3 С воздухом в объёмных концентрациях 6,72—36,5 % образует взрывоопасные
смеси (температура вспышки 15,6 °C).
Метанол смешивается в любых соотношениях с водой и
большинством органических растворителей
Слайд 4
История
Метанол был впервые обнаружен Боулем в 1661 году
в продуктах сухой перегонки древесины. Через два столетия, в
1834 году, его выделили в чистом виде Думас и Пелигот. Тогда же была установлена химическая формула метанола. В 1857 году Бертло получил метанол омылением метилхлорида.
Слайд 5
Получение
Известно несколько способов получения метанола: сухая перегонка древесины
и лигнина, термическое разложение солей муравьиной кислоты, синтез из
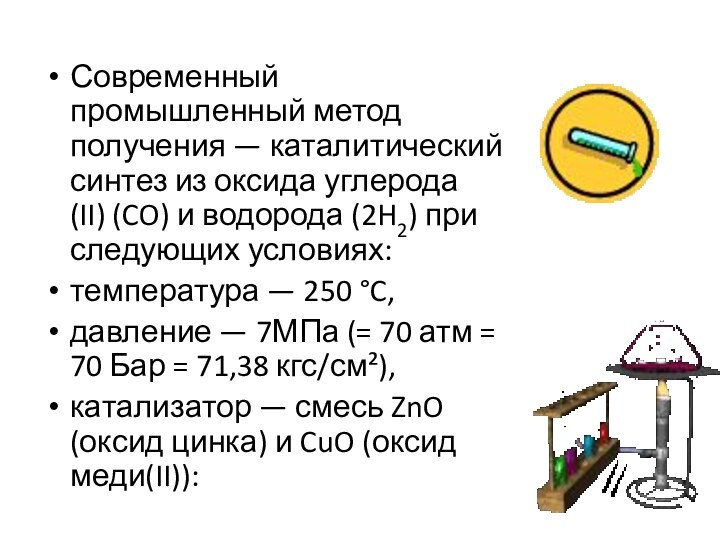
метана через метилхлорид с последующим омылением, неполное окисление метана и получение из синтез-газа.Слайд 6 Современный промышленный метод получения — каталитический синтез из оксида углерода(II) (CO)
и водорода (2H2) при следующих условиях:
температура — 250 °C,
давление — 7МПа (= 70 атм = 70
Бар = 71,38 кгс/см²),катализатор — смесь ZnO (оксид цинка) и CuO (оксид меди(II)):
Слайд 7
Применение
В органической химии метанол используется в качестве растворителя.
Метанол
используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой
температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида, формалина, уксусной кислоты и ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.Слайд 8 Благодаря высокому октановому числу, что позволяет увеличить степень
сжатия до 16 и большей на 20 % энергетической мощностью заряда
на основе метанола и воздуха, метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:
Слайд 9
Физические свойства
Температура кипения 64,7°.
Теплота горения равна 170,6,
Теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Слайд 10 Метанол смешивается во всех отношениях с водой, этиловым
спиртом и эфиром; при смешении с водой происходит сжатие
и разогревание. Горит синеватым пламенем.Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт.