Слайд 2
Знать:
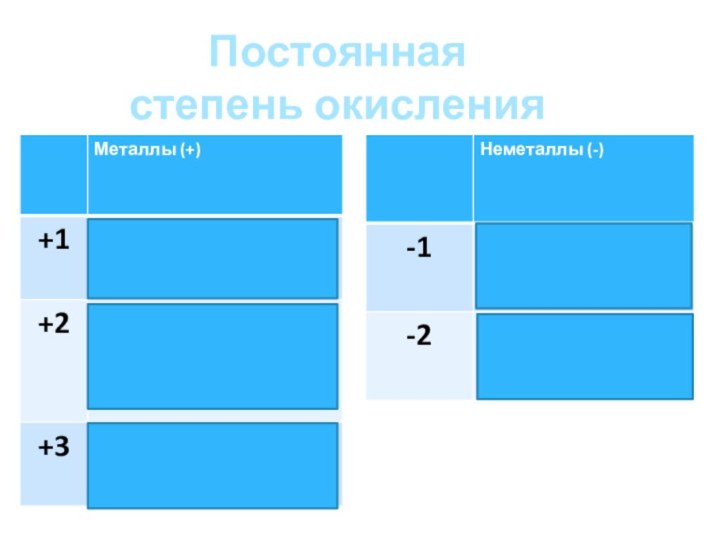
Элементы с постоянной степенью окисления;
Элементы, высшая степень окисления
которых не равна номеру группы, в которой они находятся
периодической системе;
Соединения водорода и кислорода, в которых эти элементы имеют не характерные для них степени окисления.
Слайд 3
Уметь
Определять степени окисления элемента по его положению в
периодической системе;
Определять степени окисления элементов по формуле;
Составлять формулы бинарных
соединений по степени окисления;
Называть бинарные соединения.
Слайд 4
Степень окисления(СО) – это условный заряд атомов, найденный
и для ковалентных полярных соединений, как для ионных.
Слайд 5
Постоянная степень окисления
Слайд 6
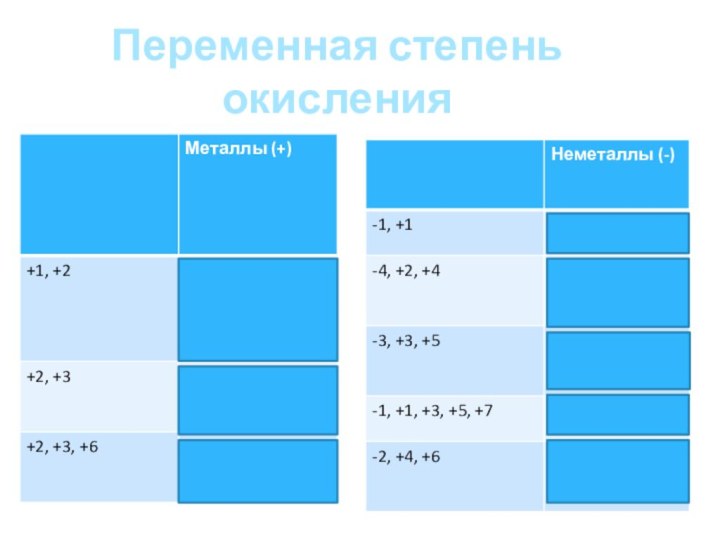
Переменная степень окисления
Слайд 7
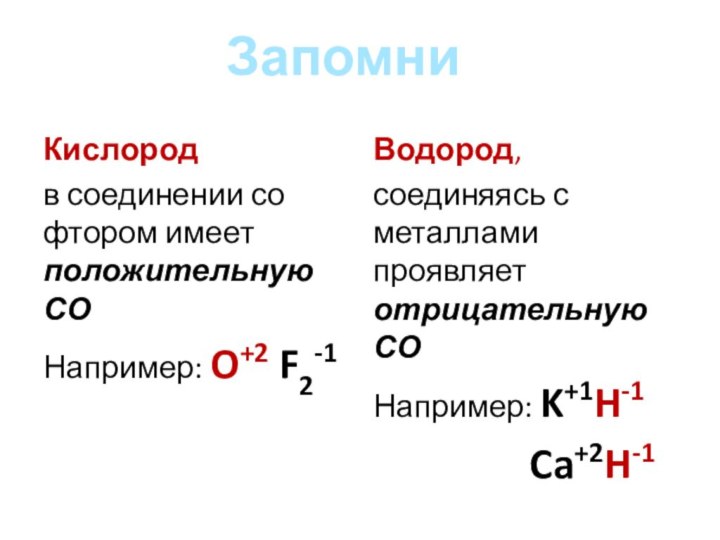
Кислород
в соединении со фтором имеет положительную СО
Например:
O+2 F2-1
Водород,
соединяясь с металлами проявляет отрицательную СО
Например:
K+1H-1
Ca+2H-1
Запомни
Слайд 8
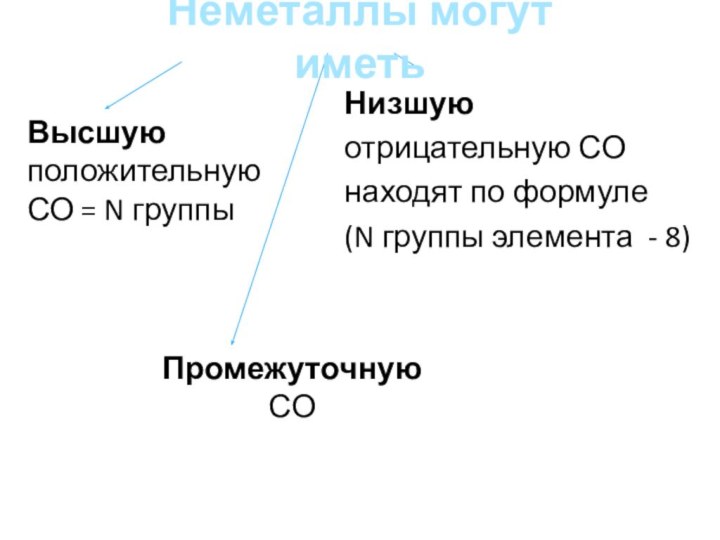
Неметаллы могут иметь
Высшую положительную СО = N группы
Низшую отрицательную СО находят по формуле
(N группы элемента - 8)
Промежуточную СО
Слайд 9
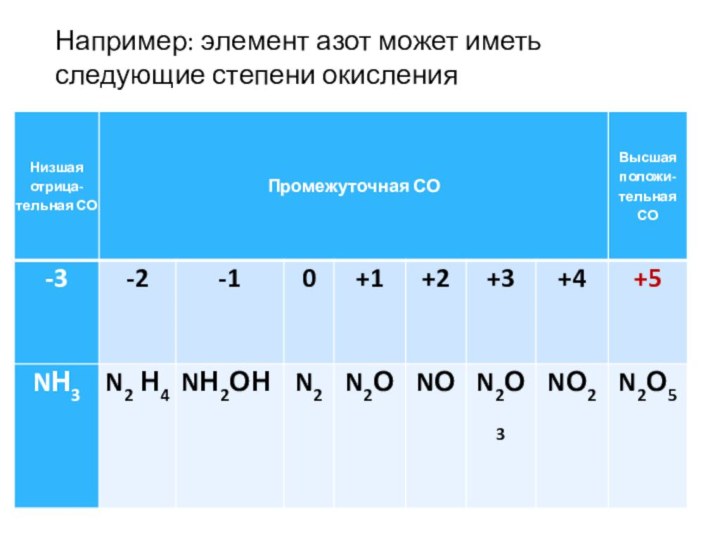
Например: элемент азот может иметь следующие степени окисления
Слайд 10
Любая формула - электронейтральна, поэтому алгебраическая сумма степеней
окисления всех атомов в молекуле =0
степени окисления записывают над
символами элементов со знаком «+» или «-» перед их величинами.
Слайд 11
Как узнать какой элемент в соединении проявляет СО
отрицательную?
F, O, N, Cl, Br, S, P, C, H,
Si, Al, Mg, Ca, Na, Cs
х.э. стоящий в ряду левее проявляет (-) СО, а правее – (+) СО
N2+5O5-2
H3+1N-3
Металлы во всех сложных соединениях имеют только положительные степени окисления.
Слайд 12
В соединениях с ионной связью степени окисления элементов
равны зарядам ионов
Например:
Na+ Cl- степень окисления
натрия равна +1, хлора = -1
K2+O2- степень окисления калия = +1, кислорода = -2.
Слайд 13
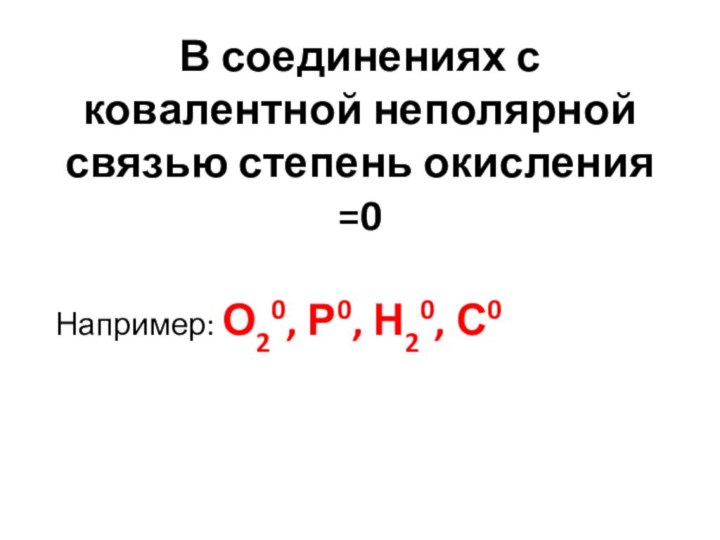
В соединениях с ковалентной неполярной связью степень окисления
=0
Например: О20, Р0, Н20, С0
Слайд 14
В соединениях с ковалентной полярной связью степень окисления
элемента – это условный заряд его атома в молекуле,
если считать, что молекула состоит из ионов, то есть рассматривать ковалентные полярные связи как ионные связи.
Например:
H :Cl считают, что общая электронная пара полностью переходит к атому хлора (ЭО Cl >ЭО H), то есть связь становится ионной H+Cl-, следовательно степень окисления водорода +1, а хлора -1.
H+1 Cl-1
Слайд 15
Правила составления формул химических соединений
1. Если СО химических
элементов, входящих в состав соединений, одинаковы, то индексы не
ставятся.
C+2O-2, Cu+2O-2, H+1Cl-1
Слайд 16
2. Если СО одного х.э. делится на СО
другого х.э., то значение большей СО делим на значение
меньшей и ставим полученное число возле х.э. с меньшей СО
S+6O-2
6:2=3 → S+6O3-2
Слайд 17
3. Если значения СО не делятся друг на
друга, ставим их в виде индексов «крест- накрест»
Al+3O-2 →Al2+3O3-2
Слайд 18
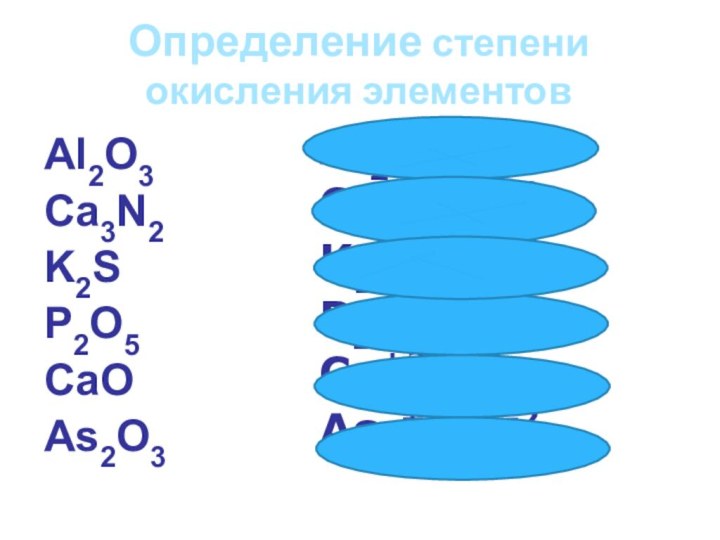
Определение степени окисления элементов
Al2O3
Ca3N2
K2S
P2O5
CаO
As2O3
Al2+3O3-2
Ca3+2N2-3
K2+1S-2
P2+5O5-2
Cа+2O-2
As2+3O3-2
Слайд 19
Номенклатура бинарных соединений
Слайд 20
Химические элементы
Корень слов
Нитрогениум
Бромум
Гидрогениум
Оксигениум
Силициум
Сульфур
Карбонеум
Фторум
Хлорум
N
Br
H
O
Si
S
C
F
Cl
Слайд 21
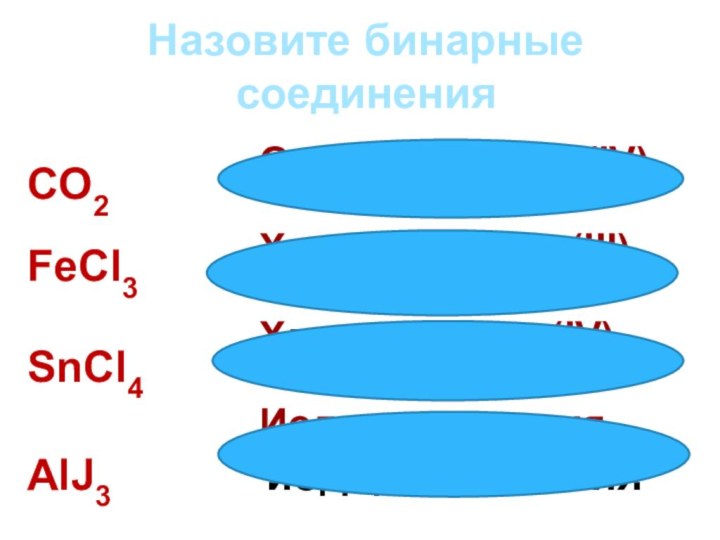
Назовите бинарные соединения
CO2
оксид углерода(IV)
FeCl3
хлорид железа (III)
SnCl4 хлорид олова(IV)
AlJ3 иодид алюминия
Оксид углерода (IV)
Хлорид железа (III)
Хлорид олова (IV)
Иодид алюминия