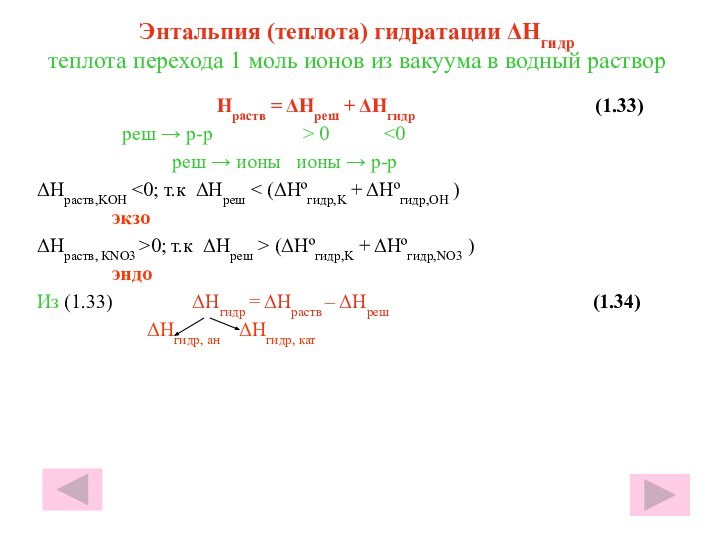
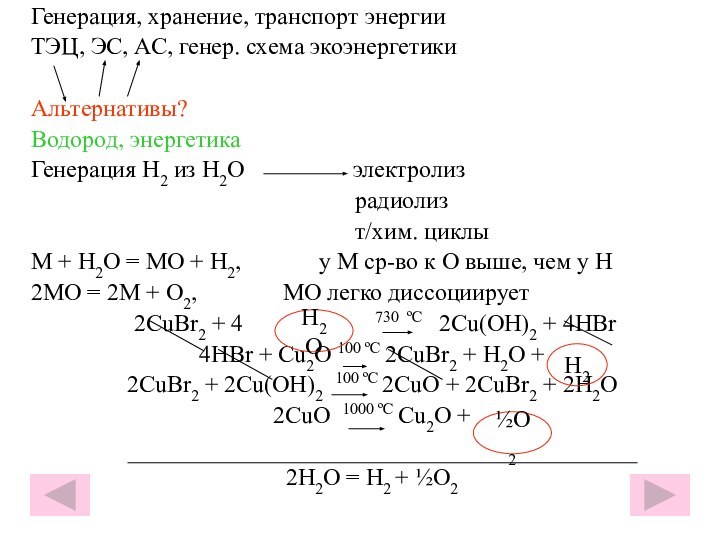
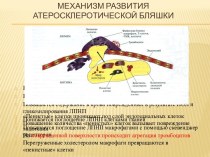
гуляю пешком по поселку
И вижу розарий, альпийскую ёлку,
Дом, фонари,
провода,Летнюю мебель, столы для пинг-понга,
Сенокосилку, цветы из Гонконга,
Я рассуждаю тогда:
- Сколько же, сколько же надо учиться,
Рано вставать
Или поздно ложиться,
Над книгами сколько корпеть,
Чтоб все это тоже иметь.
Когда я на лыжах с собакой катаюсь
И на высокий забор натыкаюсь,
А за забором прием –
Музыка, свет, королевы и дамы…
Корреспонденты, огни для рекламы,
Столики с разным питьем…
Я понимаю, чтоб это иметь,
Чтоб наслаждаться подобным забором,
Музыкой, дамами и разговором…
Надо все время корпеть,
Нужно учиться и очень серьезно,
Рано вставать,
Засыпать очень поздно
И никогда не болеть.
Когда я катаюсь на велосипеде,
О, юноша мой дорогой,
Мне часто встречаются юные леди
И каждая лучше другой.
Смотрю я на них продолжительным взглядом,
Дивлюсь их походке
Уму и нарядам…
И знаю, чтоб с ними дружить,
Надо всегда на пятерки учиться,
Надо к вершинам науки стремиться,
Жизнь к их ногам положить.
Эх, почему же я так не учился,
С книгами вместе в кровать не ложился,
С лекций в кино убегал?
Я бы сейчас не стоял у заборов,
Был бы участником тех разговоров
И этих стихов не слагал.