- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химическая идентификация
Содержание
- 2. ЕГЭ (вопрос В6): Качественные реакции на неорганические
- 3. План1. Понятие о химической идентификации.2. Задания вопроса В6 (ЕГЭ).3. Задания вопроса В3 (ГИА).
- 4. Качественные реакции – это реакции, позволяющие доказать
- 5. Пример 1.Докажите, что предложенное твёрдое вещество является
- 6. Р е ш е н и еОтбираем
- 7. Пример 2.Докажите, что водный раствор вещества является
- 8. Р е ш е н и е1)
- 9. Р е ш е н и е2)
- 10. Различить вещества
- 11. Пример 3.С помощью каких реактивов можно различить
- 12. А н а л и з и
- 13. Бромная вода — реагент, используемый для определения
- 14. Пример 4.Установите соответствие между веществами и реагентом,
- 15. А н а л и з и
- 16. Б) Пропилен CH3–CH=CH2 – непредельный углеводород с
- 17. В) Пропандиол-1,2 CH3–CHOH–CH2OH – многоатомный спирт предельного
- 18. Г) Фенол C6H5OH — гидроксильное производное ароматического
- 19. Пример 5.Установите соответствие между веществами и признаком протекающей между ними реакции.
- 20. А) 2Na3[Cr(OH)6] + 3H2O2 = 2NaOH +
- 21. В) Fe(OH)2 + 2HCl (разб.) = FeCl2
- 22. ЕГЭ (вопрос В6): Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений
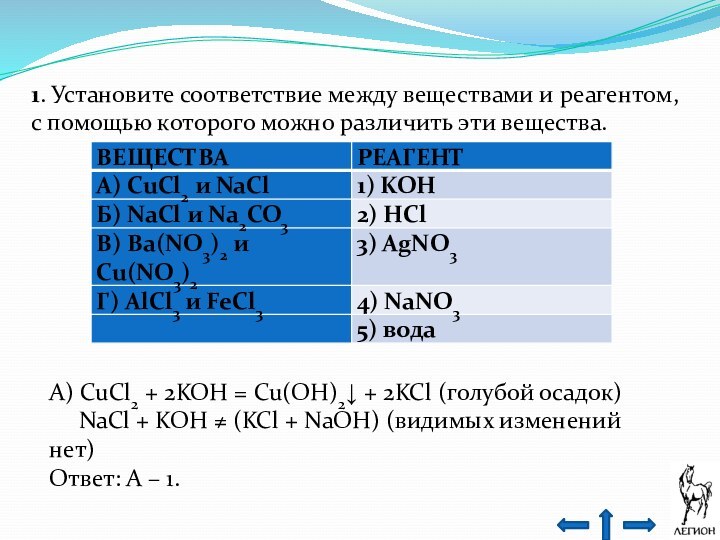
- 23. 1. Установите соответствие между веществами и реагентом,
- 24. Б) NaCl + HCl ≠ (видимых изменений
- 25. В) Ba(NO3)2 + 2KOH ≠ (Ba(OH)2 +
- 26. Г) AlCl3 + 3KOH = Al(OH)3↓ +
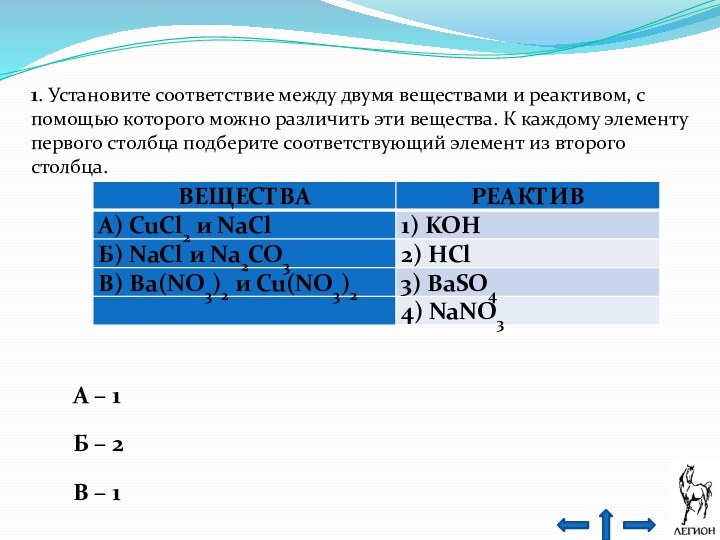
- 27. 2. Установите соответствие между веществами и реагентом,
- 28. 2. Установите соответствие между веществами и реагентом,
- 29. 2. Установите соответствие между веществами и реагентом,
- 30. 2. Установите соответствие между веществами и реагентом,
- 31. 3. Установите соответствие между реагирующими веществами и
- 32. 3. Установите соответствие между реагирующими веществами и
- 33. 3. Установите соответствие между реагирующими веществами и
- 34. 3. Установите соответствие между реагирующими веществами и
- 35. 4. Установите соответствие между веществами и реагентом,
- 36. 4. Установите соответствие между веществами и реагентом,
- 37. 4. Установите соответствие между веществами и реагентом,
- 38. 4. Установите соответствие между веществами и реагентом,
- 39. 5. Установите соответствие между веществами и реагентом,
- 40. 5. Установите соответствие между веществами и реагентом,
- 41. 5. Установите соответствие между веществами и реагентом,
- 42. 5. Установите соответствие между веществами и реагентом,
- 43. 6. Установите соответствие между реагирующими веществами и
- 44. 6. Установите соответствие между реагирующими веществами и
- 45. 6. Установите соответствие между реагирующими веществами и
- 46. 6. Установите соответствие между реагирующими веществами и
- 47. 7. Установите соответствие между веществами и реагентом,
- 48. 7. Установите соответствие между веществами и реагентом,
- 49. 7. Установите соответствие между веществами и реагентом,
- 50. 7. Установите соответствие между веществами и реагентом,
- 51. 8. Установите соответствие между веществами и реагентом,
- 52. 8. Установите соответствие между веществами и реагентом,
- 53. 8. Установите соответствие между веществами и реагентом,
- 54. 8. Установите соответствие между веществами и реагентом,
- 55. 9. Установите соответствие между реагирующими веществами и
- 56. 9. Установите соответствие между реагирующими веществами и
- 57. 9. Установите соответствие между реагирующими веществами и
- 58. 9. Установите соответствие между реагирующими веществами и
- 59. 10. Установите соответствие между реагирующими веществами и
- 60. 11. Установите соответствие между веществами и реагентом,
- 61. 12. Установите соответствие между реагирующими веществами и
- 62. 13. Установите соответствие между веществами и реагентом,
- 63. 14. Установите соответствие между веществами и реагентом,
- 64. 15. Установите соответствие между реагирующими веществами и
- 65. 16. Установите соответствие между веществами и реагентом,
- 66. 17. Установите соответствие между веществами и реагентом,
- 67. 18. Установите соответствие между веществами и реагентом,
- 68. 19. Установите соответствие между реагирующими веществами и
- 69. 20. Установите соответствие между веществами и реагентом,
- 70. 21. Установите соответствие между веществами и реагентом,
- 71. 22. Установите соответствие между двумя веществами и
- 72. 23. Установите соответствие между двумя веществами и
- 73. 24. Установите соответствие между реагирующими веществами и
- 74. 25. Установите соответствие между двумя веществами и
- 75. 26. Установите соответствие между двумя веществами и
- 76. 27. Установите соответствие между реагирующими веществами и
- 77. 28. Установите соответствие между двумя веществами и
- 78. 29. Установите соответствие между двумя веществами и
- 79. 30. Установите соответствие между двумя веществами и
- 80. 31. Установите соответствие между двумя веществами и
- 81. 32. Установите соответствие между веществом и реактивом,
- 82. 33. Установите соответствие между двумя веществами и
- 83. 34. Установите соответствие между реагирующими веществами и
- 84. 35. Установите соответствие между реагирующими веществами и
- 85. 36. Установите соответствие между двумя веществами и
- 86. 37. Установите соответствие между двумя веществами и
- 87. 38. Установите соответствие между двумя веществами и
- 88. 39. Установите соответствие между веществом и реактивом,
- 89. 40. Установите соответствие между реагирующими веществами и
- 90. 41. Установите соответствие между двумя веществами и
- 91. 42. Установите соответствие между двумя веществами и
- 92. 43. Установите соответствие между двумя веществами и
- 93. 44. Установите соответствие между двумя веществами и
- 94. 45. Установите соответствие между реагирующими веществами и
- 95. 46. Установите соответствие между реагирующими веществами и
- 96. 47. Установите соответствие между двумя веществами и
- 97. 48. Установите соответствие между реагирующими веществами и
- 98. ГИА (вопрос В3): Определение характера среды раствора
- 99. Пример 1. Установите соответствие между формулами двух
- 100. Пример 1. Анализ и решениеА) Хлороводород HCl
- 101. Пример 1. Анализ и решениеА) Азотная кислота
- 102. Пример 1. Б) Гидроксид натрия NaOH –
- 103. Пример 1. Б) Гидроксид бария Ba(OH)2 –
- 104. Пример 1. В) Хлорид аммония NH4Cl –
- 105. Пример 1. В) Хлорид натрия NaCl –
- 106. Пример 2. Установите соответствие между реагирующими веществами и признаком их взаимодействия.
- 107. Пример 2. А) 2HCl(р-р) + Ba(OH)2(р-р) =
- 108. 1. Установите соответствие между двумя веществами и
- 109. 2. Установите соответствие между двумя веществами и
- 110. 3. Установите соответствие между реагирующими веществами и
- 111. 4. Установите соответствие между двумя веществами и
- 112. 5. Установите соответствие между двумя веществами и
- 113. 7. Установите соответствие между двумя веществами и
- 114. 6. Установите соответствие между определяемым ионом и
- 115. 8. Установите соответствие между двумя веществами и
- 116. 9. Установите соответствие между реагирующими веществами и
- 117. 10. Установите соответствие между двумя веществами и
- 118. 11. Установите соответствие между двумя веществами и
- 119. 12. Установите соответствие между реагирующими веществами и
- 120. Скачать презентацию
- 121. Похожие презентации



















![Химическая идентификация А) 2Na3[Cr(OH)6] + 3H2O2 = 2NaOH + 2Na2CrO4 + 8H2O Na3[Cr(OH)6]](/img/tmb/13/1256976/66c310086c5742bf0ca55477af28e26b-720x.jpg)


































































































Слайд 2 ЕГЭ (вопрос В6): Качественные реакции на неорганические вещества
и ионы. Качественные реакции органических соединений
характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак)
Слайд 3
План
1. Понятие о химической идентификации.
2. Задания вопроса В6
(ЕГЭ).
3. Задания вопроса В3 (ГИА).
Слайд 4 Качественные реакции – это реакции, позволяющие доказать наличие
того или иного вещества (иона) в среде или присутствие
функциональной группы в веществе.Анализируемые вещества могут находиться в различных агрегатных состояниях (твёрдом, жидком и газообразном). С точки зрения наблюдаемых эффектов все реакции обнаружения можно разделить на несколько групп:
1) образование характерных осадков,
2) растворение вещества,
3) появление (изменение) окраски,
4) выделение газов,
5) изменение запаха,
6) окрашивание пламени.
Слайд 5
Пример 1.
Докажите, что предложенное твёрдое вещество является орто-фосфатом
натрия.
А н а л и з
Формула ортофосфата натрия —
Na3PO4.В состав вещества входят катион натрия Na+ и кислотный остаток (анион) PO43–. Качественная реакция на катион натрия — окрашивание пламени в жёлтый цвет, на анион PO43– — образование растворимого в кислотах осадка Ag3PO4, имеющего жёлтый цвет.
Слайд 6
Р е ш е н и е
Отбираем пробу
(небольшую порцию) вещества на прокалённую стальную проволоку и вносим
в пламя — должны наблюдать окрашивание пламени в жёлтый цвет.Вывод: в составе вещества имеются катионы Na+.
Небольшую порцию вещества растворяем в воде и добавляем в полученный раствор 1–2 капли раствора нитрата серебра, должны наблюдать образование жёлтого осадка:
Na3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4↓
Добавляем в раствор азотную кислоту — происходит растворение осадка:
Ag3PO4 + 3HNO3 = 3AgNO3 + H3PO4
Вывод: в состав вещества входят ионы PO43–.
Формула вещества Na3PO4.
Слайд 7
Пример 2.
Докажите, что водный раствор вещества является раствором
этилового спирта.
А н а л и з
Формула этилового спирта
(этанола) — C2H5OH. Относится к классу предельных одноатомных спиртов. Качественные реакции на предельные одноатомные спирты — взаимодействие с оксидом меди (II) с образованием альдегида и образование сложных эфиров, имеющих характерный запах и нерастворимых в воде, с кислородсодержащими кислотами.
Слайд 8
Р е ш е н и е
1) Отбираем
небольшую порцию раствора (говорят: «отбираем пробу»). Прокаливаем в пламени
в медную проволоку, свёрнутую в спираль, до прекращения окрашивания пламени, в результате проволока покрывается слоем оксида меди (II) чёрного цвета. Вносим нагретую проволоку в отобранную пробу и наблюдаем: чёрная окраска исчезает, спираль приобретает красный цвет и появляется характерный запах уксусного альдегида:CH3CH2OH + CuO → CH3CHO + Cu + H2O.
Вывод: вещество является этиловым спиртом.
Слайд 9
Р е ш е н и е
2) Отбираем
пробу раствора, добавляем в неё уксусную кислоту, несколько капель
концентрированной серной кислоты (катализатор) и нагреваем, в результате появляется характерный запах сложного эфира этилацетата. После охлаждения наблюдаем на поверхности жидкости слой нерастворимого в воде сложного эфира.CH3CH2OH + CH3COOH CH3COOC2H5 + H2O
Вывод: в растворе содержится этиловый спирт.
Слайд 10
Различить вещества
— это значит провести превращения, которые отличаются признаками протекания реакций или свойствами продуктов реакции. Для решения подобных заданий недостаточно знать только качественные реакции, необходимо учитывать химические и физические свойства веществ.
Слайд 11
Пример 3.
С помощью каких реактивов можно различить этилацетат
и толуол?
1) бромная вода
2) метилоранж (р‑р)
3) хлорид железа (III)
(р‑р)4) гидроксид натрия (р‑р)
Слайд 12 А н а л и з и р
е ш е н и е
Этилацетат CH3COOC2H5 — сложный
эфир уксусной кислоты и этилового спирта. Бесцветная жидкость с приятным запахом, нерастворимая в воде. Сложные эфиры не проявляют кислотно-оснόвных свойств и не окрашивают индикаторы. Вступают в реакции восстановления и гидролиза.Толуол C6H5CH3 — ароматический углеводород. Бесцветная жидкость с приятным запахом, нерастворимая в воде. Вступает в реакции замещения атома водорода в ароматическом кольце (в присутствии катализаторов) и боковой цепи (при освещении), окисляется по боковой цепи. Не проявляет кислотно-оснόвных свойств.
Слайд 13 Бромная вода — реагент, используемый для определения кратных
углерод-углеродных связей, фенола и анилина (обесцвечивание бромной воды).
Вывод:
ни со сложным эфиром этилацетатом, ни с толуолом не взаимодействует, т.е. видимых различий в поведении веществ не будет наблюдаться.Метилоранж — индикатор, используется для определения кислот.
Вывод: видимых изменений не произойдёт.
Хлорид железа (III) — реагент, используемый для определения фенолов.
Вывод: видимых изменений не произойдёт.
Гидроксид натрия реагирует с кислотами, аминокислотами и фенолами с образованием солей, используется для осуществления щелочного гидролиза различных производных.
CH3COOC2H5 + NaOH (р‑р) → CH3COONa + C2H5OH
C6H5CH3 + NaOH (р‑р) ≠
Вывод: вещества различаются по реакционной способности. При добавлении этилацетата (нерастворимое в воде вещество) в раствор щёлочи происходит гидролиз и образуются растворимые продукты реакции, при добавлении толуола в раствор щёлочи изменений наблюдаться не будет.
Ответ: 4.
Слайд 14
Пример 4.
Установите соответствие между веществами и реагентом, с
помощью которого их можно отличить друг от друга.
Слайд 15 А н а л и з и р
е ш е н и е
А) Ацетилен CH≡CH —
непредельный углеводород с тройной связью. Вступает в реакции присоединения водорода, галогенов (обесцвечивает бромную и йодную воду), галогеноводородов, воды и некоторых других веществ, легко окисляется (обесцвечивает раствор KMnO4) и в присутствии катализаторов образует продукты полимеризации. Щелочные металлы, Ag2O(NH3 р‑р), [Cu(NH3)2]Cl могут замещать атом водорода в группе ≡С–Н.Этилен CH2=CH2 — непредельный углеводород с двойной связью. Вступает в реакции присоединения водорода, галогенов, галогеноводородов, воды и некоторых других веществ, легко окисляется раствором KMnO4 и вступает в реакцию полимеризации. Металлы не замещают атомы водорода у групп CH2.
Вывод: оба вещества могут реагировать с бромной водой (ответ 1) и не реагируют с Al(OH)3 (ответ 3), соляной кислотой (ответ 4), Cu(OH)2 (ответ 5). Вещества отличаются реакционной способностью по отношению к аммиачному раствору оксида серебра [Ag(NH3)2]OH: ацетилен образует ацетиленид серебра
C2H2 + 2[Ag(NH3)2OH → C2Ag2 + 4NH3 + 2H2O,
C2H4 + 2[Ag(NH3)2OH ≠ (этилен не реагирует).
Ответ: А — 2.
Слайд 16 Б) Пропилен CH3–CH=CH2 – непредельный углеводород с одной
двойной cвязью. Вступает в реакции присоединения водорода, галогенов
(обесцвечивает растворы брома и йода), галогеноводородов, воды и некоторых других веществ, легко окисляется раствором KMnO4 и вступает в реакцию полимеризации.Пропан CH3–CH2–CH3 – предельный углеводород. Вступает в реакции замещения атома водорода при облучении, горения, дегидрирования.
Вывод: вещества отличаются реакционной способностью по отношению к бромной воде: пропилен её обесцвечивает, пропан – не реагирует.
CH3–CH=CH2 + Br2(раствор) → CH3–CHBr–CH2Br
CH3–CH2–CH3 + Br2 (вещества не взаимодействуют)
Ответ: Б – 1.
Слайд 17 В) Пропандиол-1,2 CH3–CHOH–CH2OH – многоатомный спирт предельного ряда.
Вступает в реакции замещения атома водорода со щелочными металлами
и кислородсодержащими кислотами (образуются сложные эфиры), замещения группы OH на галоген (при взаимодействии с галогеноводородами и некоторыми другими веществами), может окисляться. Особенность многоатомных спиртов, отличающая их от спиртов одноатомных, –растворение Cu(OH)2 с образованием раствора ярко-синего цвета качественная реакция).Пропанол-2 CH3–CHOH–CH3 – предельный одноатомный спирт. Не реагирует с Cu(OH)2.
Вывод: ответ В – 5.
Слайд 18 Г) Фенол C6H5OH — гидроксильное производное ароматического углеводорода,
в котором группа OH соединена с ароматическим кольцом. Реагирует
со щелочами и щелочными металлами, замещая атом водорода в группе OH. Легко окисляется и вступает в реакции электрофильного замещения атомов водорода ароматического кольца, обесцвечивая бромную воду.Этанол CH3CH2OH — предельный одноатомный спирт. Реагирует со щелочными металлами с выделением водорода и кислородсодержащими кислотами с образованием сложных эфиров. Вступает в реакции окисления и замещения группы OH, не реагирует с бромной
водой.
Вывод: ответ: Г — 1.
Ответ: 2151.
Слайд 19
Пример 5.
Установите соответствие между веществами и признаком протекающей
между ними реакции.
Слайд 20 А) 2Na3[Cr(OH)6] + 3H2O2 = 2NaOH + 2Na2CrO4
+ 8H2O
Na3[Cr(OH)6] – растворимое вещество зелёного цвета,
Na2CrO4 – растворимое вещество жёлтого цвета.
Вывод: происходит изменение окраски раствора,
ответ: А – 4.
Б) 2Fe(OH)2 + H2O2 = 2Fe(OH)3
Fe(OH)2 – нерастворимое вещество белого (светло-зелёного цвета),
Fe(OH)3 – нерастворимое вещество бурого цвета.
Вывод: происходит изменение окраски осадка, ответ: Б – 1.
Слайд 21 В) Fe(OH)2 + 2HCl (разб.) = FeCl2 +
2H2O
Fe(OH)2 – нерастворимое вещество светло-зелёного цвета,
FeCl2 – растворимое вещество. Вывод: происходит растворение осадка, ответ: В – 2.
Г) Fe(OH)3 + 3HNO3(конц.) = Fe(NO3)3 + 3H2O
Fe(OH)3 – нерастворимое вещество бурого цвета,
Fe(NO3)3 – растворимое вещество бурого цвета.
Вывод: происходит растворение осадка, ответ: Г – 2.
Ответ: 4122.
Слайд 22 ЕГЭ (вопрос В6): Качественные реакции на неорганические вещества
и ионы. Качественные реакции органических соединений
Слайд 23 1. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
A) CuCl2 + 2KOH
= Cu(OH)2↓ + 2KCl (голубой осадок)NaCl + KOH ≠ (KCl + NaOH) (видимых изменений нет)
Ответ: А – 1.
Слайд 24
Б) NaCl + HCl ≠ (видимых изменений нет)
Na2CO3 + 2HCl = 2NaCl + H2O
+ CO2 (выделяется газ)Ответ: Б – 2.
Слайд 25 В) Ba(NO3)2 + 2KOH ≠ (Ba(OH)2 + 2KNO3)
(видимых изменений нет)
Cu(NO3)2 + 2KOH =
Cu(OH)2↓ + 2KNO3 (голубой осадок)Ответ: В – 1.
Слайд 26
Г) AlCl3 + 3KOH = Al(OH)3↓ + 3KCl
Al(OH)3 + KOH = K[Al(OH)4]
(образуется белый
объёмный осадок, который
растворяется в избытке щёлочи)FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl (бурый осадок)
Ответ: Г – 1.
Слайд 27 2. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
A) CH3COOH + Cu(OH)2
→ CH3COO(CuOH) + H2O (осадок растворяется, соль)
NH2CH2COOH + Cu(OH)2 → комплексное соединение фиолетового цвета
Ответ: А – 5.
Слайд 28 2. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Б) C2H6 + I2(р-р)
≠ (вещества не взаимодействуют, окраска раствора йода не изменяется)
CH2=CH2 + I2(р-р) → CH2I–CH2I (раствор обесцвечивается)
Ответ: Б – 3.
Слайд 29 2. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
В) C6H6 + FeCl3(р-р)
≠ (вещества не взаимодействуют, окраска раствора йода не изменяется)
C6H5OH + FeCl3(р-р) → комплексное соединение
фиолетового цвета Ответ: В – 1.
Слайд 30 2. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Г) C2H5OH + FeCl3(р-р)
≠ (вещества не взаимодействуют, окраска раствора йода не изменяется)
C6H5OH + FeCl3(р-р) → комплексное соединение
фиолетового цвета Ответ: Г – 1.
Слайд 31 3. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
А) 2KMnO4 + 16HCl = 2KCl
+ 2MnCl2 + 5Cl2↑ + 8H2O
KMnO4 имеет малиновый цвет, MnCl2 – бесцветный (очень бледно розовый). Cl2 – газ жёлто-зелёного цвета
Ответ: А – 1. Слайд 32 3. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
Б) Na2CO3 + 2HCl = 2NaCl
+ H2O + CO2↑
Растворы Na2CO3 и HCl не имеют цвета, NaCl – бесцветный. CO2 – бесцветный газ Ответ: А – 1.
Слайд 33 3. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
В) 2NaOH(изб.) + CO2 = Na2CO3
+ H2O илиNaOH + CO2(изб.) = NaHCO3
NaOH, CO2, H2O, Na2CO3, NaHCO3 не имеют цвета Ответ: В – 5.
Слайд 34 3. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
Г) Ca(OH)2(р-р) + 2HNO3(р-р, изб.) =
Ca(NO3)2 + 2H2O Ca(OH)2, HNO3(р-р), Сa(NO3)2, H2O не имеют цвета Ответ: Г – 5.
Слайд 35 4. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А) (NH4)2SO4(р-р) + HOH
NH4HSO4 + NH4OH среда – кислая (раствор содержит больше ионов H+ из
кислой соли, образованной сильной кислотой, чем OH– из слабого основания , лакмус – красный
Na2SO4 + HOH ≠ (гидролиз не происходит)
среда – нейтральная, лакмус - фиолетовый Ответ: А – 1.
Слайд 36 4. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Б) Na2SiO3(р-р) + HOH
NaHSiO3 + NaOH среда – щелочная, лакмус – синий
Na2SO4 + HOH ≠ (гидролиз не происходит)
среда – нейтральная, лакмус - фиолетовый Ответ: Б – 1.
Слайд 37 4. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
В) Ca(OH)2(р-р) – щёлочь
среда – щелочная, лакмус – синий
H2SO4 – кислота
среда – кислая, лакмус – красный Ответ: В – 1.
Слайд 38 4. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Г) KNO3 + NaCl
≠ (KCl + NaNO3) видимых изменений нет
AgNO3 + NaCl = AgCl↓ + NaNO3
образуется белый творожистый осадок Ответ: Г – 2.
Слайд 39 5. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А) C17H35COOH + Br2(р-р)
≠ (не взаимодействуют, стеариновая кислота – предельная кислота, бромную воду не обесцвечивает) видимых изменений нет
C17H33COOH + Br2(р-р) → C17H33Br2COOH
олеиновая кислота непредельная (имеет одну С=С связь) и реагирует с бромом (бромной водой),
Раствор обесцвечивается Ответ: А – 1.
Слайд 40 5. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Б) C3H7OH + CuO
→ CH3CH2CHO + Cu + H2OПервичные (и вторичные) спирты окисляются оксидом меди (II) с образованием альдегидов (или кетонов). Наблюдаем образованием меди красного цвета
CH3–CO–CH3 + CuO ≠
Ответ: Б – 3.
Слайд 41 5. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
В) (CH3)2CHOH + CuO
→ (CH3)2CHCHO + Cu + H2OПервичные (и вторичные) спирты окисляются оксидом меди (II) с образованием альдегидов (или кетонов). Наблюдаем образованием меди красного цвета
CH3–CO–CH3 + CuO ≠
Ответ: В – 3.
Слайд 42 5. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Г) CH3NH2 + HOH
→ CH3NH3OHCH3NH3OH – гидроксид метиламмония проявляется оснόвные свойство и окрашивает лакмус в синий цвет
C3H8 + HOH ≠ (
алканы не обладают кислотно-основными свойствами
Ответ: Г – 3.
Слайд 43 6. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
А) CH3–CH=CH2 + Br2(р-р) → CH3–CHBr–CH2Br
Бром реагирует, раствор обесцвечиваетсяОтвет: А – 2.
Слайд 44 6. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
Б) C6H5OH + FeCl3(р-р) → появляется
фиолетовое окрашиваниеОтвет: Б – 3.
Слайд 45 6. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
В) 2C2H5OH + 2Na → 2C2H5ONa
+ H2↑натрий растворяется, выделяется газ
Ответ: В – 1.
Слайд 46 6. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
Г) 2CH3COOH + Na2CO3 → 2CH3COONa
+ H2O + CO2↑И CH3COOH, и Na2CO3, и CH3COONa не имеют окраски, выделяется газ
Ответ: В – 1.
Слайд 47 7. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А) Zn + 2KOH
+ 2H2O = K2[Zn(OH)4] + H2↑цинк растворяется в щелочах с выделением водорода
Fe + KOH ≠
Ответ: А – 1.
Слайд 48 7. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Б) KOH – щёлочь,
окрашивает лакмус в синий цветHCl – кислота, окрашивает лакмус в красный цвет
Ответ: Б – 3.
Слайд 49 7. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
В) CH3COONa + HOH
CH3COOH + NaOHNaOH – щёлочь, окрашивает лакмус в синий цвет
NaHSO4 Na+ + HSO4–
HSO4– H+ + SO42–
окрашивает лакмус в красный цвет
Ответ: В – 3.
Слайд 50 7. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Г) Na2SO4 + HOH
≠гидролиз не происходит, среда – нейтральная, лакмус - фиолетовый
Na2SO3 + HOH NaHSO3 + NaOH
NaOH – щёлочь, окрашивает лакмус в синий цвет
Ответ: Г – 3.
Слайд 51 8. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А) (CH3)2NH + HNO3
→ (CH3)2NH2NO3Газ будет поглощаться в растворе азотной кислоты
C3H8 + HNO3 ≠
Ответ: А – 2.
Слайд 52 8. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Б) C6H6 + FeCl3(р-р)
≠ вещества не взаимодействуют, изменений нетC6H5OH + FeCl3(р-р) → фиолетовое окрашивание
Ответ: Б – 1.
Слайд 53 8. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
В) CH3CHO + 2Cu(OH)2
→ CH3COOH + 2Cu2O + 2H2OCu(OH)2 – синего цвета, Cu2O – красного цвета
CH3CH2OH + Cu(OH)2 ≠
Спирты не окисляются гидроксидом меди (II)
Ответ: В – 4.
Слайд 54 8. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
Г) CH3COOCH3 + 2Cu(OH)2
≠Сложные эфиры не окисляются гидроксидом меди (II)
CH2OH–CH2OH + Cu(OH)2 → комплексное соединение фиолетового цвета
Ответ: Г – 4.
Слайд 55 9. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
А) K3[Cr(OH)6] + H2O2 → K2CrO4
+ H2OK3[Cr(OH)6] – растворимое вещество зелёного цвета, K2CrO4 – растворимое вещество жёлтого цвета
Ответ: А – 4.
Слайд 56 9. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
Б) 2Fe(OH)2 + H2O2 = 2Fe(OH)3
Fe(OH)2 – нерастворимое вещество белого цвета, Fe(OH)3 – нерастворимое вещество бурого цвета
Ответ: Б – 1.
Слайд 57 9. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
В) Fe(OH)2 + 2HBr = FeCl2
+ 2H2OFe(OH)2 – нерастворимое вещество белого цвета,
FeBr2 – растворимое вещество белого цвета
Ответ: В – 2.
Слайд 58 9. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
Г) Fe(OH)3 + 3HNO3 = Fe(NO3)3
+ 3H2OFe(OH)3 – нерастворимое вещество бурого цвета,
Fe(NO3)3 – растворимое вещество бурого цвета
Ответ: Г – 2.
Слайд 59 10. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
А - 1
Б - 3
В -
3Г - 3
Слайд 60 11. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А - 2
Б -
1В - 2
Г - 3
Слайд 61 12. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
А - 3
Б - 4
В -
5Г - 5
Слайд 62 13. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А - 1
Б -
4В - 2
Г - 1
Слайд 63 14. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А – 2
Б
– 1 В – 5
Г – 1
Слайд 64 15. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
А – 5
Б – 1
В – 3
Г – 2
Слайд 65 16. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А – 3
Б
– 1 В – 1
Г – 2
Слайд 66 17. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А – 3
Б
– 2 В – 1
Г – 2
Слайд 67 18. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А – 5
Б
– 1 В – 2
Г – 3
Слайд 68 19. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции
А – 4
Б – 1
В – 4
Г – 3
Слайд 69 20. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А – 3
Б
– 4 В – 5
Г – 1
Слайд 70 21. Установите соответствие между веществами и реагентом, с
помощью которого можно различить эти вещества.
А – 1
Б
– 3 В – 2
Г – 3
Слайд 71 22. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 2
Б – 3
В – 2
Г – 2
Слайд 72 23. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 4
Б – 5
В – 4
Г – 5
Слайд 73 24. Установите соответствие между реагирующими веществами и признаком
реакции, которая протекает между ними.
А – 5
Б –
3 В – 2
Г – 1
Слайд 74 25. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 3
Б – 3
В – 3
Г – 4
Слайд 75 26. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 4
Б – 2
В – 5
Г – 1
Слайд 76 27. Установите соответствие между реагирующими веществами и признаком
реакции, которая протекает между ними.
А – 1
Б –
3 В – 5
Г – 2
Слайд 77 28. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 5
Б – 4
В – 1
Г – 3
Слайд 78 29. Установите соответствие между двумя веществами и реагентом,
с помощью которого можно различить эти вещества.
А – 4
Б – 4
В – 2
Г – 5
Слайд 79 30. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 3
Б – 5
В – 5
Г – 2
Слайд 80 31. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 2
Б – 1
В – 5
Г – 4
Слайд 81 32. Установите соответствие между веществом и реактивом, с
помощью которого можно определить это вещества.
А – 1
Б
– 1 В – 1
Г – 3
Слайд 82 33. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 5
Б – 5
В – 1
Г – 2
Слайд 83 34. Установите соответствие между реагирующими веществами и признаком
реакции, которая протекает между ними.
А – 4
Б –
2 В – 3
Г – 4
Слайд 84 35. Установите соответствие между реагирующими веществами и признаком
реакции, которая протекает между ними.
А – 5
Б –
1 В – 4
Г – 3
Слайд 85 36. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 3
Б – 3
В – 4
Г – 3
Слайд 86 37. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 2
Б – 3
В – 1
Г – 5
Слайд 87 38. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 1
Б – 3
В – 1
Г – 5
Слайд 88 39. Установите соответствие между веществом и реактивом, с
помощью которого можно определить это вещества.
А – 4
Б
– 5 В – 3
Г – 3
Слайд 89 40. Установите соответствие между реагирующими веществами и признаком
реакции, которая протекает между ними.
А – 2
Б –
5 В – 1
Г – 5
Слайд 90 41. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 4
Б – 1
В – 2
Г – 4
Слайд 91 42. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 1
Б – 2
В – 4
Г – 1
Слайд 92 43. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 3
Б – 5
В – 5
Г – 3
Слайд 93 44. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 1
Б – 4
В – 2
Г – 5
Слайд 94 45. Установите соответствие между реагирующими веществами и признаком
реакции, которая протекает между ними.
А – 3
Б –
1 В – 3
Г – 5
Слайд 95 46. Установите соответствие между реагирующими веществами и признаком
реакции, которая протекает между ними.
А – 2
Б –
2 В – 5
Г – 4
Слайд 96 47. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества.
А – 3
Б – 2
В – 5
Г – 5
Слайд 97 48. Установите соответствие между реагирующими веществами и признаком
реакции, которая протекает между ними.
А – 2
Б –
4 В – 5
Г – 2
Слайд 98 ГИА (вопрос В3): Определение характера среды раствора кислот
и щелочей с помощью индикаторов. Качественные реакции на ионы
в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак)
Слайд 99
Пример 1.
Установите соответствие между формулами двух веществ
и реактивом, с помощью которого можно различить эти вещества.
Слайд 100
Пример 1.
Анализ и решение
А) Хлороводород HCl –
ядовитый бесцветный газ с резким запахом, очень хорошо растворимый
в воде (хлороводородная, или соляная, кислота). Качественная реакция на хлорид-ионы – образование белого творожистого осадка хлорида серебра AgCl, нерастворимого в кислотах и азотной кислоте.HCl + AgNO3 = HNO3 + AgCl↓
Ag+ + Cl– = AgCl
HCl + CuCl2 ≠
HCl + KOH = KCl + H2O
HCl + Na2SO4 ≠
Слайд 101
Пример 1.
Анализ и решение
А) Азотная кислота HNO3
– жидкость с резким запахом, концентрированная кислота «дымит» на
воздухе. Качественная реакция на HNO3 и нитраты - выделение «бурого» газа (оксид азота (IV)) при взаимодействии с тяжёлыми металлами (медью, серебром и др.).4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2↑ + 2H2O
HNO3 + CuCl2 ≠
HNO3 + KOH = KNO3 + H2O
HNO3 + AgNO3 ≠
HNO3 + Na2SO4 ≠
Вывод: вещества отличаются реакционной способностью (признаками взаимодействия) по отношению к AgNO3. Ответ: А – 3.
Слайд 102
Пример 1.
Б) Гидроксид натрия NaOH – бесцветное
твёрдое вещество, хорошо растворимое в воде (раствор – щёлочь).
Качественная реакция на Na+ – окрашивание пламени в жёлтый цвет. Щёлочи определяют с помощью индикаторов: лакмус окрашивается в синий цвет, фенолфталеин – в малиновый.2NaOH + CuCl2 = 2NaCl + Cu(OH)2↓ (голубой осадок)
Cu2+ + 2OH– = Cu(OH)2
NaOH + KOH ≠
2NaOH + 2AgNO3 = 2NaNO3 + Ag2O↓ + H2O (чёрный осадок)
2Ag+ + 2OH– = Ag2O + H2O
NaOH + Na2SO4 ≠
Слайд 103
Пример 1.
Б) Гидроксид бария Ba(OH)2 – вещество
белого цвета, хорошо растворимое в воде(раствор Ba(OH)2 (баритовая вода)
– щёлочь). Качественная реакция на Ba2+ – образование нерастворимого в кислотах сульфата бария, вещества белого цвета.Ba(OH)2 + CuCl2 = BaCl2 + Cu(OH)2↓ (синий осадок)
Cu2+ + 2OH– = Cu(OH)2
Ba(OH)2 + KOH ≠
Ba(OH)2 + 2AgNO3 = Ba(NO3)2 + Ag2O↓ + H2O (чёрный осадок)
2Ag+ + 2OH– = Ag2O + H2O
Ba(OH)2 + Na2SO4 = BaSO4↓ + 2NaOH (белый осадок)
Ba2+ + SO42– = BaSO4
Вывод: вещества отличаются признаками при взаимодействии с Na2SO4.
Ответ: Б – 4.
Слайд 104
Пример 1.
В) Хлорид аммония NH4Cl – вещество
белого цвета, хорошо растворимое в воде. Качественная реакция на
катион аммония NH4+ – выделение аммиака при действии щелочей.NH4Cl + CuCl2 ≠
NH4Cl + KOH = NH3↑ + H2O + KCl (запах, индикаторная бумага)
NH4+ + OH– = NH3 + H2O
NH4Cl + AgNO3 = NH4NO3 + AgCl↓ (белый творожистый осадок)
Ag+ + Cl– = AgCl
NH4Cl + Na2SO4 ≠
Слайд 105
Пример 1.
В) Хлорид натрия NaCl – твёрдое
вещество белого цвета, хорошо растворимое в воде
NaCl
+ CuCl2 ≠NaCl + KOH ≠
NaCl + AgNO3 = NaNO3 + AgCl↓ (белый осадок)
Ag+ + Cl– = AgCl
NaCl + Na2SO4 ≠
Вывод: вещества отличаются по реакционной способности по отношению к KOH. Ответ: В – 2.
Слайд 106
Пример 2.
Установите соответствие между реагирующими веществами и
признаком их взаимодействия.
Слайд 107
Пример 2.
А) 2HCl(р-р) + Ba(OH)2(р-р) = BaCl2(р-р)
+ 2H2O Вывод: как исходные вещества, так и продукты хорошо
растворимы в воде, видимых признаков реакции (образования осадка или растворения исходного вещества, выделения газа, изменения цвета) – нет. Ответ: А – 4.Б) HCl(г) + NH3(г) = NH4Cl(тв.) Вывод: при взаимодействии двух газообразных веществ образуется твёрдое вещество, частицы которого будут находиться в воздухе, т.е. образуется дым. Ответ: Б – 1.
В) Li2CO3(р-р) + H2SO4(р-р) = Li2SO4(р-р) + H2O + CO2↑ Вывод: при смешивании растворов будет выделяться газ. Ответ В: – 3.
Слайд 108 1. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества. К каждому
элементу первого столбца подберите соответствующий элемент из второго столбца.А – 1
Б – 2
В – 1
Слайд 109 2. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества. К каждому
элементу первого столбца подберите соответствующий элемент из второго столбца.А – 4
Б – 2
В – 1
Слайд 110 3. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции.
А – 1
Б – 1
В – 4
Слайд 111 4. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества. К каждому
элементу первого столбца подберите соответствующий элемент из второго столбца.А – 1
Б – 2
В – 4
Слайд 112 5. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества. К каждому
элементу первого столбца подберите соответствующий элемент из второго столбца.А – 3
Б – 2
В – 4
Слайд 113 7. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества. К каждому
элементу первого столбца подберите соответствующий элемент из второго столбца.А – 2
Б – 4
В – 3
Слайд 114 6. Установите соответствие между определяемым ионом и реагентом,
с помощью которого ион можно определить.
А – 3
Б
– 4 В – 2
Слайд 115 8. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества. К каждому
элементу первого столбца подберите соответствующий элемент из второго столбца.А – 1
Б – 2
В – 3
Слайд 116 9. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции.
А – 1
Б – 3
В – 3
Слайд 117 10. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества. К каждому
элементу первого столбца подберите соответствующий элемент из второго столбца.А – 2
Б – 3
В – 3
Слайд 118 11. Установите соответствие между двумя веществами и реактивом,
с помощью которого можно различить эти вещества. К каждому
элементу первого столбца подберите соответствующий элемент из второго столбца.А – 2
Б – 4
В – 1
Слайд 119 12. Установите соответствие между реагирующими веществами и признаком
протекающей между ними реакции.
А – 3
Б – 4
В – 1





























