- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Исходная презентация Подгруппа галогенов для подготовки урока химии на повышенном уровне
Содержание
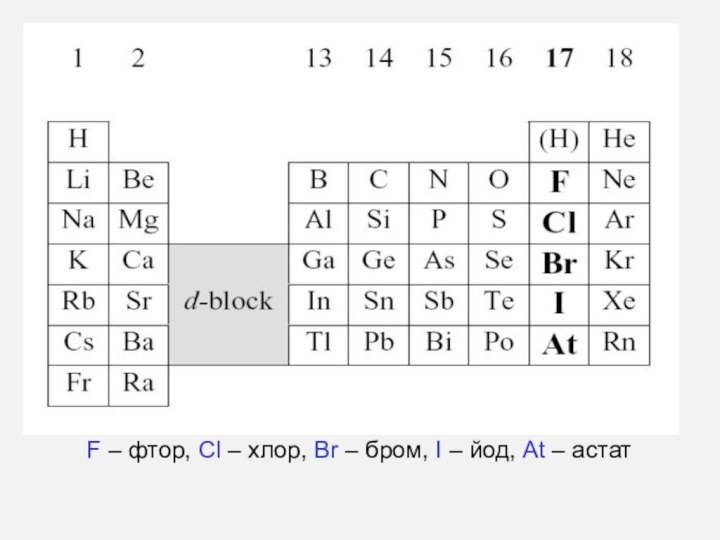
- 2. Элементы 17 группыF – фтор, Cl –
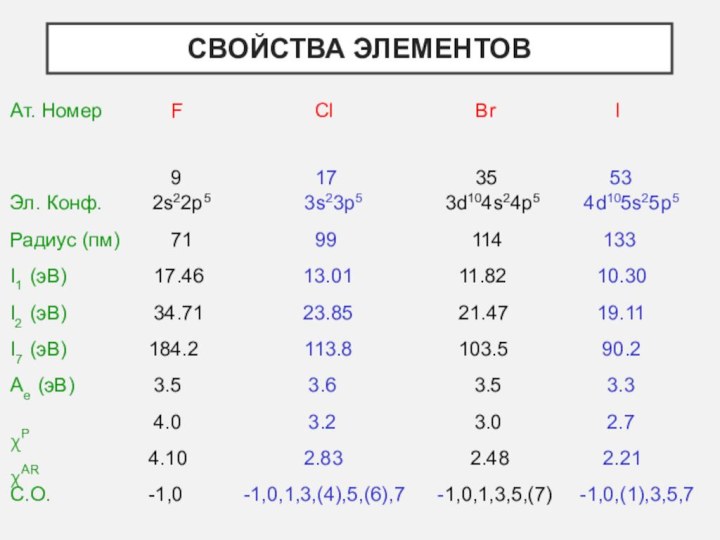
- 3. Свойства элементов
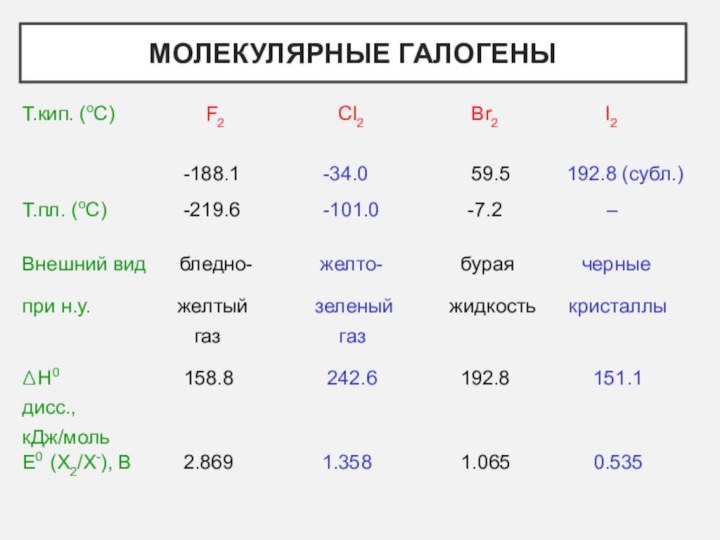
- 4. Молекулярные галогены
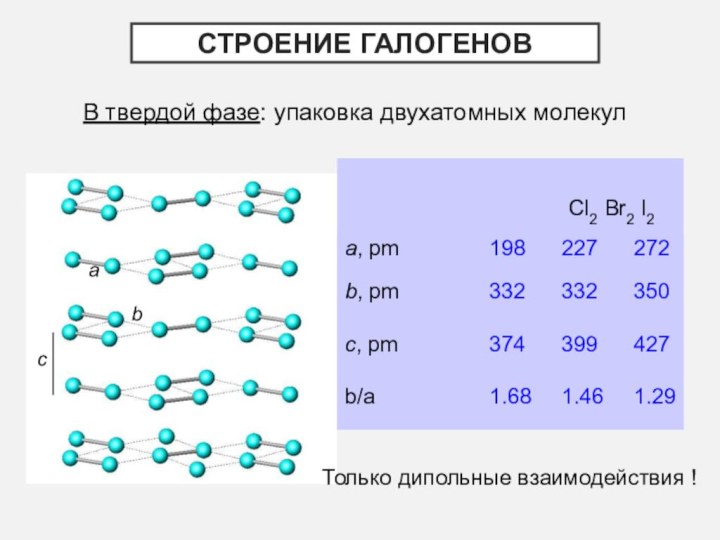
- 5. В твердой фазе: упаковка двухатомных молекулCl2 Br2 I2ab cСтроение галогеновТолько дипольные взаимодействия !
- 6. Химические свойства галогеновF2 Cl2 Br2I21. Окислителиослабление окислительных свойствокислителями
- 7. Реакции галогенов1.2.F2 + Xe = XeF2(+ XeF4
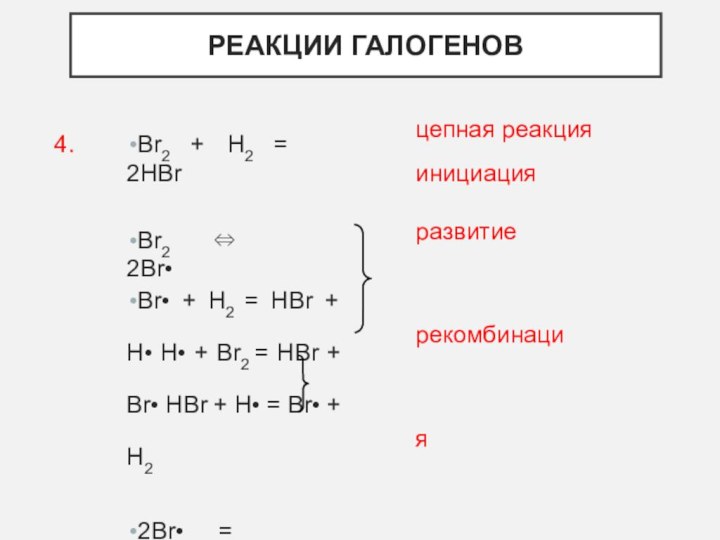
- 8. Br2 + H2 = 2HBrBr2 ⇔ 2Br•Br•
- 9. Реакции галогенов5.2F2 + 2H2O = 4HF +
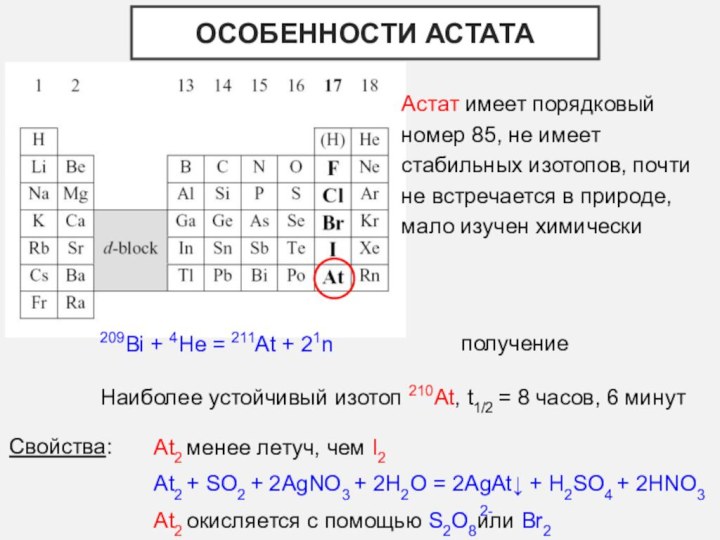
- 10. Особенности астатаАстат имеет порядковый номер 85, не
- 11. Получение галогеновФтор получают электролизом HF в расплаве
- 12. Применение галогеновФторв ядерной промышленности (UF6)в металлургии (CaF2),
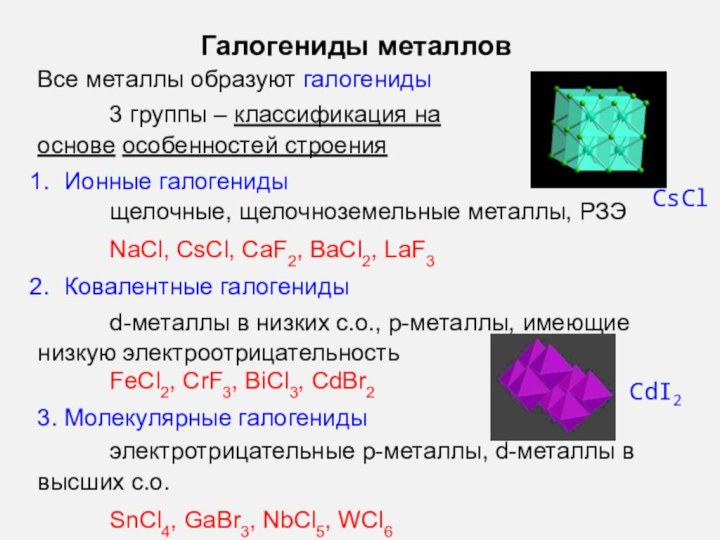
- 13. Галогениды металловВсе металлы образуют галогениды3 группы –
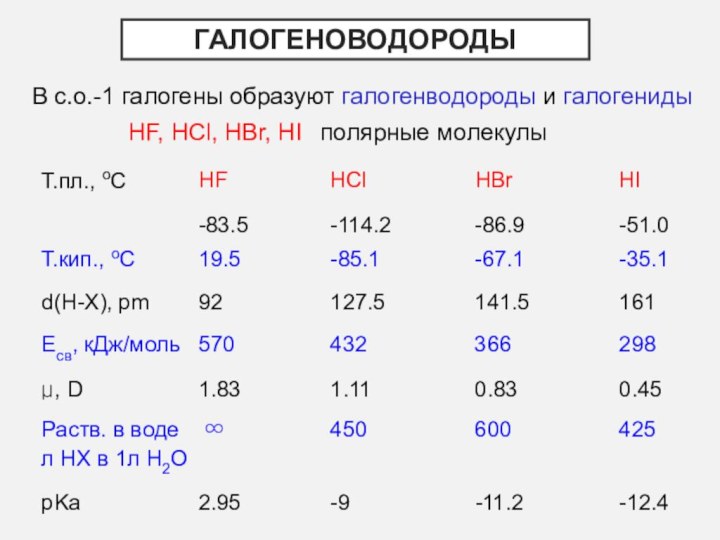
- 14. ГалогенОводородыВ с.о.-1 галогены образуют галогенводороды и галогенидыHF, HCl, HBr, HI полярные молекулы
- 15. Свойства кислот НХСильные кислотыHF < HCl <
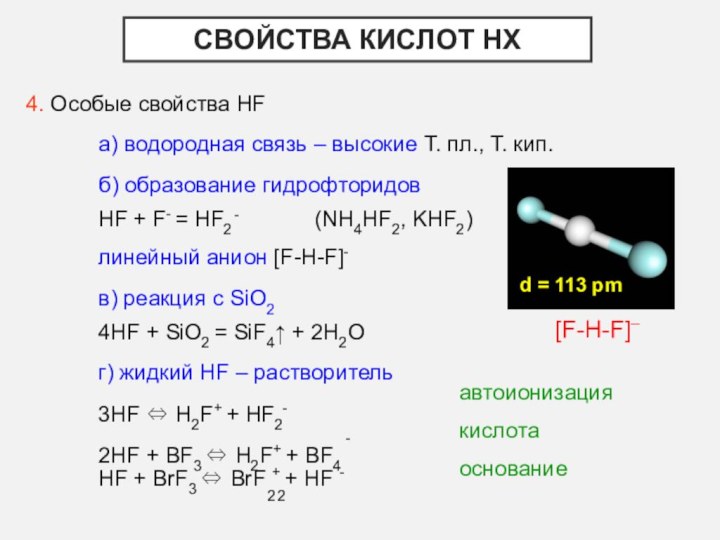
- 16. Свойства кислот НХ4. Особые свойства HFа) водородная
- 17. Получение НХРеакция H2 + X2 = 2HX
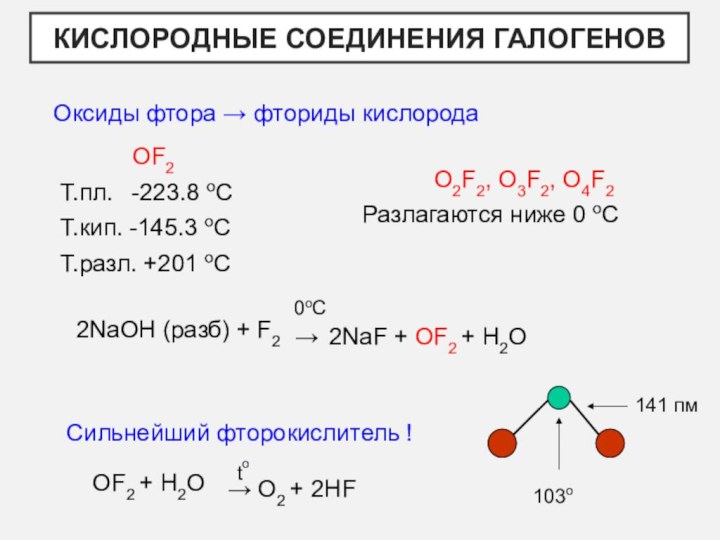
- 18. Кислородные соединения галогеновОксиды фтора → фториды кислородаOF2Т.пл. -223.8
- 19. Обзор оксидов Cl, Br, ICl2O6Cl2O7
- 20. Оксиды хлорагазгазCl2O2Cl2 + 3HgO = Hg3O2Cl2 +
- 21. Оксиды хлораClO22KClO3 + 2H2C2O4 = 2ClO2 +
- 22. Оксиды хлораCl2O6 (ClO3)ClO2 + O3 = ClO3
- 23. «Пентаоксид» йодаI2O52HIO3 ⇔ I2O5 + H2O2I2 +
- 24. Кислородные кислоты галогенов1. Общие сведения (обзор кислот)2.
- 25. Кислородные кислоты Cl, Br, I
- 26. Кислородные кислоты Cl, Br, I1. HOX существуют
- 27. Кислородные кислоты Cl, Br, I3. HClO3, HBrO3
- 28. Кислородные кислоты Cl, Br, I4. HClO4 –
- 29. Сравнение силы кислотHClOHClO2 HClO3HClO4Основной процесс – смещение электронной
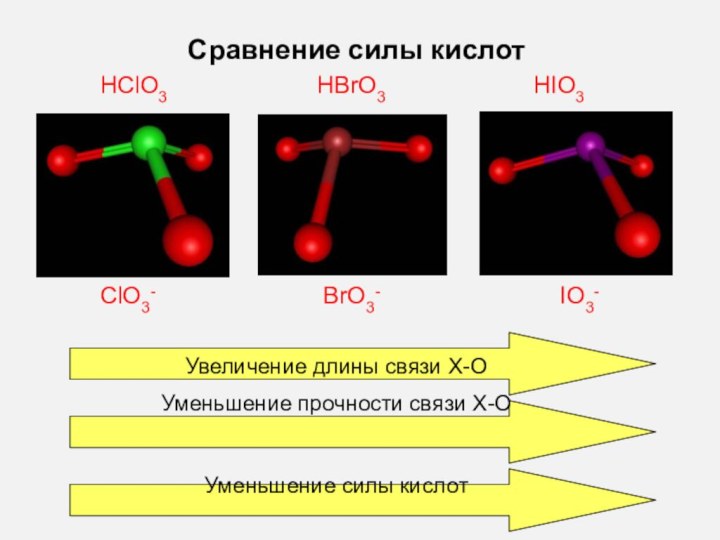
- 30. Сравнение силы кислотHBrO3HClO3HIO3ClO3-BrO3-IO3-Увеличение длины связи Х-ОУменьшение прочности связи Х-О Уменьшение силы кислот
- 31. Red/Ox способность кислот и оснований1. Все кислоты
- 32. Red/Ox способность кислот и основанийВ с.о. +7
- 33. Соли кислородных кислот Cl, Br, I1. Гипохлориты:2KOH
- 34. Соли кислородных кислот Cl, Br, I3. Хлораты,
- 35. Скачать презентацию
- 36. Похожие презентации













Слайд 5
В твердой фазе: упаковка двухатомных молекул
Cl2 Br2 I2
a
b c
Строение галогенов
Только
дипольные взаимодействия !
Слайд 6
Химические свойства галогенов
F2 Cl2 Br2
I2
1. Окислители
ослабление окислительных свойств
окислителями
Слайд 7
Реакции галогенов
1.
2.
F2 + Xe = XeF2
(+ XeF4 +
XeF6)
5Cl2 + 2Sb = 2SbCl5
2Cl2 + Zr = ZrCl4
Cl2 + Cu = CuCl2горение
горение при 250 оС
(но не CuCl)
Br2 (ж) + Hg (ж) = HgBr2 (тв) 2Al + 3I2 = 2AlI3
2I2 + Sn = SnI4 H2 + I2 ⇔ 2HI
CCl4/60oC
обратимая реакция
= +1.8 кДж/моль
3.
ΔfG0
298
Слайд 8
Br2 + H2 = 2HBr
Br2 ⇔ 2Br•
Br• +
H2 = HBr + H• H• + Br2 =
HBr + Br• HBr + H• = Br• + H22Br• = Br2
2H• = H2
4.
цепная реакция инициация
развитие рекомбинация
Реакции галогенов
Слайд 9
Реакции галогенов
5.
2F2 + 2H2O = 4HF + O2
20oC
X2
+ H2O ⇔ H+ + X- + HOX
20oC
K =
4.2·10-4 K = 7.2·10-9 K = 2.0·10-13X2 + 2OH- ⇔ X- + OX- H2O
K = 7.5·1015 K = 2·103
K = 30
X = Cl X = Br X = I
20oC
X = Cl X = Br X = I
Для X = Br, I:
3OX- ⇔ 2X- + XO3
-
очень быстрая реакция
Слайд 10
Особенности астата
Астат имеет порядковый номер 85, не имеет
стабильных изотопов, почти не встречается в природе, мало изучен
химически209Bi + 4He = 211At + 21n
получение
Наиболее устойчивый изотоп 210At, t1/2 = 8 часов, 6 минут
Свойства:
At2 менее летуч, чем I2
At2 + SO2 + 2AgNO3 + 2H2O = 2AgAt↓ + H2SO4 + 2HNO3
At2 окисляется с помощью S2O8 или Br2
2-
Слайд 11
Получение галогенов
Фтор получают электролизом HF в расплаве KHF2
или разложением высших фторидов
2CeF4 = 2CeF3 + F2
Хлор получают
окислением HCl (в лаборатории) …KMnO4(тв) + 16HCl(к) + 2KCl = K3MnCl6 + 2Cl2 + 4H2O
… и в хлорщелочном производстве (в промышленности)
2NaCl + 2H2O = Cl2 + 2NaOH + H2
Анод Катод
электролиз
Бром и йод получают вытеснением хлором из солей
2KBr + Cl2 = 2KCl + Br2
2KI + Cl2 = 2KCl + I2
Слайд 12
Применение галогенов
Фтор
в ядерной промышленности (UF6)
в металлургии (CaF2), в
химическом синтезе (HF, BrF3)
в холодильном деле (CF2Cl2, …)
Хлор
в органическом
и полимерном синтезе (ПВХ, …)в химической промышленности (галогениды)
в очистке воды и как отбеливатель (Cl2)
в органическом синтезе (Br2)
в фотографии (AgBr), в фармацевтике
Бром
Йод
в металлургии (I2)
для деревообработки (KI, KI3)
в аналитике (иодометрия)
в пищевых добавках (NaI)
Слайд 13
Галогениды металлов
Все металлы образуют галогениды
3 группы – классификация
на основе особенностей строения
Ионные галогениды
щелочные, щелочноземельные металлы, РЗЭ
NaCl, CsCl,
CaF2, BaCl2, LaF3Ковалентные галогениды
d-металлы в низких с.о., p-металлы, имеющие низкую электроотрицательность
FeCl2, CrF3, BiCl3, CdBr2
3. Молекулярные галогениды
электротрицательные р-металлы, d-металлы в высших с.о.
SnCl4, GaBr3, NbCl5, WCl6
CsCl
CdI
2
Слайд 14
ГалогенОводороды
В с.о.-1 галогены образуют галогенводороды и галогениды
HF, HCl,
HBr, HI полярные молекулы
Слайд 15
Свойства кислот НХ
Сильные кислоты
HF < HCl < HBr
< HI сила кислот Причина: уменьшение Есв в ряду HF→HI
⇒уменьшение электростатического взаимодействия Н3О+ и Х- ⇒
увеличение способности к диссоциации
Восстановители (кроме HF)
4HCl(к) + MnO2(тв) = Cl2 + MnCl2 + 2H2O
2HI + 2FeCl3 = 2FeCl2 + I2 + 2HCl
Образование азеотропных смесей с водой
Слайд 16
Свойства кислот НХ
4. Особые свойства HF
а) водородная связь
– высокие Т. пл., Т. кип.
б) образование гидрофторидов
HF +
F- = HF2-
(NH4HF2, KHF2)
линейный анион [F-H-F]-
в) реакция с SiO2
4HF + SiO2 = SiF4↑ + 2H2O
г) жидкий HF – растворитель
3HF ⇔ H2F+ + HF2-
2HF + BF3 ⇔ H2F+ + BF4
автоионизация кислота основание
-
HF + BrF3 ⇔ BrF + + HF -
2 2
d = 113 pm
[F-H-F]–
Слайд 17
Получение НХ
Реакция H2 + X2 = 2HX не
используется в лаборатории
1.
2.
CaF2 + H2SO4(к) = CaSO4 + 2HF
KCl(тв) + H2SO4(к) = KHSO4 + HClKBr(тв) + H2SO4(к) = KHSO4 + HBr
(to)
(to)
3.
2KBr(тв) + 3H2SO4(к) = 2KHSO4 + Br2 + SO2 + 2H2O
KBr(тв) + H3PO4(85%) = KH2PO4 + HBr
PBr3 + 3H2O = H3PO3 + 3HBr
KI(тв) + H3PO4(85%) = KH2PO4 + HI
I2 + H2S = S + 2HI
(to)
4.
(to)
Слайд 18
Кислородные соединения галогенов
Оксиды фтора → фториды кислорода
OF2
Т.пл. -223.8 оС
Т.кип.
-145.3 оС
Т.разл. +201 оС
O2F2, O3F2, O4F2
Разлагаются ниже 0 оС
2NaOH
(разб) + F20oC
→ 2NaF + OF2 + H2O
OF2 + H2O
to
→ O2 + 2HF
141 пм
Сильнейший фторокислитель !
103о
Слайд 20
Оксиды хлора
газ
газ
Cl2O
2Cl2 + 3HgO = Hg3O2Cl2 + Cl2O
2Cl2
+ Bi2O3 = 2BiOCl + Cl2O Cl2O + 2KOH
= 2KOCl + H2Oполучение
ангидрид
Слайд 21
Оксиды хлора
ClO2
2KClO3 + 2H2C2O4 = 2ClO2 + 2CO2
+ K2C2O4 + 2H2O
(лаб.)
2NaClO3 + SO2 + H2SO4 =
2NaHSO4 + ClO22ClO2 + H2O = HClO2 + HClO3
2ClO2 + 2NaOH = NaClO2 + NaClO3 + H2O
(пром.)
(2Cl4+ → Cl3+ + Cl5+) (2Cl4+ → Cl3+ + Cl5+)
2ClO2 + Na2O2 = 2NaClO2 + O2
окислитель
ClO2
Парамагнитная молекула
Единственный неспаренный электрон находится на разрыхляющей орбитали ⇒ нет димеризации
Слайд 22
Оксиды хлора
Cl2O6 (ClO3)
ClO2 + O3 = ClO3 +
O2
Димерен в жидкой фазе
Очень сильный окислитель, но легко диспропорционирует
2ClO3
+ H2O = HClO3 + HClO4Cl2O7
2HClO4 + P2O5 = Cl2O7 + 2HPO3
Cl2O7 + H2O = 2HClO4
Очень взрывоопасен !
получение ангидрид
Слайд 23
«Пентаоксид» йода
I2O5
2HIO3 ⇔ I2O5 + H2O
2I2 + 5O2
= 2I2O5
ангидрид
= -158.1 кДж/моль
ΔfH0
298
Единственный термодинамически стабильный оксид галогена, но:
реакция обратима, I2O5 разлагается при 350 0СI2O5 + 5CO = I2 + 5CO2 3I2O5 + H2O = 2HI3O8 HI3O8 + H2O = 3HIO3
окислитель гигроскопичен
Слайд 24
Кислородные кислоты галогенов
1. Общие сведения (обзор кислот)
2. Фторноватистая
кислота
-50оС
F2(газ) + H2O(тв) → HF(ж) + HOF(газ)
2HOF = 2HF + O2
4HOF
+ 2H2O = 4HF + 2H2O2 + O2неустойчива при н.у. разложение воды
Слайд 26
Кислородные кислоты Cl, Br, I
1. HOX существуют только
в растворах
IO- + H+ ⇔ HOI ⇔ I+ +
OH- 2HClO ⇔ HClO2 + HCl3HBrO ⇔ HBrO3 + 2HBr
амфотерность
(HOI)
2Cl2 + H2O + 3HgO = Hg3O2Cl2 + 2HOCl
2. HClO2 существует только в растворе
получение
4HClO2 = 2ClO2 + HClO3 + HCl + H2O
(4Cl3+ → 2Cl4+ + Cl5+ + Cl-)
HClO2 = O2 + HCl
5HClO2 = 4ClO2 + HCl + 2H2O
3HClO2 = 2HClO3 + HCl
побочные реакции
Ba(ClO2)2 + H2SO4 = 2HClO2 + BaSO4↓
получение
Слайд 27
Кислородные кислоты Cl, Br, I
3. HClO3, HBrO3 существуют
только в растворе
HIO3 – бесцветные кристаллы
3HClO3 = HClO4 +
2ClO2 + H2O4HBrO3 = 2H2O + 2Br2 + 5O2
2HIO3 = I2O5 + H2O
(to)
(3Cl5+ → Cl7+ + 2Cl4+)
(to)
(to)
разложение дегидратация
I2 + 10HNO3(б/в) = 2HIO3 + 10NO2 + 4H2O I2O5 + H2O = 2HIO3
Ba(ClO3)2 + H2SO4 = 2HClO3 + BaSO4↓ 2HIO3 + 5H2O2 = I2 + 5O2 + 6H2O
I2 + 5H2O2 = 2HIO3 + 4H2O
получение
IO3-
Слайд 28
Кислородные кислоты Cl, Br, I
4. HClO4 – бесцветная
жидкость
HBrO4 неустойчива даже в разбавленных растворах
H5IO6 – бесцветные кристаллы
HClO4
– окислитель только в концентрированных растворах2HClO4(р) + Ca = Ca(ClO4)2 + H2
H5IO6 + K2CO3 = K2H3IO6 + CO2 + H2O K2H3IO6 + KOH = K3H2IO6 + H2O
HCl + NaClO4 = HClO4 + NaCl↓
Ba3(H2IO6)2 + 6HNO3(б/в) = 2H5IO6 + Ba(NO3)2↓
H5IO6
HClO4
Нет 5-замещенных солей в растворе
Получение в
кислой среде
Слайд 29
Сравнение силы кислот
HClO
HClO2 HClO3
HClO4
Основной процесс – смещение электронной плотности
по
кратной связи Cl-O ⇒ ослабление связи О-Н ⇒ легкое
отщепление протона: диссоциацияОслабление связи О-Н Увеличение кратности связи Cl-O
Увеличение силы и устойчивости кислот
Слайд 30
Сравнение силы кислот
HBrO3
HClO3
HIO3
ClO3
-
BrO3
-
IO3
-
Увеличение длины связи Х-О
Уменьшение прочности связи
Х-О Уменьшение силы кислот
Слайд 31
Red/Ox способность кислот и оснований
1. Все кислоты более
сильные окислители, чем их соли
ClO4 + 2H + 2e = ClO3 + H2O
- + - -
pH=0,
E = +1.20 B0
ClO4 + H2O + 2e = ClO3 + 2OH
- - - -
pH=14, E = +0.37 B
0
HClO4 + H2SO4 + 2FeSO4 = HClO3 + H2O + Fe2(SO4)3 2KClO4 + FeSO4 ⇔ Fe(ClO4)2 + K2SO4
2. При pH=0 X+ и Cl3+ склонны к диспропорционированию при рН=14 диспропорционируют Х2
самая устойчивая с.о. +5
2HClO2 HClO3 + HClO
3NaClO = NaClO3 + 2NaCl (при 60 0С)
Слайд 32
Red/Ox способность кислот и оснований
В с.о. +7 производные
брома самые сильные окислители и при рН=0, и при
рН=145HBrO4 + 2MnSO4 + 3H2O = 2HMnO4 + 5HBrO3 + 2H2SO4 H5IO6 + 2HCl = HIO3 + 3H2O + Cl2
HClO4 + HCl =
Причина: r(Br)>r(Cl) ⇒ уменьшается экранирование для к.ч.=4, но для I к.ч.=6
В с.о. +5 окислительная способность меняется по ряду
Cl ≈ Br > I
2KBrO3 + I2 = 2KIO3 + Br2
2KClO3 + I2 = 2KIO3 + Cl2
Слайд 33
Соли кислородных кислот Cl, Br, I
1. Гипохлориты:
2KOH +
Cl2 = KClO + KCl + H2O
CaO + Cl2
= CaOCl2 [Ca(OCl)2·CaCl2]сильные окислители
20оС
20oC
4NaOH + 3NaOCl + 2Fe(OH)3 = 2Na2FeO4 + 3NaCl + 5H2O
2. Хлориты
Na2O2 + 2ClO2 = 2NaClO2 + O2
5NaClO2 + 2H2SO4 = 4ClO2 + 2Na2SO4 + 2H2O + NaCl
Структура Ca(ClO2)2
в кристаллическом состоянии
Слайд 34
Соли кислородных кислот Cl, Br, I
3. Хлораты, броматы,
иодаты
6KOH + 3Cl2 = KClO3 + 5KCl + 3H2O
6KOH
+ 3Br2 = KBrO3 + 5KBr + 3H2O2KClO3 + I2 = 2KIO3 + Cl2
60оС
4KClO3 = KCl + 3KClO4
2Ca(IO3)2 = 2CaO + I2 + 5O2
2KClO3 (Br)
2KCl + 3O2
4. Перхлораты, перброматы, периодаты KBrO3 + F2 + 2KOH = KBrO4 + 2KF + H2O KOH + H2O + KIO3 + KOCl = K2H3IO6 + KCl K2H3IO6 + HNO3 = KIO4 + KNO3 + 2H2O
KClO4 = KCl + 2O2
(плохо растворимая соль)
MnO2, to





























