– «сила»).
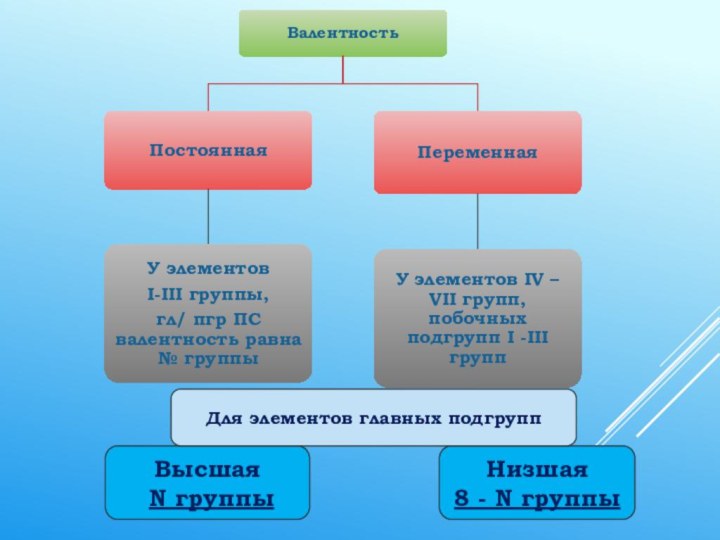
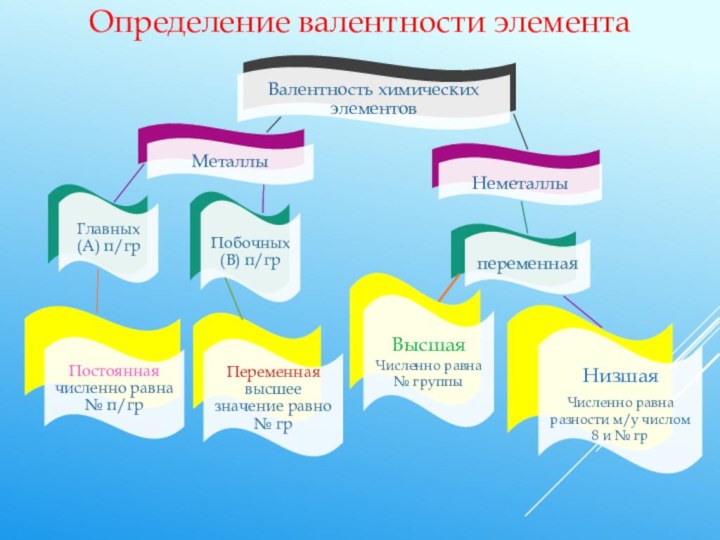
Обратите внимание Валентность не имеет знака!
Валентные возможности атома
определяются числом:Неспаренных ē
Неподелённых ē – пар
Вакантных валентных орбиталей
В отличие от степени окисления, эта величина всегда только положительная и обозначается римскими цифрами