- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химическое исследование питьевой воды
Содержание
- 2. «Пользу воды мы понимаем, когда колодец пересыхает»,
- 3. Цель работы:
- 4. Основные компоненты минерального состава воды.Компонент минерального состава
- 5. Группа 21.Катионы:
- 6. Хлориды В питьевой воде
- 7. Катионы аммония Метод определения массовой концентрации катиона
- 8. Катионы железа Метод определения железа основан на
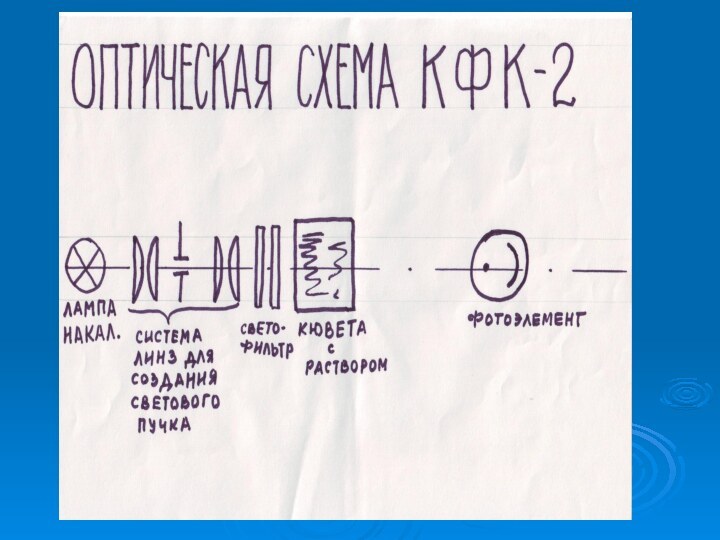
- 9. Фотоэлектрический колориметр
- 11. Практическая частьРЕЗУЛЬТАТЫ ИЗМЕРЕНИЯ МАССОВОЙКОНЦЕНТРАЦИИ ИОНОВ АММОНИЯ ВПИТЬЕВОЙ
- 12. РЕЗУЛЬТАТЫ ИЗМЕРЕНИЯ МАССОВОЙ КОНЦЕНТРАЦИИ ЖЕЛЕЗА ОБЩЕГО В
- 13. РЕЗУЛЬТАТЫ ОПРЕДЕЛЕНИЯ ХЛОРИДОВ В ПИТЬЕВОЙ ВОДЕВзята проба
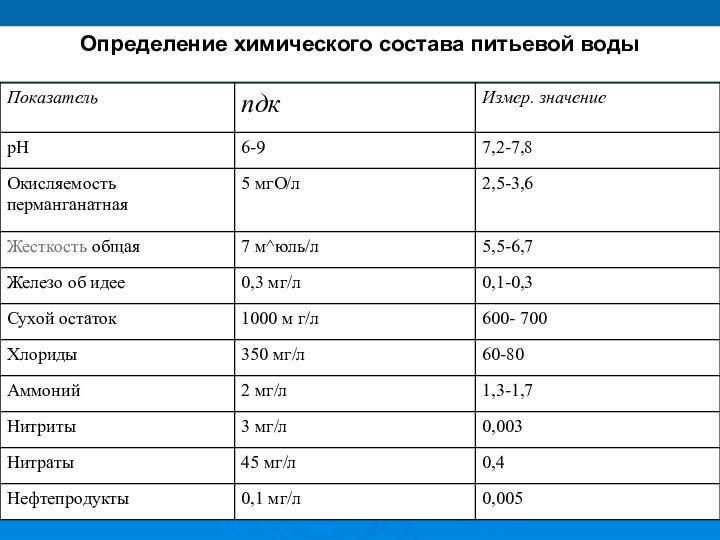
- 14. Определение химического состава питьевой воды
- 15. Заключение. Во всех пробах питьевой
- 16. Водоснабжение г.ГусеваВодоснабжение города Гусева.
- 17. Далее вода направляется на фильтры обезжелезивания, предварительно
- 18. Очищенная от железа вода собирается во второй
- 19. Скачать презентацию
- 20. Похожие презентации
«Пользу воды мы понимаем, когда колодец пересыхает», - так сказал около двух с половиной столетий назад великий ученый-естествоиспытатель и политик, один из отцов-основателей США Бенджамин Франклин. Он произнес эти слова в те времена, когда люди нашей

















Слайд 3
Цель работы:
химическое исследование питьевой воды.
Задачи:
- посещение лаборатории МУП «ВКХ»;- знакомство с различными методами анализа питьевой воды, фотоэлектрическим колориметром КФК -2;
- определение массовой концентрации ионов аммония, катионов железа, анионов хлора в питьевой воде.
Слайд 4
Основные компоненты минерального состава воды.
Компонент минерального состава воды
Предельно-допустимая концентрация (ПДК)
Группа 11.Катионы:
Кальций (Ca2+) 200 мг/л
Натрий (Na+) 200 мг/л
Магний (Mg 2+) 100 мг/л
2.Анионы:
Гидрокарбонат (HCO3 -) 1000 мг/л
Сульфат (SO42-) 500 мг/л
Хлорид (Cl -) 350 мг/л
Карбонат (CO32 100 мг/л
Слайд 5
Группа 2
1.Катионы:
Аммоний (NH 4+)
2,5 мг/лТяжелые металлы (сумма) 0,001 ммоль/л
Железо общее (Fe2+ + Fe 3+ ) 0,3 мг/л
2.Анионы:
Нитрат (NO3- ) 45 мг/л
Ортофосфат (PO 43-) 3,5 мг/л
Нитрит (NO2-) 0,1 мг/л Концентрации растворенных в воде минеральных солей определяют, как правило, химическими методами: титриметрическим, колориметрическим и др.
Слайд 6
Хлориды
В питьевой воде города
Гусева концентрация хлоридов составляет 20 – 120 мг/л, в
зависимости от того, какие скважины работают.Метод аргентометрического титрования. Титрование можно выполнять в пределах рН 5,0-8,0.
Массовую концентрацию хлорид-аниона (С) в мг/л вычисляют по уравнению:
Vхл х H х 35,5 х 1000
С = ----------------------------,
Vв
где: Vхл - объём раствора нитрата серебра, израсходованное на
титрование, мл;
Н – концентрация титрованного раствора нитрата серебра с
учетом поправочного коэффициента, г-экв/л;
Vв - объем воды, взятой для анализа, мл;
35,5 – эквивалентная масса хлора;
1000 – коэффициент пересчета единиц измерения из г/л в мг/л.
Слайд 7
Катионы аммония
Метод определения массовой концентрации катиона аммония
основан на его реакции с реактивом Несслера образовывать соединения,
окрашенные в щелочной среде в желтый цвет.2K2HgJ4 + NH3 + 3KOH = Hg2OJNH2 + 7KJ + 2H2 O
желтый
Мешающее влияние железа устраняют добавлением к пробе сегнетовой соли: KCOO(CHOH)COONa.
Концентрацию катионов аммония определяют колориметрическим методом с помощью фотоколориметра КФК.
Оптическая плотность окрашенных растворов пропорциональна концентрации катионов аммония.
Слайд 8
Катионы железа
Метод определения железа основан на способности
катиона железа(11) в интервале рН 3-9 образовывать с орто-фенантролином
комплексное оранжево-красное соединение.При наличии в воде железа (111), оно восстанавливается до железа (11) солянокислым гидроксиламином в нейтральной или слабокислой среде по реакции:
Fe3+ + 2NH2OH х HCl = Fe2+ + N2 + 2H2O + 2HCl + 2H+
Таким образом определяется суммарное содержание железа (11) и железа (111). Анализ проводится в ацетатном буферном растворе при рН 4,5-4,7.
Концентрацию железа в анализируемой воде определяют с помощью КФК(фотоэлектрический колориметр).
Слайд 11
Практическая часть
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЯ МАССОВОЙ
КОНЦЕНТРАЦИИ ИОНОВ АММОНИЯ В
ПИТЬЕВОЙ ВОДЕ.
Для
анализа берем две пробы питьевой воды из водопроводного крана:
одна объемом 25 мл, а другая объемом 5 мл, разбавленная до 25 мл дистиллированной водой. Добавляем реактивы в соответствии с прописью методики. Получаем окрашенные в желтый цвет растворы, интенсивность окраски которых различна (первая проба более ярко окрашена, чем другая).С помощью фотоэлектрического колориметра (КФК) измеряем оптическую плотность окрашенных растворов (Д). Данные измерения заносим в таблицу. По формуле зависимости массовой концентрации ионов аммония (X мг/л) от оптической плотности (Д)
Х= 11,081 Д
находим значение массовой концентрации ионов аммония в исследуемых пробах питьевой воды и данные заносим в таблицу:
Слайд 12
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЯ МАССОВОЙ
КОНЦЕНТРАЦИИ ЖЕЛЕЗА ОБЩЕГО В
ПИТЬЕВОЙ ВОДЕ.
Для анализа
взяты две пробы питьевой воды из крана: одна объемом
25 мл и другая объемом 5 мл, доведенная до объема 25 мл дистиллированной водой (разбавленная проба).После добавления реактивов в каждую пробу в соответствии с прописью методики, получили окрашенные растворы, с различной интенсивностью окраски. С помощью фотоэлектрического колориметра (КФК-2) измерили оптическую плотность (Д) окрашенных растворов. Получили данные, которые занесли в таблицу. По формуле расчета зависимости концентрации ионов (X) мг/л в растворе от оптической плотности раствора:
X = 8,324 Д
рассчитали концентрацию ионов железа общего в каждом растворе. Результаты расчета также занесли в таблицу:
Слайд 13
РЕЗУЛЬТАТЫ ОПРЕДЕЛЕНИЯ ХЛОРИДОВ В
ПИТЬЕВОЙ ВОДЕ
Взята проба питьевой воды
из водопроводного крана объемом 25 мл. Добавили реактив в
соответствии с прописью методики. Получили раствор желтого цвета. Оттитровали его раствором азотнокислого серебра до перехода окраски из желтой в оранжевую. На титрование 25 мл питьевой воды пошло 1,1 мл раствора нитрата серебра. Подставляем это значение в формулу для расчета массового содержания хлоридов. Получили содержание хлоридов в питьевой воде 78,1 мг/л.
Слайд 15
Заключение.
Во всех пробах питьевой воды
из водопроводных кранов, взятых для анализа, массовая концентрация ионов
аммония, катионов железа, анионов хлора.соответствует гигиеническим требованиям, утвержденным нормативными документами (СаН ПиН и ГОСТР).Слайд 17 Далее вода направляется на фильтры обезжелезивания, предварительно пройдя
обработку активным хлором для обеззараживания. После фильтров концентрация железа
в воде снижается с 4-5 мг/л до 0,1- 0,2 mi 7л.Слайд 18 Очищенная от железа вода собирается во второй накопительной
емкости объемом 2000 куб.метров и насосами подается в разводящую
сеть. Нерастворимый осадок окислов железа удаляется из фильтров обратной промывкой водой и сбрасывается в отстойники.Для поддержания давления в городской сети служит подкачивающая станция, расположенная по ул. Балтийской, имеющая 4 накопительные емкости по 100 куб. метров каждая.
Протяженность распределительной сети городского водопровода составляет 86,4 км.
Водопотребление составляет примерно 10 тысяч куб. метров в сутки.