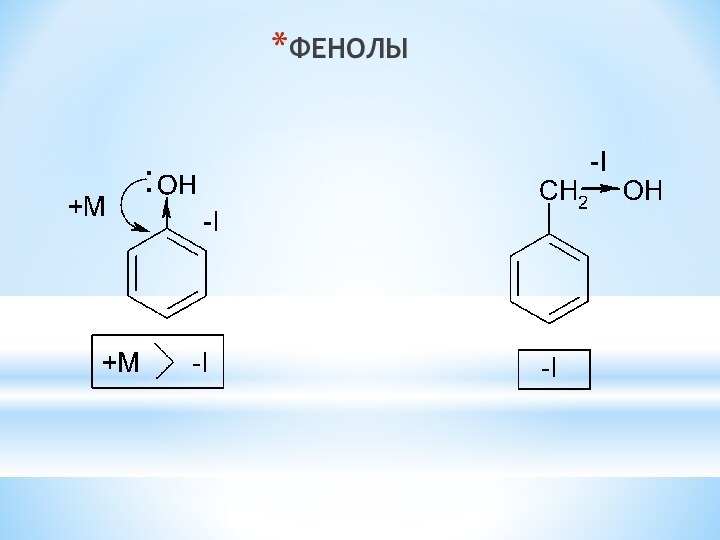
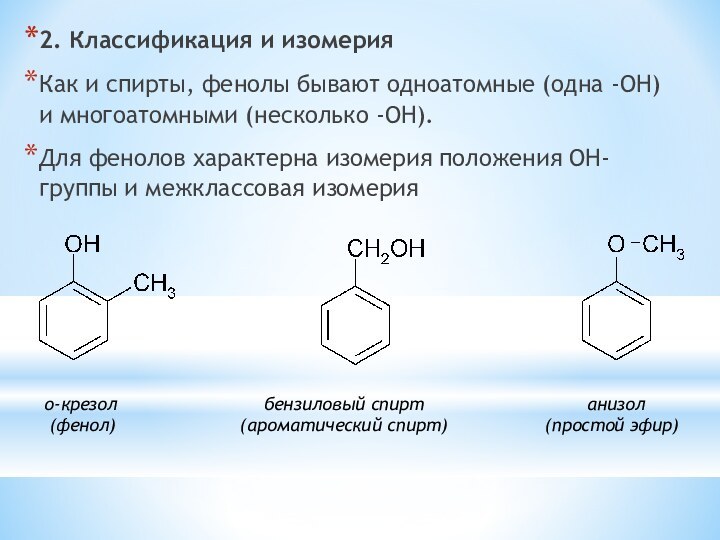
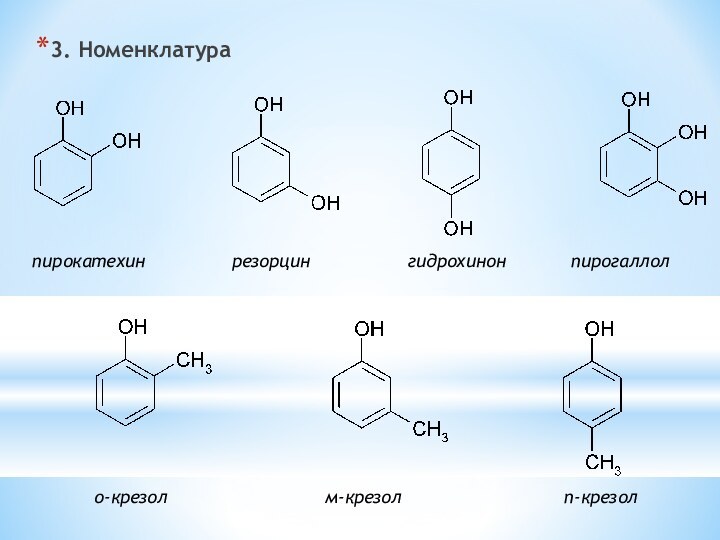
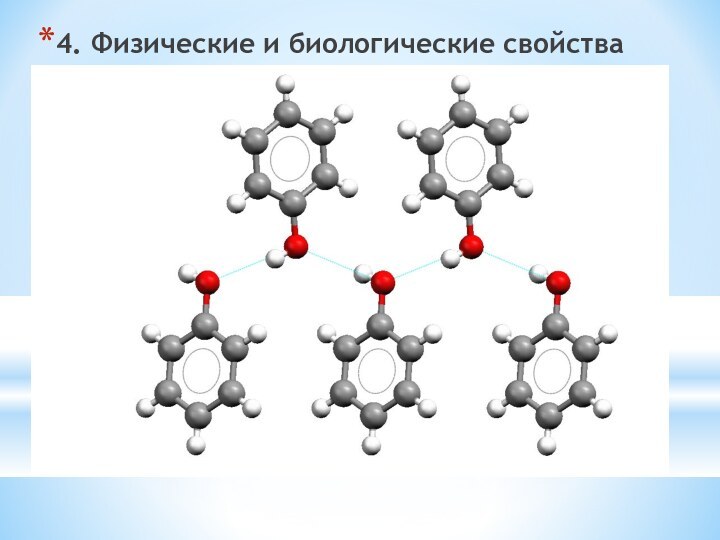
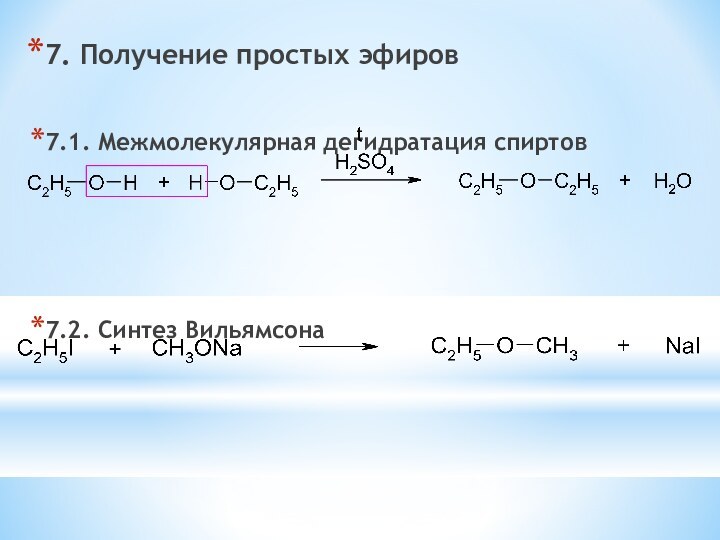
одноатомные (одна -OH) и многоатомными (несколько -OH).
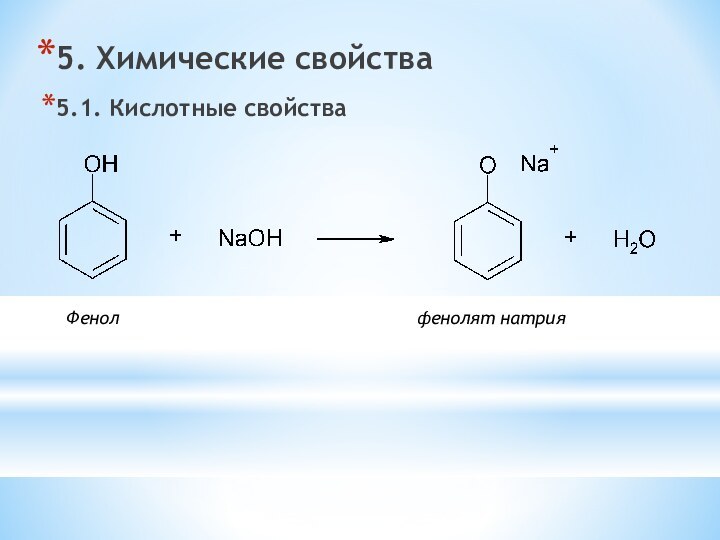
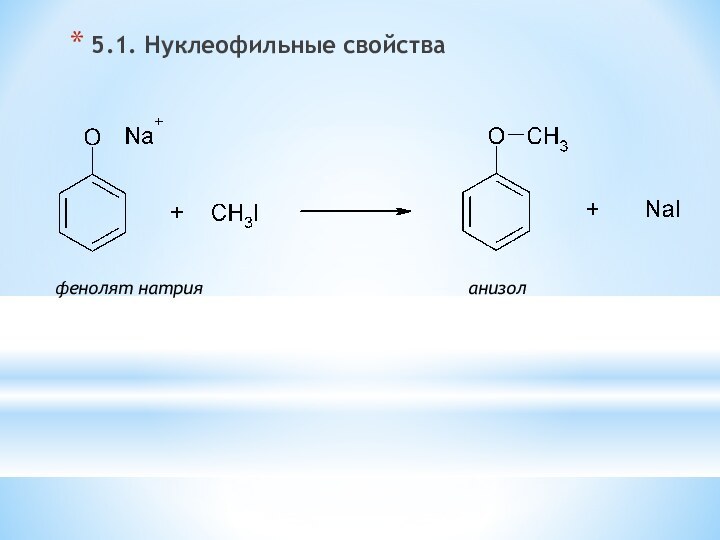
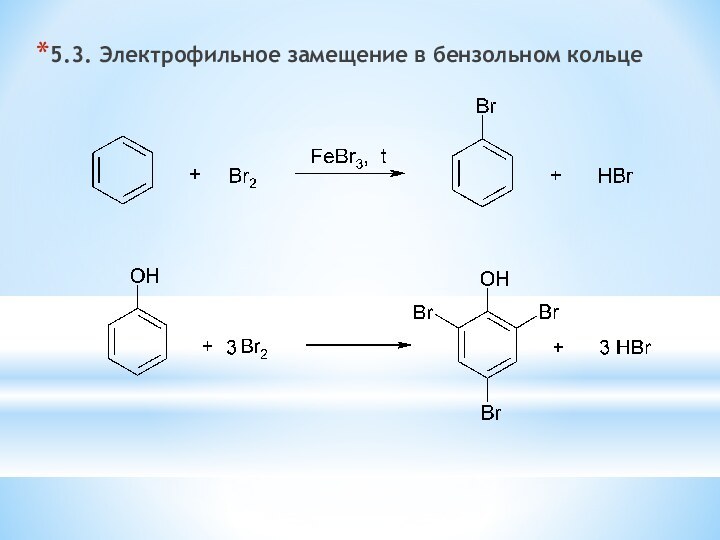
Для фенолов характерна
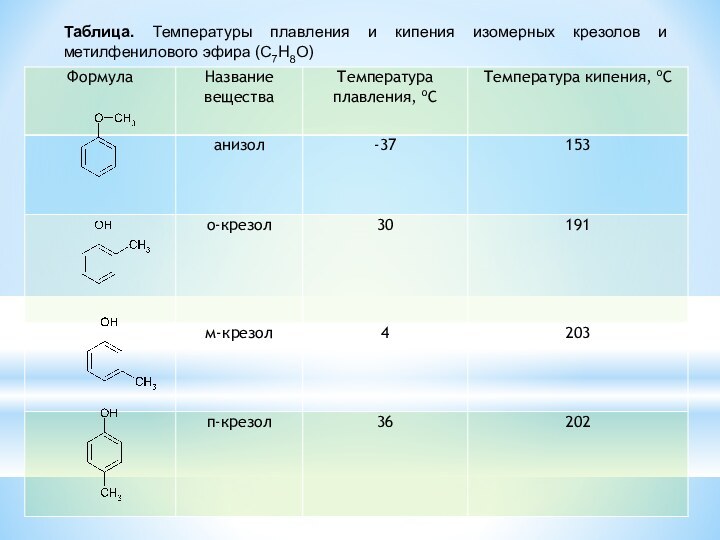
изомерия положения OH-группы и межклассовая изомерия о-крезол бензиловый спирт анизол
(фенол) (ароматический спирт) (простой эфир)