Слайд 3
Факторы, определяющие оптимальный синтез
Слайд 4
Многостадийный синтез
"Болевая точка" многостадийного синтеза - низкий выход
целевого продукта
При среднем выходе на стадию Y общий выход
на п стадий составляет
Yn
Пример: 5 стадий с Y = 0.8 (80% )
0.85 = 0.33 (33%)
Слайд 5
Многостадийный синтез
Поэтому важно при планировании сложного синтеза минимизировать
число стадий и выбирать наиболее эффективные синтетические методы для
его осуществления
Слайд 6
Синтетический метод
Важные характеристики эффективного синтетического метода - общность
(слабая зависимость результата от конкретных особенностей структуры исходных соединений),
селективность (участие в реакции лишь определенных функциональных групп) и высокие выходы продуктов
Слайд 7
Многостадийный синтез
Другой путь повышения общего выхода - использование
так называемых конвергентных схем синтеза
Слайд 8
Многостадийный синтез
При традиционном подходе сборка сложной молекулы из
фрагментов Аi осуществляется путем последовательного усложнения исходного субстрата в
соответствии с "линейной" схемой
Слайд 9
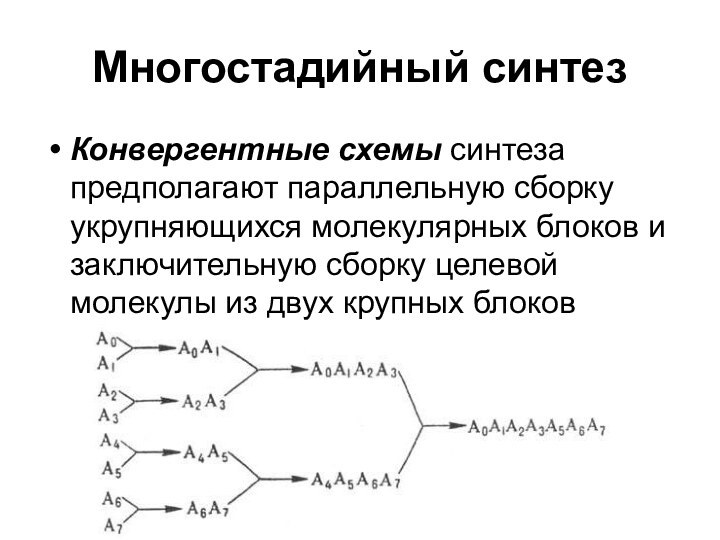
Многостадийный синтез
Конвергентные схемы синтеза предполагают параллельную сборку укрупняющихся
молекулярных блоков и заключительную сборку целевой молекулы из двух
крупных блоков
Слайд 10
Многостадийный синтез
Конвергентная схема обусловливает значительно более слабую зависимость
общего выхода от числа стадий
Схема синтеза Число стадий
8 16 32 64 80
Линейная
Выход,% 17 2.8 0.08 6•10-5
2•10-6
Конвергентная
Выход,% 51 41 33 26 24
Слайд 11
Многостадийный синтез
Преимущества конвергентных схем: возможность разобщения сходных функциональных
групп по разным ветвям схемы (упрощаются задачи обеспечения селективности
реакций)
возможность одновременной проработки различных ветвей схемы, а также внесения необходимых изменений в те или иные участки схемы без нарушения общего стратегического замысла
Слайд 12
Многостадийный синтез
Использование реакций, обеспечивающих возможность сборки молекул из
крупных блоков, наряду с синтонным подходом, обусловило успехи органического
синтеза (синтез хлорофилла, витамина В12, полинуклеотидов и др.) и перевод многих чисто препаративных синтезов в промышленные (синтез стереоидных гормонов и простагландинов)
Слайд 13
Органический синтез
Критерии оптимального синтеза:
доступность исходных соединений; их
устойчивость, токсичность, пожаро- и взрывоопасность
Слайд 14
Исходные соединения
Субстрат и реагент - это два
равноправных участника реакции
Углеродный скелет субстрата включается в структуру продукта,
становясь его основой
Структура реагента является элементом, дополнительным к структуре субстрата
Субстрат выбирают, руководствуясь целью синтеза, а реагент − методом достижения цели
Слайд 15
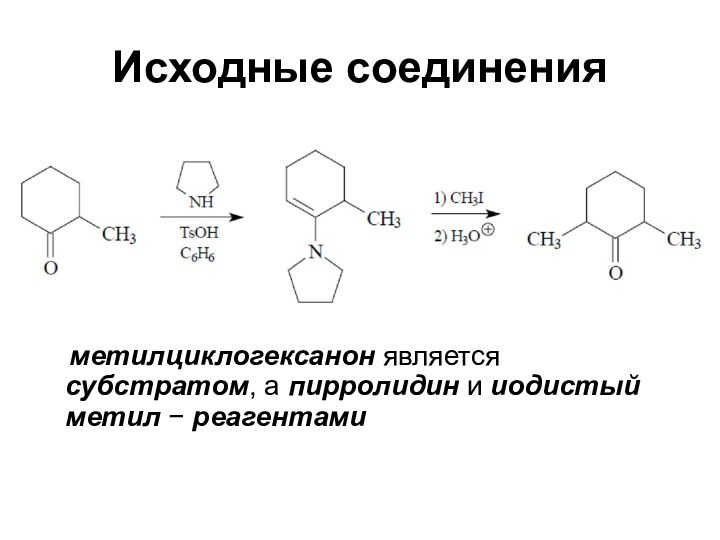
Исходные соединения
метилциклогексанон является субстратом, а
пирролидин и иодистый метил − реагентами
Слайд 16
Условия реакций
Экологические аспекты органического синтеза
Региоселективность
Региоспецифичность
Слайд 17
Региоселективность реакции
Реакция протекает преимущественно по одному из двух
(или более) положений субстрата
Слайд 18
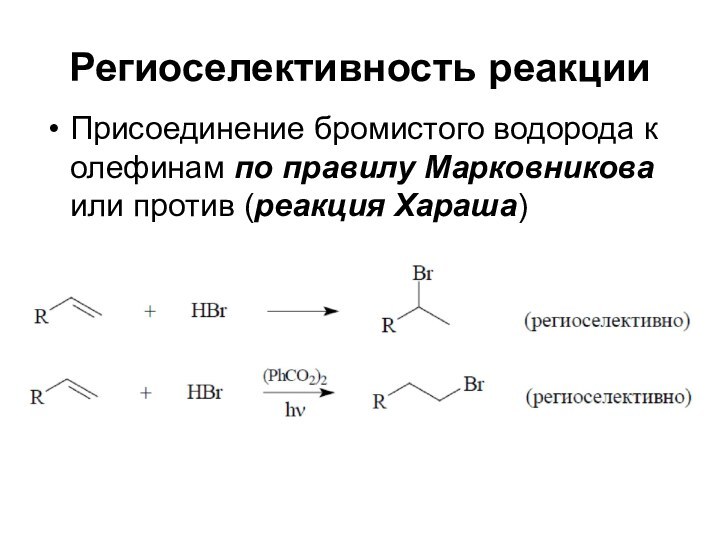
Региоселективность реакции
Присоединение бромистого водорода к олефинам по правилу
Марковникова или против (реакция Хараша)
Слайд 19
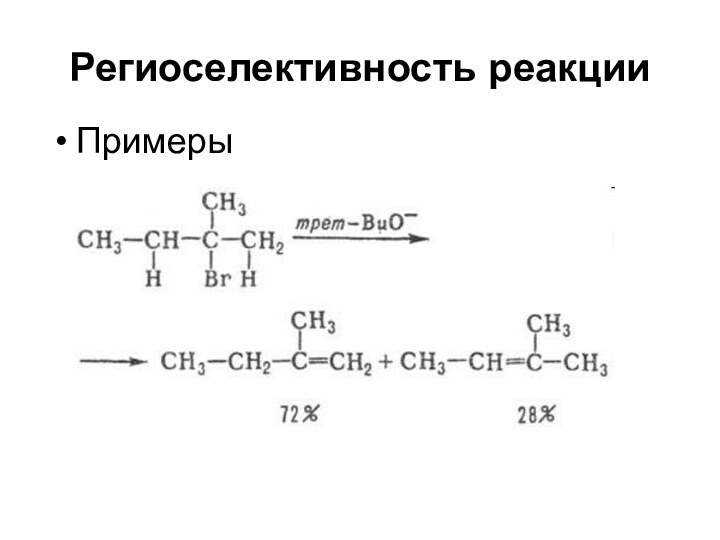
Региоселективность реакции
Примеры
Слайд 20
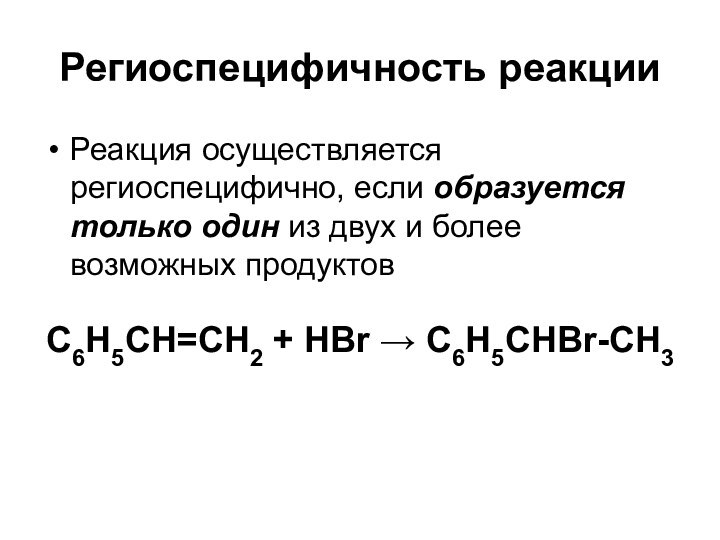
Региоспецифичность реакции
Реакция осуществляется региоспецифично, если образуется только один
из двух и более возможных продуктов
C6H5CH=CH2 + HBr →
C6H5CHBr-CH3
Слайд 21
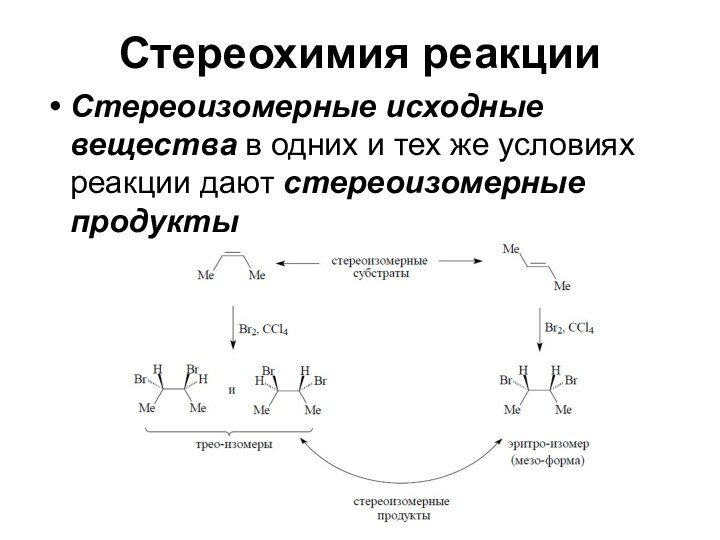
Стереохимия реакции
Стереоизомерные исходные вещества в одних и тех
же условиях реакции дают стереоизомерные продукты
Слайд 22
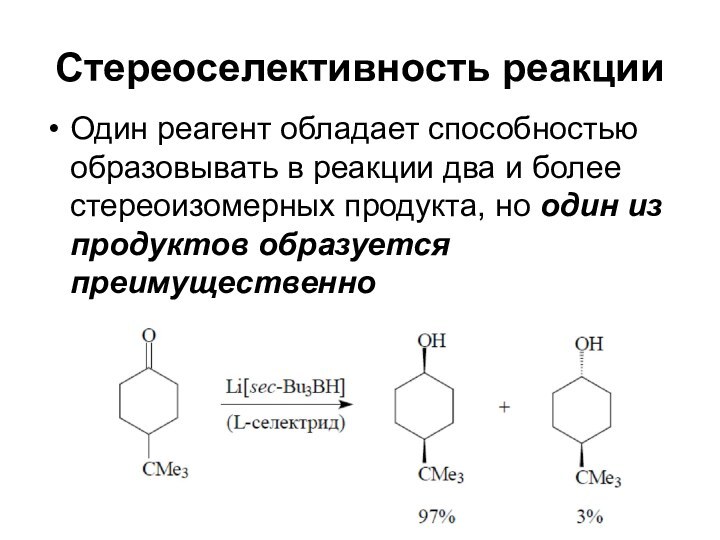
Стереоселективность реакции
Один реагент обладает способностью образовывать в реакции
два и более стереоизомерных продукта, но один из продуктов
образуется преимущественно
Слайд 23
Стереоселективность реакции
Количественная оценка
СС = (А —
Б)/(А + Б)
Высочайшая стереоселективность наблюдается в реакциях, катализируемых ферментами
Слайд 24
Стереоспецифичность реакции
Протекание реакции исключительно по одному пространственному пути
из нескольких возможных
Слайд 25
Направление реакции
Определяется наибольшей энергетической выгодностью и принципом наименьшего
движения (минимумом изменений положений атомов и исходной электронной конфигурации,
включая сохранение орбитальной симметрии) - правила Вудворда-Хофмана
Слайд 26
Участие катализатора
Гомогенные катализаторы - кислоты или основания,
комплексы переходных металлов
Гетерогенные катализаторы - металлы и оксиды
металлов
Межфазный катализатор выполняет функцию переноса иона из одной фазы в другую
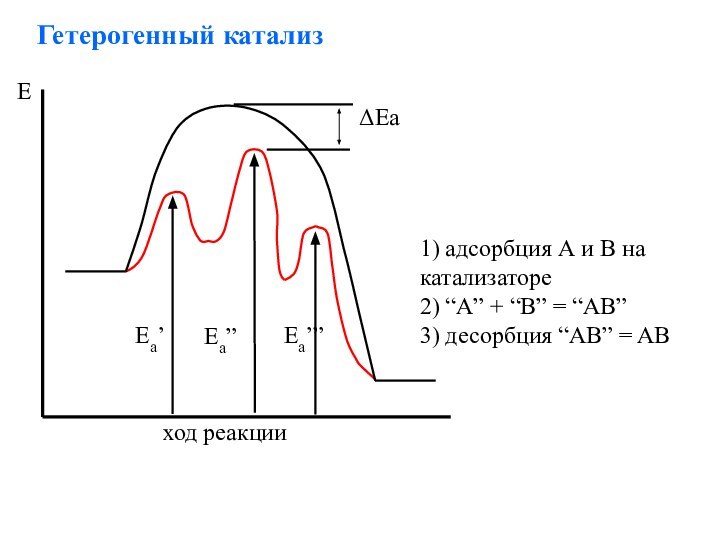
Слайд 28
Гетерогенный катализ
1) адсорбция А и В на катализаторе
2)
“A” + “B” = “AB”
3) десорбция “AB” = AB
Слайд 29
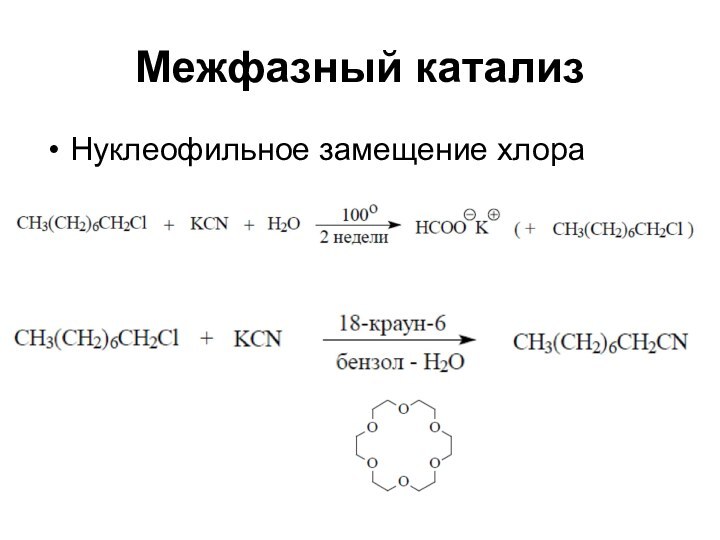
Межфазный катализ
Нуклеофильное замещение хлора
Слайд 31
Растворители
Большинство химических реакций проводится в растворах
В качестве
растворителя может использоваться любое соединение в жидком состоянии, в
том числе сжиженные газы (например, аммиак), а также расплавы твердых веществ
Вещества в сверхкритическом состоянии, ионные жидкости
Слайд 32
Растворители
Для проведения реакции при высокой температуре используется
эвтектическая смесь, состоящая из бифенила (26,5%) и дифенилового эфира
(73,5%), известная под названием «даутерм А» (dowtherm A) - температура кипения этой смеси равна 258о С
Слайд 33
Растворители
В большинстве случаев между растворителем и растворенным веществом
имеется взаимодействие
При отсутствии растворителя вещество представляет собой совокупность ассоциатов
молекул
Слайд 34
Растворители
Взаимодействие вещества с растворителем приводит к разрушению ассоциатов
молекул за счет их сольватации
Слайд 36
Полярность растворителя
Количественные характеристики - значения диэлектрической проницаемости (ε)
и дипольного момента (μ)
Слайд 37
Полярность растворителя
Апротонные растворители называют неполярными, если они имеют
величину ε меньше 15, а μ − меньше 2D
(углеводороды, галогенопроизводные, простые эфиры, третичные амины )
Взаимодействие неполярных апротонных растворителей с веществом обусловлено слабыми силами Ван-дер-Ваальса
Слайд 38
Полярность растворителя
Полярные апротонные растворители характеризуются значением диэлектрической проницаемости
больше 15 и дипольным моментом более 2D (ДМФА, ДМСО,
гексаметилфосфортриамид - ГМФТА, ацетонитрил)
Слайд 39
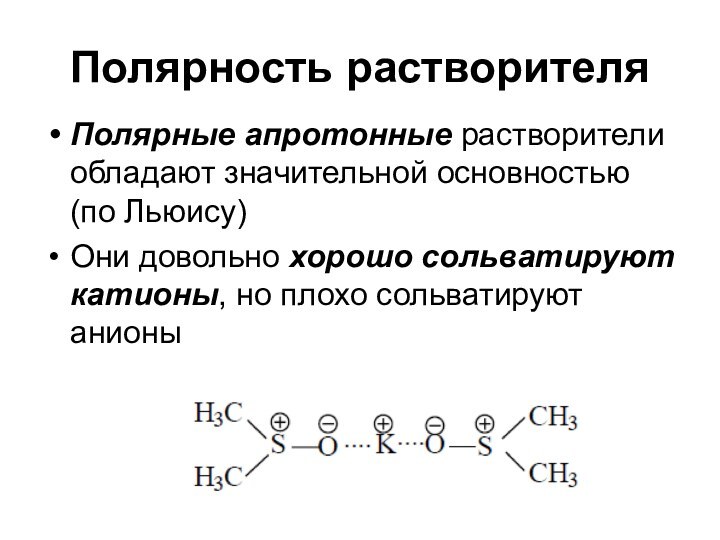
Полярность растворителя
Полярные апротонные растворители обладают значительной основностью (по
Льюису)
Они довольно хорошо сольватируют катионы, но плохо сольватируют
анионы
Слайд 40
Полярность растворителя
Полярные протонные растворители − это вода, спирты,
первичные и вторичные амины, жидкий аммиак, карбоновые кислоты
Они способны
сольватировать как катионы, так и анионы (энергия сольватации анионов за счет образования водородных связей обычно в несколько раз больше, чем энергия сольватации катионов)
Слайд 41
Кислотные или основные свойства растворителя
Вода, карбоновые кислоты, спирты,
аммиак при действии основания могут отщеплять протон (акцептором протона
могут выступать молекулы самого диссоциирующего вещества)
Слайд 42
Кислотные или основные свойства растворителя
Растворители, которые обладают как
кислотными, так и основными свойствами с собственной ионизацией, называются
амфипротонными
Слайд 43
Кислотные или основные свойства растворителя
Чтобы выяснить, какая кислота
является более сильной, надо использовать растворитель, у которого основность
мала (дифференцирующий)
В метаноле HNO3 диссоциирует частично, а HCl нацело
В уксусной кислоте HCl диссоциирует частично, а H2SO4 полностью
В ацетоне все кислоты, кроме HСlO4, являются слабыми электролитами
Слайд 44
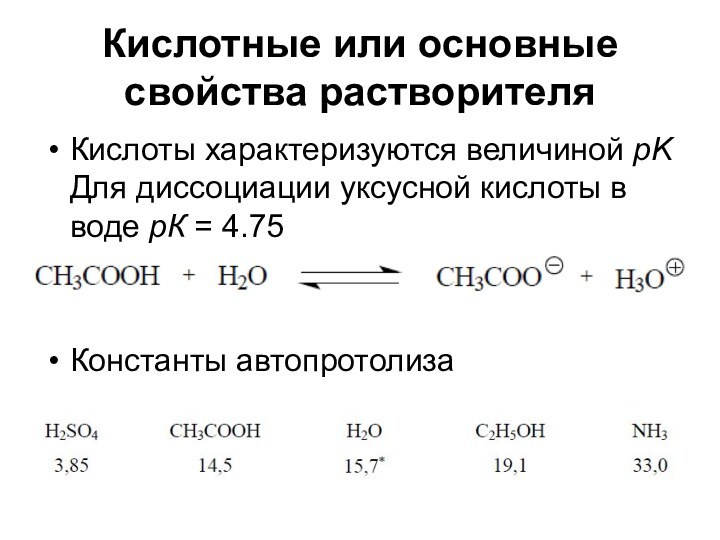
Кислотные или основные свойства растворителя
Кислоты характеризуются величиной pK
Для
диссоциации уксусной кислоты в воде рК = 4.75
Константы
автопротолиза
Слайд 45
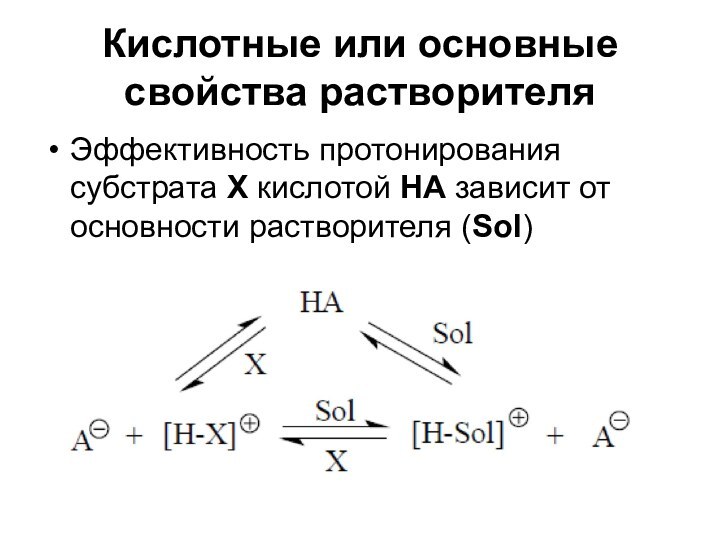
Кислотные или основные свойства растворителя
Эффективность протонирования субстрата Х
кислотой НА зависит от основности растворителя (Sol)
Слайд 46
Кислотные или основные свойства растворителя
Трет-бутилат калия в ДМСО
является очень сильным основанием (ДМСО не обладает выраженными кислотными
свойствами)
В воде трет-бутилат калия практически полностью гидролизуется с образованием гораздо менее основной щелочи
Слайд 47
Суперкислоты
Очень большой протонирующей способностью обладают жидкий фтористый
водород и 96-100%-ная серная кислота
Кислоты с еще большей протонирующей
способностью принято называть суперкислотами (фторсульфоновая кислота)
Слайд 48
Суперкислоты
Смесь фторсульфоновой кислоты с пентафторидом сурьмы (FSO3H +
SbF5) способна протонировать алканы - ее назвали «магической кислотой»
В
суперкислой среде молекула воды оказывается дважды протонированной
Слайд 49
Суперкислоты
Образуется катион метония
Превращение простых эфиров в сложные
Слайд 50
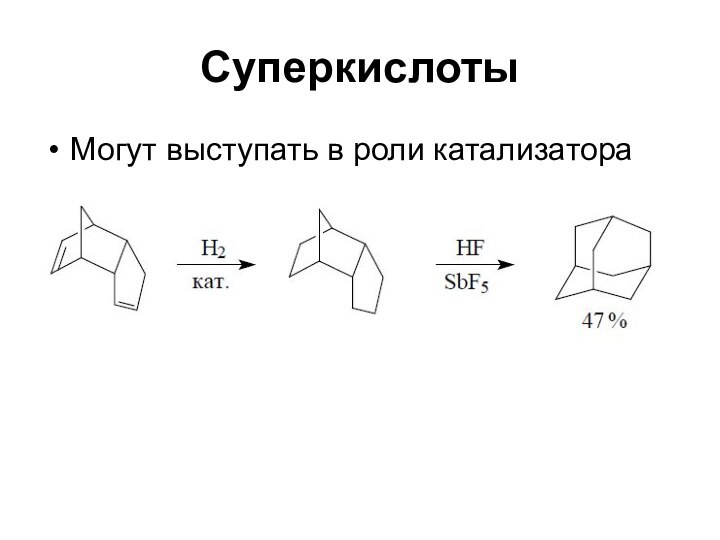
Суперкислоты
Могут выступать в роли катализатора
Слайд 51
Сильные основания
Депротонирование углеводорода
Сильные основания
Слайд 52
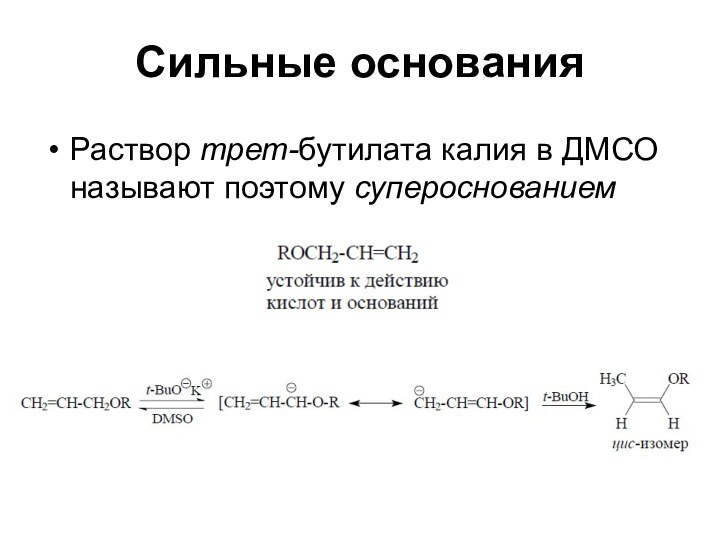
Сильные основания
Раствор трет-бутилата калия в ДМСО называют поэтому
супероснованием
Слайд 53
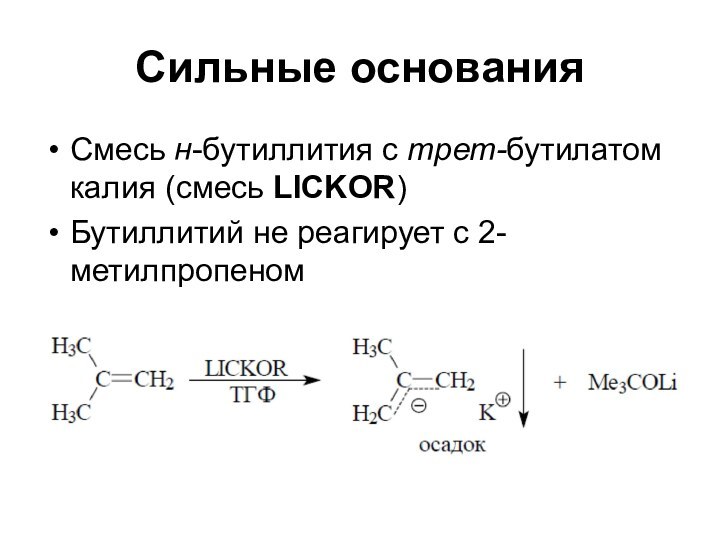
Сильные основания
Смесь н-бутиллития с трет-бутилатом калия (смесь LICKOR)
Бутиллитий
не реагирует с 2-метилпропеном
Слайд 54
Флюиды как растворители
Суперкритические жидкости
При нагревании жидкости
в замкнутом сосуде она будет расширяться, а ее плотность
- уменьшаться (плотность пара над поверхностью жидкости будет увеличиваться)
При некоторых критических значениях температуры (tкрит) и давления (Ркрит) плотности жидкости и пара сравняются, и граница раздела фаз исчезнет
Слайд 55
Флюиды как растворители
При температуре и давлении, превышающих tкрит
и Ркрит, состояние вещества называется суперкритическим, а само вещество,
приобретающее новые и необычные свойства – флюидом
Плотность водяного флюида при 400°С и 250 атм составляет 0,16 г/см3
Слайд 56
Флюиды как растворители
Растворимость органических и неорганических веществ во
флюидах намного повышается
СО2 (tкрит = 31°С, Ркрит =
74 атм) способен растворять многие полярные органические вещества
Вода (tкрит = 374°С и Ркрит = 220 атм) становится менее полярной и способна растворять большое число неполярных соединений
Слайд 57
Флюиды как растворители
Растворы многих органических веществ в суперкритической
воде легко реагируют с кислородом, давая продукты полного окисления:
CO2, H2O, N2 и т.д. (можно утилизировать многие ядовитые отходы, превращая их в безопасные продукты)
Слайд 58
Флюиды как растворители
Промышленное применение находит суперкритический диоксид углерода:
с его помощью извлекают кофеин из зерен кофе и
розовое масло из лепестков розы
Легко гидрируется с образованием муравьиной кислоты
Слайд 59
Флюиды как растворители
В суперкритических средах кислотность углеводородов возрастает
Бензол является очень слабой CH-кислотой (pK 43), в суперкритической
воде его величина pK понижается до 19
Слайд 60
Флюиды как растворители
О синтезах в суперкритических «жидкостях» говорят
как о «синтезах с помощью гаечного ключа» - для
их выполнения требуется особая техника с использованием высокого давления
У этих процессов большое будущее
Слайд 61
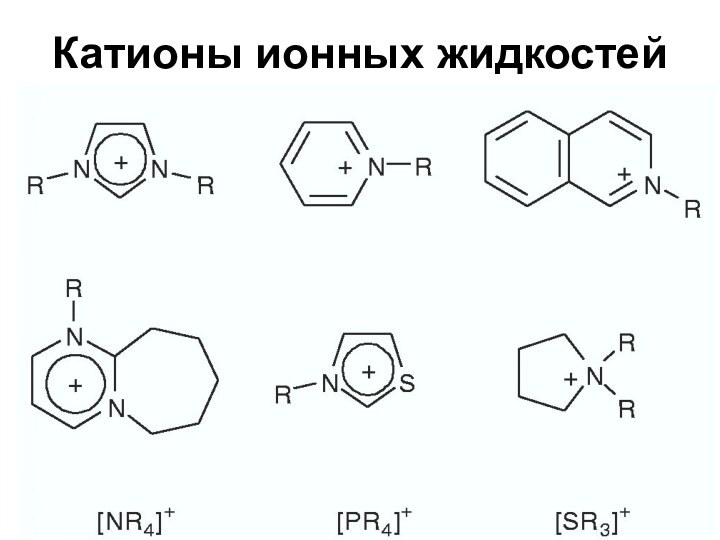
Ионные жидкости
Новый интересный класс растворителей
Особый тип материалов
Соли с
температурой плавления ниже температуры кипения воды
Состоят из ионов
Слайд 63
Свойства ионных жидкостей
Изменяя природу ионов можно изменять свойства
ИЖ
Хлорид-анион – хороший акцептор водородных связей, [PtF6]- - плохой
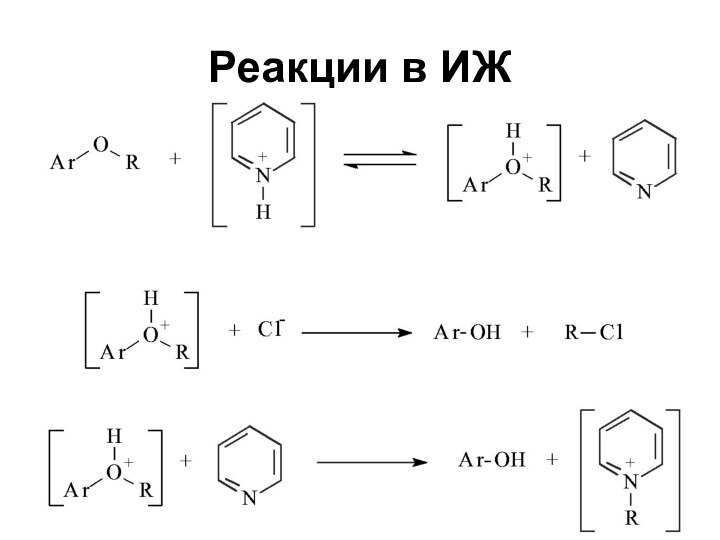
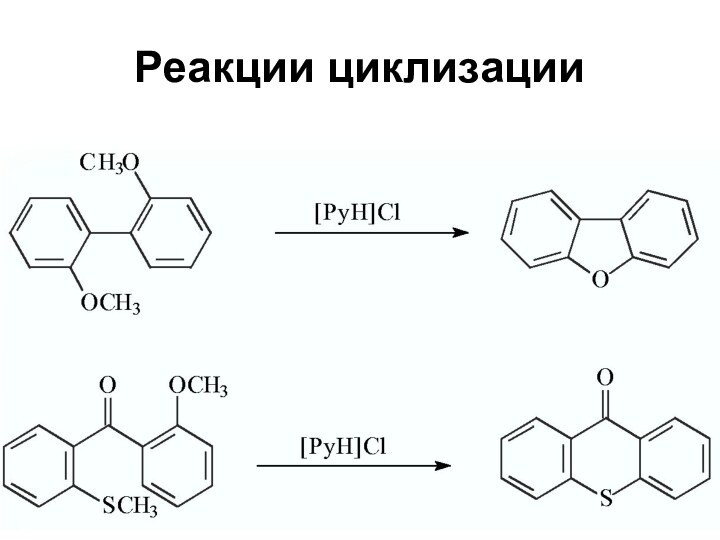
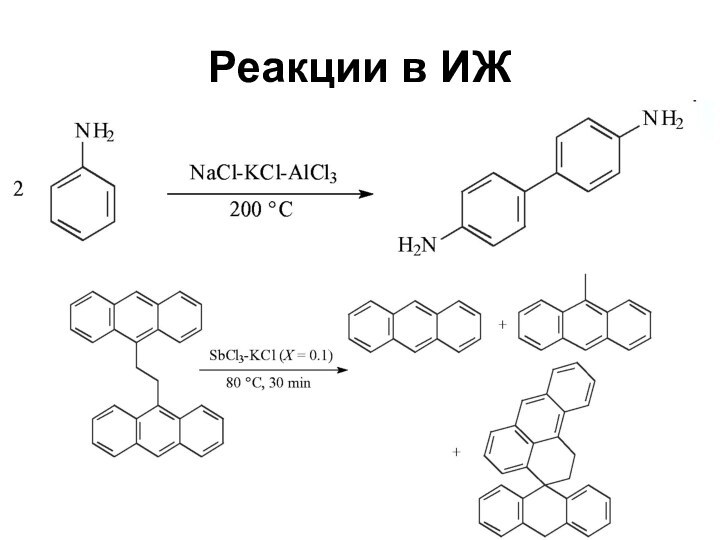
Слайд 64
Свойства ионных жидкостей
Растворимость органических веществ и солей металлов
в ИЖ позволяет проводить реакции катализа в гомогенных условиях
Различие
в растворимости в ИЖ реагентов и продуктов позволяет выделять последние
Слайд 68
Микроволновая активация
Применяется в органическом синтезе с 1980-х
годов
Позволяет сократить время синтеза и увеличить выход целевых
продуктов
Слайд 69
Микроволновая активация
Эффект микроволновой активации не сводится к
простому нагреву реакционной смеси
Волны могут непосредственно взаимодействовать с участниками
реакции
Микроволновое излучение позволяет осуществлять реакции с такой эффективностью, которой нельзя достичь с помощью обычного нагревания