- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
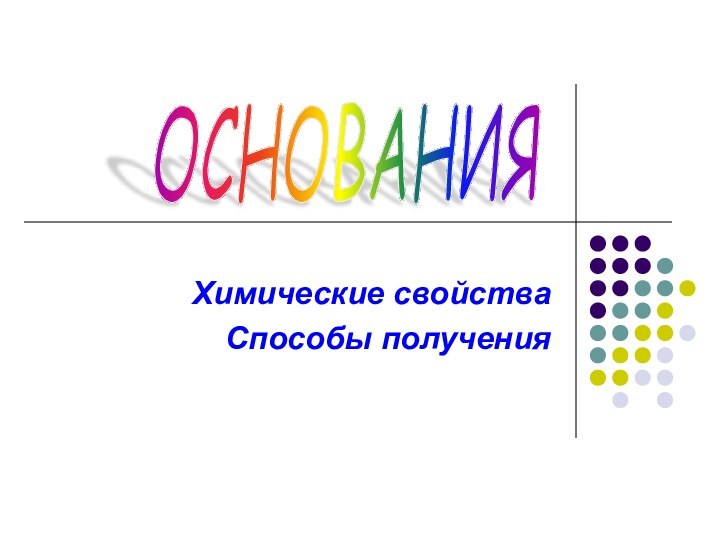
Презентация на тему Основания. Химические свойства. Способы получения
Содержание
- 2. Химические свойства Гидроксид – ионы (ОН-), образующиеся
- 3. Химические свойства оснований (щелочей и нерастворимых оснований)
- 4. Химические свойства щелочей 3. Взаимодействие с оксидами:Са(OН)2
- 5. Химические свойства щелочей4. Взаимодействие с растворами солей:
- 6. Химические свойства нерастворимых оснований
- 7. Способы получения растворимых оснований (щелочей) 1. Взаимодействие
- 8. Скачать презентацию
- 9. Похожие презентации
Химические свойства Гидроксид – ионы (ОН-), образующиеся при диссоциации оснований, обуславливают их химические свойства 1. Действие на индикаторы




Слайд 2
Химические свойства
Гидроксид – ионы (ОН-), образующиеся при
диссоциации оснований, обуславливают их химические свойства
индикаторы
Слайд 3
Химические свойства оснований
(щелочей и нерастворимых оснований)
2NaOH
+ H2SO4 → Na2SO4 + 2H2O
основание +
кислота = соль + вода2Na++2OH-+2H++SO42-→2Na++SO42- + 2H2O
2H+ + 2OH- →2H2O
Реакция нейтрализации – реакция между кислотой и основанием
2. Взаимодействие с кислотами
Cu(OH)2 + H2SO4=CuSO4 + 2H 2O
нерастворимое + кислота = соль + вода
основание
Cu(OH)2 + 2H+ + SO42- = Cu2+ + SO4 2- + 2H2O
Cu(OH)2 + 2H += Cu2+ + 2H2O
Слайд 4
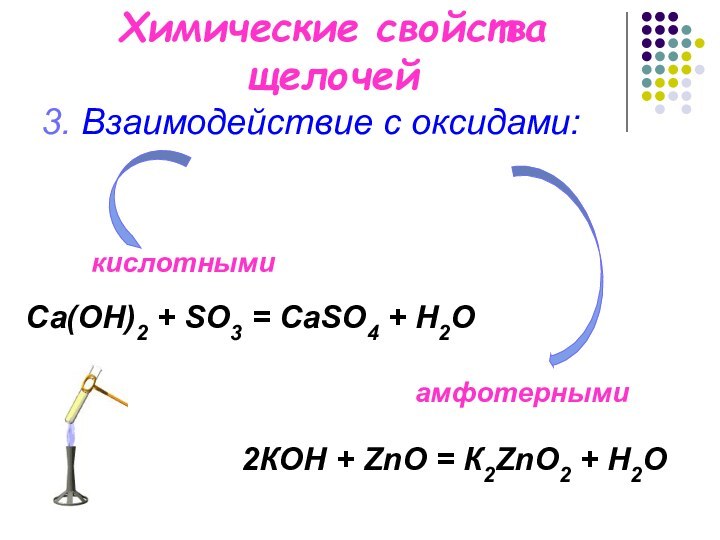
Химические свойства щелочей
3. Взаимодействие с оксидами:
Са(OН)2 +
SO3 = СаSO4 + H2O
2КOН + ZnO = К2ZnO2 + H2O
кислотными
амфотерными
Слайд 5
Химические свойства щелочей
4. Взаимодействие с растворами солей:
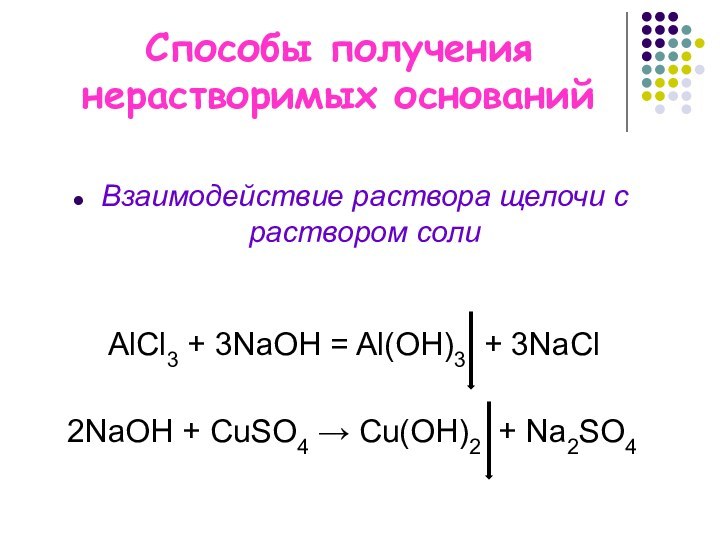
2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
Слайд 6
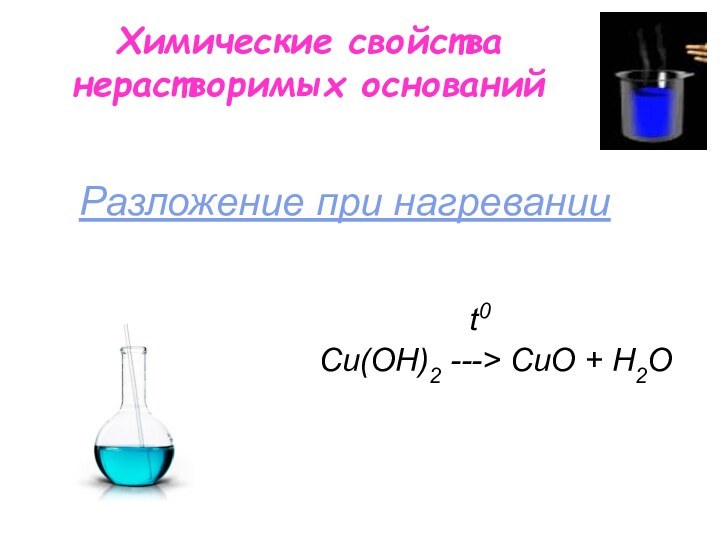
Химические свойства нерастворимых оснований
t0
Сu(OН)2 ---> СuO + H2O
Разложение при нагревании
Слайд 7
Способы получения растворимых оснований (щелочей)
1. Взаимодействие щелочных и
щелочно-земельных металлов с водой
2Na + 2H2O = 2NaOH + H2
2. Взаимодействие оксидов щелочных и щелочно-земельных металлов с водой
СаO + H2O = Са(OН)2





























