- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Хром
Содержание
- 2. Положение в периодической таблицеАтомный номер – 24Символ – CrПериод – 4Группа – побочная VI
- 3. Строение атомаКоличество протонов (p+) и электронов (e-)
- 4. Степени окисленияСтепень окисления Cr+2 Оксид хрома II
- 5. ИСТОРИЯ ОТКРЫТИЯВ 1766 году в окрестностях Екатеринбурга
- 6. Физические свойстваХром обладает всеми свойствами металла –
- 7. Химические свойстваВзаимодействие с неметаллами:4Cr + 3O2 =
- 8. Взаимодействие с кислотамиCr + 2HCl = CrCl2
- 9. Получение хромаFeO · Cr2O3 + 4C → Fe + 2Cr + 4CO↑
- 10. Применение хромаВажнейший легирующий элементПроизводство огнеупоровДекоративные коррозионно-стойкие покрытияКраскаПроизводство кожиХромированный MercedesКраска из хрома
- 11. Биологическая рольХром - один из биогенных элементов,
- 12. Скачать презентацию
- 13. Похожие презентации
Положение в периодической таблицеАтомный номер – 24Символ – CrПериод – 4Группа – побочная VI











Слайд 3
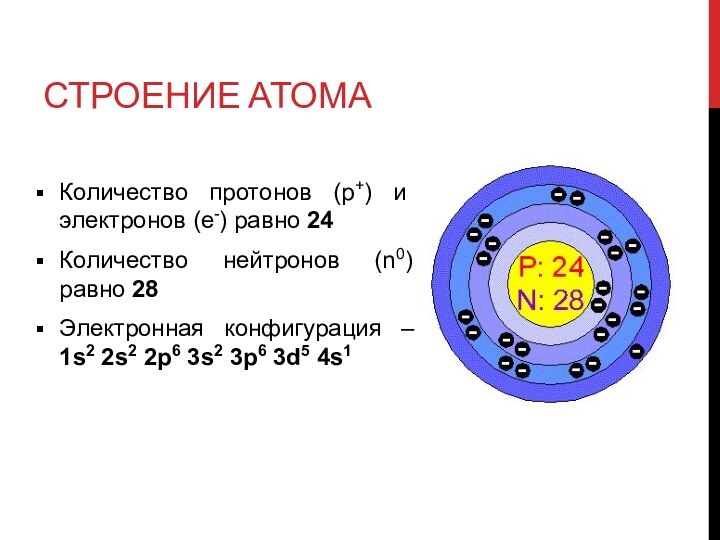
Строение атома
Количество протонов (p+) и электронов (e-) равно
24
Количество нейтронов (n0) равно 28
Электронная конфигурация – 1s2 2s2
2p6 3s2 3p6 3d5 4s1
Слайд 4
Степени окисления
Степень окисления Cr+2
Оксид хрома II (CrO)
Галогениды
(CrF2, CrI2, CrCl2, ClBr2)
Степень окисления Cr+3
Oксид хрома III (Cr2O3)
Гидроксид
Cr(OH)3Степень окисления Cr+4
Оксид хрома IV (CrO2)
Степень окисления Cr+6
Оксид хрома VI (CrO3)
Ряд кислот (H2CrO4, H2Cr2O7)
Оксид хрома(VI)
Оксид хрома(III)
Слайд 5
ИСТОРИЯ ОТКРЫТИЯ
В 1766 году в окрестностях Екатеринбурга был
обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4.
Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл.Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Образцы крокоита из Тасмании
Слайд 6
Физические свойства
Хром обладает всеми свойствами металла – хорошо
проводит тепло и электрический ток, имеет характерный металлический блеск.
Главная особенность хрома - устойчивость к действию кислот и кислорода.Температура плавления - 1875°C
При температуре около 37°C некоторые физические свойства этого металла резко, скачкообразно меняются; ученые объяснить эту аномалию пока не могут.
Слайд 7
Химические свойства
Взаимодействие с неметаллами:
4Cr + 3O2 = 2Cr2O3
2Cr
+ 3Cl2 = 2CrCl3.
2Cr + N2 = 2CrN
2Cr +
3S = Cr2S3Взаимодействие с водой:
2Cr + 3H2O = Cr2O3 + 3H2
Восстановление металлов из оксидов и солей:
2Cr + 3CuCl2 = 2CrCl3 + 3Cu
Слайд 8
Взаимодействие с кислотами
Cr + 2HCl = CrCl2 +
H2
Cr + H2SO4 = CrSO4 + H2
4Cr + 12HCl
+ 3O2 = 4CrCl3 + 6H2O2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O
Взаимодействие с щелочными реагентами
2Cr + 6KOH = 2KCrO2 + 2K2O + 3H2
Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O
Слайд 10
Применение хрома
Важнейший легирующий элемент
Производство огнеупоров
Декоративные коррозионно-стойкие покрытия
Краска
Производство кожи
Хромированный
Mercedes
Краска из хрома
Слайд 11
Биологическая роль
Хром - один из биогенных элементов, постоянно
входит в состав тканей растений и животных.
Отравления Хромом, и
его соединениями встречаются при их производстве; в машиностроении; металлургии; при изготовлении кож, красок и т. д. Токсичность соединений Хрома зависит от их химические структуры: дихроматы токсичнее хроматов, соединения Cr (VI) токсичнее соединений Cr(II), Cr(III).Начальные формы заболевания проявляются ощущением сухости и болью в носу, першением в горле, затруднением дыхания, кашлем; они могут проходить при прекращении контакта с Хромом. При длительном контакте с соединениями Хрома развиваются признаки хронические отравления: головная боль, слабость, диспепсия, потеря в весе и других.