и неорганическая химия.
Ахметов Н. С. Общая и неорганическая
химия. Чупахин А. П. Общая химия. Химическая связь и строение вещества.
Глинка Н.Л. Общая химия.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть











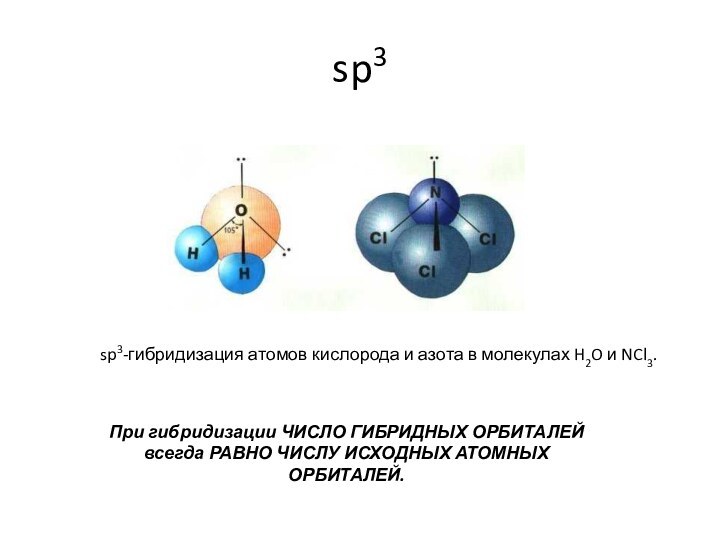

![Геометрия молекул dsp3Устойчивый диамагнитный комплекс пентацианоникколат(II)-ион [Ni(CN)5]3- имеет форму квадратной пирамиды:](/img/tmb/15/1437397/90df0e162ed09f0fc6c3cef1e57a151d-720x.jpg)
![Геометрия молекул d2sp3Октаэдрический комплекс никеля(II) [Ni(H2O)6]2+, хотя и парамагнитен, но достаточно устойчив. Его образование обусловленоsp3d2-гибридизацией атомных орбиталей никеля:](/img/tmb/15/1437397/d09d2947dab7fddf51cf77cd87842dd1-720x.jpg)

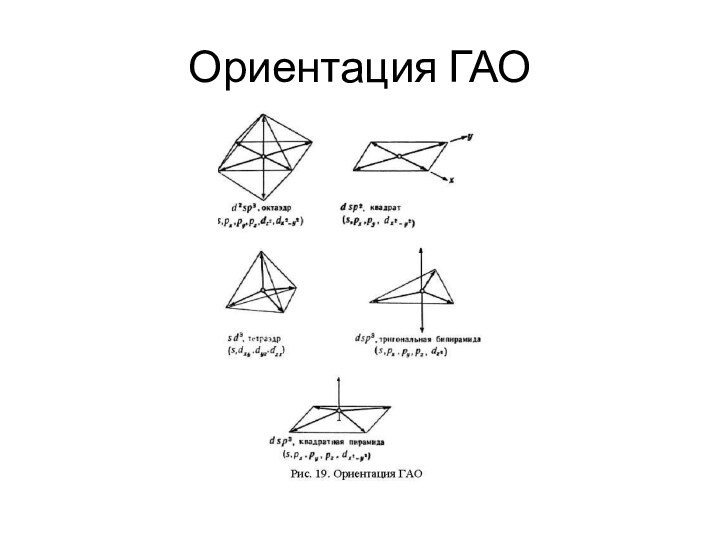


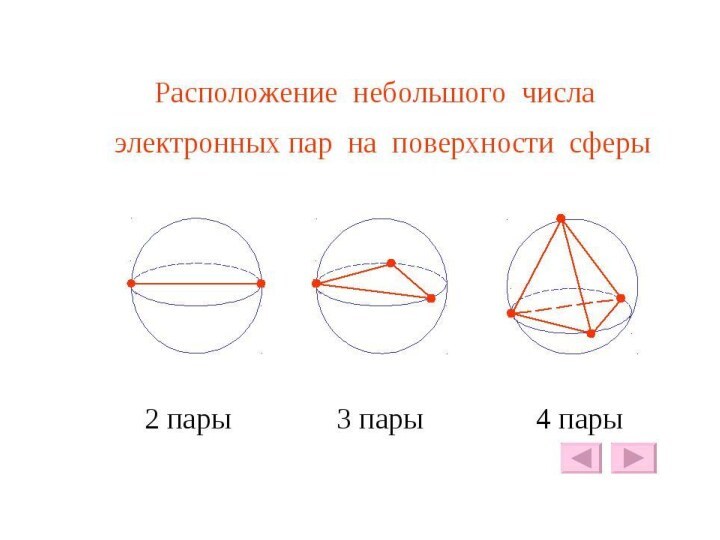
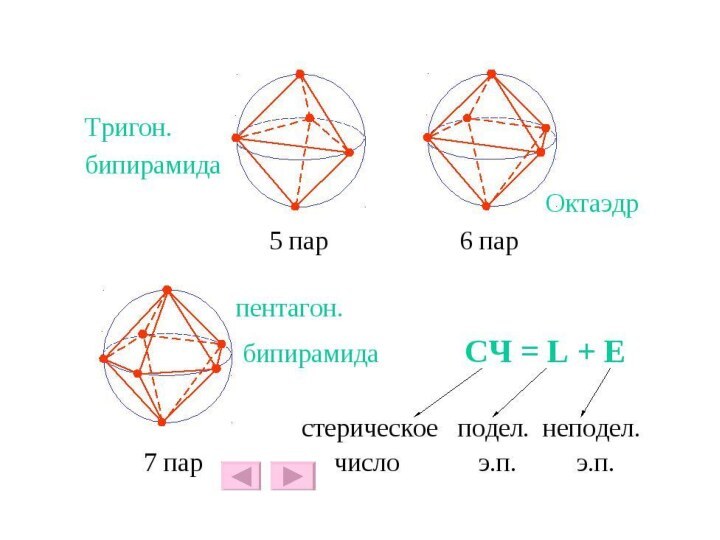






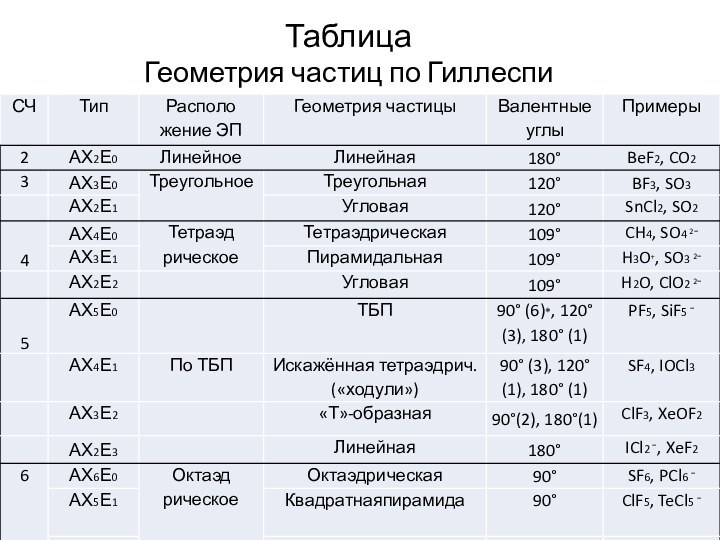











Чупахин А. П. Общая химия. Химическая связь и строение вещества.
Глинка Н.Л. Общая химия.