Слайд 2
Термодинамика химической коррозии
Первопричиной химической коррозии металлов является их
термодинамическая неустойчивость в различных средах при данных внешних условиях.
Стремление металла перейти из металлического в ионное состояние характеризуется величиной уменьшения свободной энергии, что и составляет сущность процесса химической коррозии.
Слайд 3
В качестве критерия равновесия и самопроизвольности процессов коррозии
металлов наиболее удобно пользоваться изобарно-изотермическим потенциалом.
ΔG – функцией состояния
системы, убыль которой в обратимом процессе при постоянных давлениях и температуре равна максимальной полезной работе.
Таким образом, процесс можно охарактеризовать тремя состояниями системы:
1) коррозионный процесс невозможен ΔG > 0;
2) коррозионный процесс возможен ΔG < 0;
3) система находится в равновесии ΔG = 0.
Слайд 4
Наиболее общим методом расчета ΔG является определение его
из данных химического равновесия по уравнению изотермы химической реакции.
Так, для наиболее распространенного процесса коррозии металлов реакция окисления металла кислородом описывается уравнением:
Слайд 5
Уравнение изотермы химической реакции будет представлено следующим образом:
Слайд 6
По уравнению можно оценить возможность протекания процесса окисления
металла.
Большинство коррозионных реакций являются обратимыми, и при помощи
законов термодинамики можно определить вероятность образования соединения.
Изменение внутренней энергии связано с количеством выделяемой теплоты Q и величиной совершаемой работы A:
Слайд 7
Энергия вещества при постоянном давлении характеризуется энтальпией:
где ΔHp
– энтальпия при постоянном давлении
Слайд 8
Движущей силой процесса является изобарно-изотермический потенциал ΔG, который
является свойством вещества, выражающим одновременно как энтальпию, т.е. энергию,
так и энтропию – степень беспорядка. Эти величины связаны уравнениями:
Слайд 9
Структура металлов и ее влияние на коррозионные процессы.
влияют
на процесс коррозии:
Механизм образования поверхностных соединений.
Адгезия поверхностных соединений
к металлу
Эти показатели во многом определяются структурой и составом металла
В ряде случаев кристаллографическая структура определяет коррозионную устойчивость металлов и их сплавов.
Слайд 10
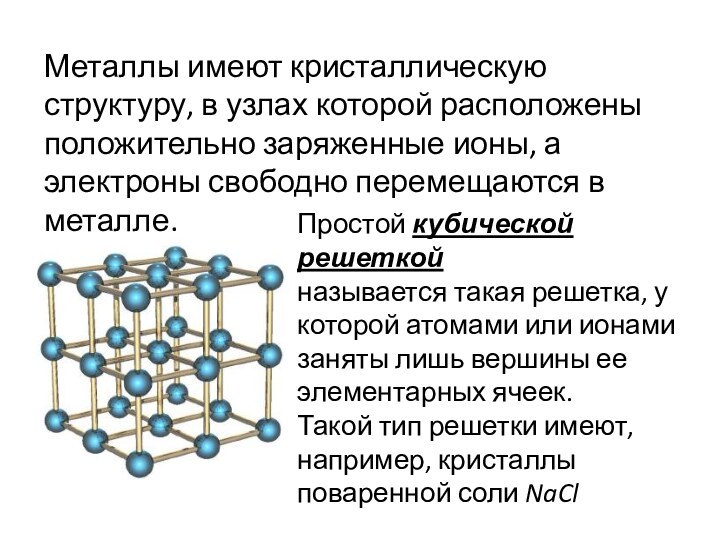
Металлы имеют кристаллическую структуру, в узлах которой расположены
положительно заряженные ионы, а электроны свободно перемещаются в металле.
Простой
кубической решеткой
называется такая решетка, у которой атомами или ионами заняты лишь вершины ее элементарных ячеек.
Такой тип решетки имеют,
например, кристаллы поваренной соли NaCl
Слайд 11
Кристаллические структуры металлов
1. Объемноцентрированная кубическая решетка (ОЦК)
(Na, K,
α-Fe, δ-Fe, V, Cr, Mo, W)
координационное число: к.ч. =
8
плотность упаковки: ρ = 68 %
Слайд 12
Решетка, у которой кроме вершин атомом или ионом
занят центр, называется объемно-центрированной. Такое кристаллическое строение имеют литий,
натрий, калий, ванадий, хром, α–железо (при температурах до 900 °С).
Слайд 13
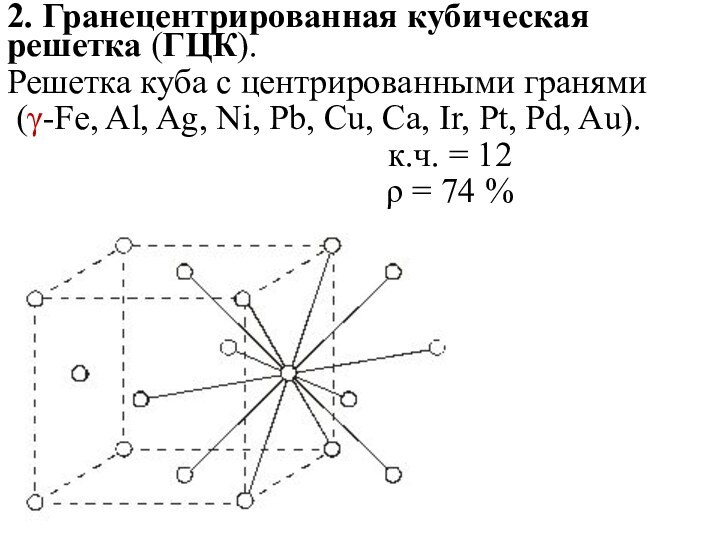
2. Гранецентрированная кубическая решетка (ГЦК).
Решетка куба с центрированными
гранями
(γ-Fe, Al, Ag, Ni, Pb, Cu, Ca, Ir,
Pt, Pd, Au).
к.ч. = 12
ρ = 74 %
Слайд 14
Гранецентрированной называется такая решетка, у которой материальными частицами
заняты центры граней.
Такой тип кристаллической решетки имеют алюминий,
никель, медь, свинец, серебро, золото, платина, γ–железо (в интервале температур 900-1400 °С)
Слайд 15
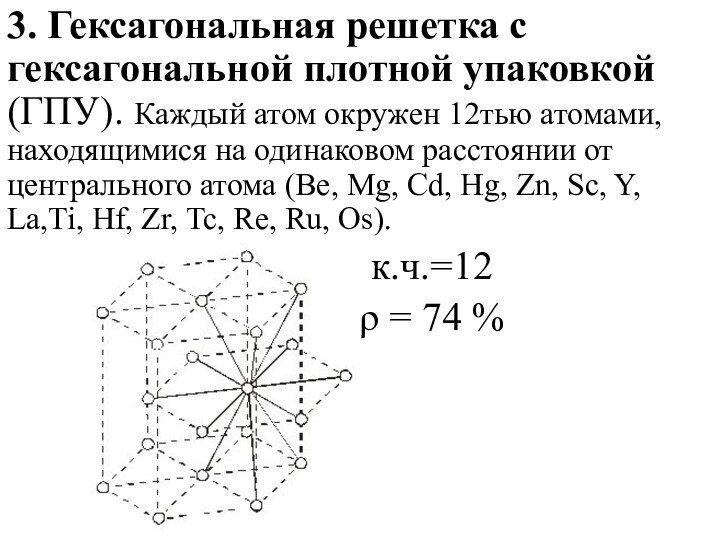
3. Гексагональная решетка с гексагональной плотной упаковкой (ГПУ).
Каждый атом окружен 12тью атомами, находящимися на одинаковом расстоянии
от центрального атома (Be, Mg, Cd, Hg, Zn, Sc, Y, La,Ti, Hf, Zr, Tc, Re, Ru, Os).
к.ч.=12
ρ = 74 %
Слайд 16
В отличие от идеальных кристаллов, в которых атомы
кристаллической решетки расположены строго периодично, реальные кристаллы всегда имеют
нарушения регулярности структуры (разупорядоченность), которые называются дефектами.
Дефекты кристаллических решеток изменяют заданные свойства металлов, влияют на его химические и электрохимические характеристики.
Дефекты структуры, выходящие на поверхность металла, обладают повышенной реакционной способностью, и они являются первыми очагами коррозии.
Слайд 17
Известны четыре типа точечных дефектов:
Вакансии;
Примесные атомы замещения и
внедрения;
Дислоцированные атомы;
дефекты Френкеля;
Слайд 18
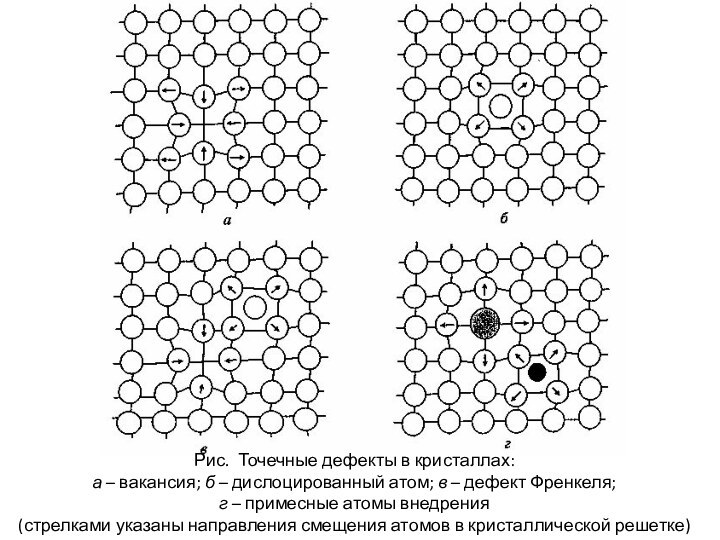
Рис. Точечные дефекты в кристаллах:
а – вакансия; б
– дислоцированный атом; в – дефект Френкеля;
г – примесные
атомы внедрения
(стрелками указаны направления смещения атомов в кристаллической решетке)
Слайд 19
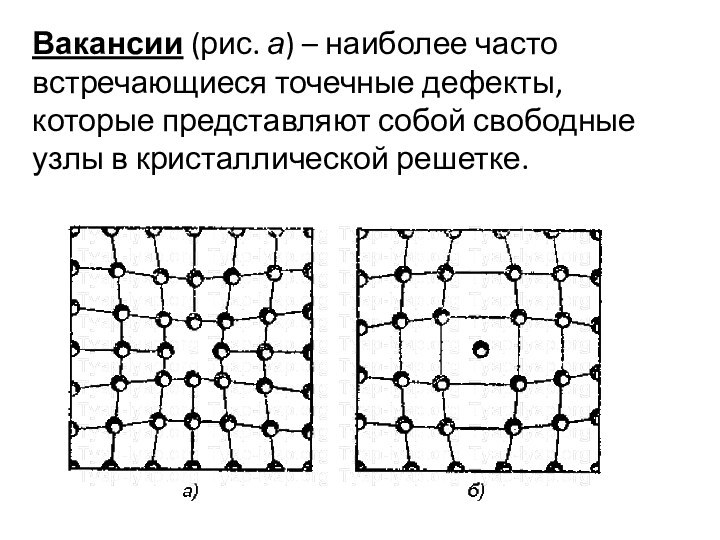
Вакансии (рис. а) – наиболее часто встречающиеся точечные
дефекты, которые представляют собой свободные узлы в кристаллической решетке.
Слайд 20
Вакансии возникают за счет тепловых колебаний атомов, при
воздействии на металл механических напряжений, радиоактивного излучения и других
факторов.
При образовании вакансий кристаллическая решетка искажается, а ближайшие атомы смещаются от своего равновесного состояния.
Слайд 21
Дислоцированные атомы (рис. б) – атомы основного металла,
смещенные из своих равновесных положений в межузельные пространства; местами
их расположения являются пустоты наибольшего объема.
Слайд 22
Если вакансии и дислоцированные атомы образуются одновременно, то
возникают парные дефекты, называемые дефектами Френкеля (рис. в), концентрация
которых в металлических материалах ниже, чем остальных точечных дефектов.
Точечные дефекты существенно влияют на процессы диффузии ионов металла при образовании поверхностных оксидных пленок.
Слайд 23
В реальных металлических материалах дислокации образуют сплошную трехмерную
сетку с узлами. В узлах происходит пересечение отдельных дислокаций,
расстояние между которыми оценивается как ≈ 10-6 м
К плоскостным и поверхностным дефектам кристаллической решетки относят границы, разделяющие различно ориентированные области
Слайд 24
Строение границ в простой кубической решетке:
а – граница
скручивания;
б – двойник с когерентной границей;
в, г –
границы зерен, разориентированные под большим углом;
г – общий вид
Слайд 25
Типы границ различаются углом разориентировки (Ω)
Чем больше величина
угла разориентировки, тем выше энергия кристаллической решетки, но всегда
энергия решетки, содержащей поверхностные дефекты, выше, чем содержащей линейные
Дефекты кристаллической решетки способствуют протеканию в металле процессов диффузии и фазовых превращений.
Взаимодействие дефектов, приводящее к снижению энергии кристаллической решетки, – характерное явление для металлических материалов.
Слайд 26
а – расположение двух кристаллов с углом разориентировки;
б
– малоугловая граница
Образование малоугловой границы:
Слайд 27
Любой вид дефекта приводит к увеличению скорости коррозии.
Для повышения коррозионной стойкости металла производят технологические операции, такие
как закалка, отжиг и др.
Легирование повышает коррозионную стойкость металла, и он становится многокомпонентным сплавом. Легирующие и примесные элементы могут вступать друг с другом во взаимодействие, образуя фазы, однородные по структуре и составу (интерметаллиды) и ограниченные поверхностями раздела.
Слайд 28
В сплавах могут существовать твердые растворы замещения и
внедрения.
В растворах замещения атомы компонентов могут замещать друг
друга в любом месте узла кристаллической решетки.
В растворах внедрения атомы растворенного компонента располагаются между узлами решетки растворителя.
Слайд 29
Схемы образования твердого раствора (или смешанного кристалла) в
металлах: а – решетка металла-растворителя; б – твердый раствор
замещения; в – фаза со сверхструктурой; г – твердый раствор внедрения.
Слайд 30
Коррозия металлов в неэлектролитах
Коррозия в неэлектролитах – это
коррозия в жидкостях, не проводящих электрический ток.
К неэлектролитам
относятся, например, бром, расплавленная сера, многие органические вещества (бензол, хлороформ, фенол и т.д.), жидкое топливо (нефть, керосин, бензин), смазочные масла.
Слайд 31
Коррозия металлов и сплавов в безводных растворах неэлектролитов
протекает с меньшей скоростью, чем в растворах электролитов, и
преимущественно по химическому механизму, однако все же приводит к значительным разрушениям металлической аппаратуры.