Слайд 2
Документы, которые определяют структуру и содержание экзаменационной работы
ЕГЭ 2015 года:
Кодификатор элементов содержания и требований к уровню
подготовки выпускников общеобразовательных учреждений для проведения в 2015 году единого государственного экзамена по химии (далее - кодификатор);
Спецификация контрольных измерительных материалов для проведения в 2015 году единого государственного экзамена по химии (далее - спецификация);
Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена по химии 2015 года.
Слайд 3
Предназначение кодификатора
определяет общий объём содержания курса химии, проверяемого
на экзамене
Слайд 4
Структура кодификатора
состоит из двух частей:
Часть 1 «Перечень элементов
содержания, проверяемых на едином государственном экзамене по химии»
Часть 2
«Перечень требований к уровню подготовки, проверяемых на едином государственном экзамене по химии»
Слайд 5
Часть 1 «Перечень элементов содержания, проверяемых на едином
государственном экзамене по химии»
перечислены те понятия, законы, теоретические положения
курса химии, знание которых проверяется заданиями экзаменационной работы 2015 года
выделены четыре крупных блока:
блок 1 «Теоретические основы химии»,
блок 2 «Неорганическая химия»,
блок 3 «Органическая химия»,
блок 4 «Методы познания в химии; химия и жизнь». Первый и четвёртый блоки подразделены в свою очередь на несколько содержательных линий.
В каждом из блоков и содержательных линиях выделены элементы содержания курса химии..
Этих элементов содержания в кодификаторе 56.
Слайд 6
Часть 2 «Перечень требований к уровню подготовки, проверяемых
на едином государственном экзамене по химии»
содержит перечень операционализированных умений,
которые должны быть сформированы в процессе усвоения соответствующей системы знаний
В части 2 выделены два крупных блока умений и видов деятельности, составляющих основу требований к уровню подготовки выпускников:
Блок «Уметь»
Блок «Знать/понимать:»
Слайд 7
«Спецификация контрольных измерительных материалов для проведения в 2015
году единого государственного экзамена по химии»
наиболее полно характеризует структуру и содержание экзаменационной работы и показывает, в чем состоит её назначение, а также обозначает условия проведения экзамена
Слайд 8
В спецификации
подробно описаны
структура и план экзаменационной работы
ЕГЭ по химии этого года;
дана характеристика проверочных заданий
различных типов,
показано, как они распределяются по частям работы, по содержательным блокам и содержательным линиям, по видам проверяемых умений и способам действий;
представлена система оценивания отдельных заданий и всей работы в целом;
дано описание уровня подготовки выпускников, достижение которого может гарантировать получение минимального количества баллов ЕГЭ;
указаны время выполнения работы,
дополнительные материалы и оборудование, которыми можно пользоваться на экзамене;
даны общие рекомендации по подготовке к ЕГЭ
Слайд 9
Изменения в КИМ ЕГЭ 2015 года по сравнению
с 2014 годом
1. Изменена структура варианта КИМ: каждый вариант
состоит из двух частей и включает в себя 40 заданий (вместо 42 заданий в 2014 году), различающихся формой и уровнем сложности. Задания в варианте представлены в режиме последовательной нумерации.
2. Уменьшено число заданий базового уровня сложности с 28 до 26 заданий.
3. Максимальный балл за выполнение всех заданий экзаменационной работы 2015 года составляет 64 (вместо 65 баллов в 2014 году).
4. Изменена шкала оценивания задания на нахождение молекулярной формулы вещества. Максимальный балл за его выполнение – 4 (вместо 3 баллов в 2014 году).
Слайд 10
Система оценивания заданий
Верное выполнение каждого из
заданий с порядковыми номерами 1 – 26 базового уровня
сложности оценивается в 1 балл.
Задание считается выполненным верно, если в бланке ответов указана цифра, соответствующая номеру правильного ответа.
За выполнение задания ставится 0 баллов, если:
а) указан номер неправильного ответа;
б) указаны номера двух и более ответов, среди которых может быть и правильный;
в) ответ в бланке отсутствует
Слайд 11
Система оценивания заданий
Верное
выполнение каждого из заданий с порядковыми номерами 27 –
35 повышенного уровня сложности в части 1 оценивается
2 баллами.
Ставится 1 балл, если в ответе допущена одна ошибка.
Ставится 0 баллов, если:
а) в ответе допущено более одной ошибки;
б) ответ в бланке отсутствует.
Слайд 12
Система оценивания заданий
За верное выполнение всех заданий
экзаменационной работы можно максимально получить 64 первичных баллов
Слайд 13
Дополнительные справочные материалы:
Периодическая система химических элементов Д.И. Менделеева;
таблица растворимости солей, кислот и оснований в воде;
электрохимический ряд
напряжений металлов.
Слайд 14
Демонстрационный вариант
представляет собой образец экзаменационной работы, составленный в
соответствии со спецификацией
на его примере можно получить представление о
том, какие виды заданий включаются в экзаменационную работу, какие правила необходимо соблюдать при выполнении заданий, какие требования предъявляются к записи ответов на задания
не является точной копией какого либо варианта экзаменационной работы 2015 года
Слайд 15
Обобщённый план экзаменационной работы
Всего заданий в экзаменационной работе
40
Для каждой позиции в плане указаны:
проверяемые элементы содержания
и их коды по кодификатору;
коды требований;
уровень сложности задания;
максимальный балл за выполнение каждого задания;
примерное время выполнения задания (мин.)
Слайд 16
Задание 1
Строение электронных оболочек атомов элементов первых
четырех периодов: s-, p- и d-элементы.
Электронная конфигурация атома. Основное
и возбужденное состояние атомов.
Слайд 17
Примеры задания 1
Два неспаренных электрона
на внешнем уровне в основном состоянии имеет атом
1)магния
2)углерода
3)хлора
4)бериллия
Возбуждённому состоянию
атома соответствует электронная конфигурация
1)1s22s22p63s23p2
2)1s22s22p63s13p2
3)1s22s22p63s1
4)1s22s22p63s2
Слайд 18
Задание 2
Закономерности изменения химических свойств элементов и их
соединений по периодам и группам
Общая характеристика металлов IА–IIIА групп
в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Слайд 19
Примеры задания 2
В каком ряду химические элементы расположены
в порядке уменьшения их электроотрицательности?
1) Sb → As →
P
2) Li → Be → B
3) Li → Na → K
4) P → S → Cl
У какого из перечисленных элементов наиболее выражены металлические свойства?
1) Са
2) Mg
3) Nа
4) K
Слайд 20
Задание 3
Ковалентная химическая связь, ее разновидности и механизмы
образования.
Характеристики ковалентной связи (полярность и энергия связи).
Ионная
связь.
Металлическая связь.
Водородная связь.
Слайд 21
Примеры задания 3
Соединение с ионной связью образуется при
взаимодействии
1) P и O2
2) Na и H2
3) S и
О2
4) N2 и H2
В каком соединении одна из ковалентных связей образована по донорно-акцепторному механизму?
1) NH4Cl
2) SiН4
3) CH3Cl
4) CBr4
Слайд 22
Задание 4
Электроотрицательность.
Степень окисления и валентность химических элементов.
Слайд 23
Пример задания 4
Хлор проявляет положительную степень окисления в
соединениях с
1) фосфором
2) кислородом
3) водородом
4)
серой
Слайд 24
Задание 5
Вещества молекулярного и немолекулярного строения.
Тип кристаллической
решетки.
Зависимость свойств веществ от их состава и строения
Слайд 25
Пример задания 5
Вещество с высокой температурой
плавления, очень малой электропроводностью расплава, нерастворимое в воде, имеет
кристаллическую решётку
1) металлическую
2) ионную
3) молекулярную
4) атомную
Слайд 26
Задание 6
Классификация неорганических веществ.
Номенклатура неорганических веществ (тривиальная
и международная).
Слайд 27
Пример задания 6
Среди перечисленных веществ:
А) Ba(NO3)2
Б) Ca(HS)2
В) (NH4)2SО4
Г)
MgHPO4
Д) CaBr2
Е) NaHCO3
средними солями являются
1) БГЕ
2) АБГ
3) АВД
4)
ВДЕ
Слайд 28
Задание 7
Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных,
алюминия; переходных металлов: меди, цинка, хрома, железа.
Характерные химические свойства
простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Слайд 29
Задание 8
Характерные химические свойства оксидов: оснóвных, амфотерных,
кислотных.
Слайд 30
Задание 9
Характерные химические свойства оснований и амфотерных гидроксидов.
Характерные химические свойства кислот.
Слайд 31
Задание 10
Характерные химические свойства солей: средних,
кислых, оснóвных, комплексных (на примере
соединений алюминия и цинка).
Слайд 32
Задание 11
Взаимосвязь неорганических веществ
Слайд 33
Примеры заданий 7 - 11
При термическом разложении какой
соли не образуется твёрдый остаток?
1) NH4NO3
2) Ba(NO3)2
3) CaCO3
4)
KNO3
В схеме превращений
гидроксид железа(II) X оксид железа(III)
соединением Х является
1) карбид железа
2) хлорид железа(II)
3) гидроксид железа(III)
4) нитрид железа(II)
Слайд 34
Задание 12
Теория строения органических соединений: гомология и
изомерия (структурная и пространственная).
Типы связей в молекулах органических
веществ.
Гибридизация атомных орбиталей углерода.
Слайд 35
Пример задания 12
Изомером этанола является
1) СН3СООН
2) CH3–O–CH3
3) СН3СНО
4)
C3H7OH
Слайд 36
Задания 13 - 15
Характерные химические свойства
углеводородов: алканов,
циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола);
предельных
одноатомных и многоатомных спиртов, фенола;
альдегидов, предельных карбоновых кислот, сложных эфиров.
Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды).
Слайд 37
Пример задания
И бутан, и бутен реагируют с
1) аммиачным
раствором Ag2O
2) раствором KMnO4
3) хлором
4) бромной водой
Слайд 38
Задание 16
Основные способы получения
углеводородов
кислородсодержащих соединений
Слайд 39
Пример задания 16
При взаимодействии какого вещества с
водой можно получить уксусный альдегид?
1) C2H2
2) C2H5Cl
3) CH4
4) C2H4
Слайд 40
Задание 17
Взаимосвязь углеводородов и кислородсодержащих органических соединений
Слайд 41
Пример задания 17
В схеме превращений
веществом Х является
1) этаналь
2)
этанол
3) этан
4) оксид углерода(II)
Слайд 42
Задания 18 – 21
Ориентированы на проверку
знаний о химической реакции:
классификация химических реакций в неорганической и
органической химии;
скорость реакции, ее зависимость от различных факторов;
обратимые и необратимые химические реакции; химическое равновесие; смещение равновесия под действием различных факторов;
электролитическая диссоциация электролитов в водных растворах; сильные и слабые электролиты;
реакции ионного обмена.
Слайд 43
Пример задания
Изменение давления не влияет на
скорость реакции между
1) N2 и H2
2) Al и S
3)
CO и O2
4) H2 и Cl2
Слайд 44
Задание 22
Правила работы в лаборатории.
Правила безопасности при
работе с едкими, горючими и токсичными веществами, средствами бытовой
химии.
Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ.
Качественные реакции на неорганические вещества и ионы.
Идентификация органических соединений
Слайд 45
Пример задания 22
Верны ли следующие суждения о свойствах
указанных веществ, которые необходимо учитывать при работе с ними?
А.
Как метан, так и водород образуют взрывчатые смеси с воздухом.
Б. Соли ртути очень ядовиты.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 46
Задание 23
Понятие о металлургии: общие способы получения металлов.
Общие научные принципы химического производства (на примере промышленного получения
аммиака, серной кислоты, метанола).
Химическое загрязнение окружающей среды и его последствия.
Природные источники углеводородов, их переработка.
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки.
Слайд 47
Пример задания 23
Верны ли следующие суждения о производстве
метанола?
А. Для осуществления реакции СО + 2Н2 → СН3ОН используют высокое давление и катализатор.
Б. Реакция
синтеза метанола является эндотермической.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 48
На позициях 24, 25 и 26 присутствуют три
расчетные задачи
Выполнение этих заданий предполагает применение
умений проводить расчёты:
с использованием понятия «массовая доля вещества в растворе» (№ 24);
объемных отношений газов при химических реакциях (№ 25);
по термохимическим уравнениям (№ 25);
по уравнениям химических реакций (массы, объема газа, количества вещества одного из участвующих в реакции веществ) (№ 26).
Слайд 49
Пример задания
Согласно термохимическому уравнению реакции окисления
глюкозы
C6H12O6(тв) + 6O2(г) = 6CO2(г) + 6H2O(г) +
2800 кДж
выделилось 560 кДж теплоты.
Масса прореагировавшей глюкозы составляет
1) 65,5 г
2) 90 г
3) 45 г
4) 36 г
Слайд 50
Задания 27 - 32
Представляют собой задания повышенного уровня
сложности.
По форме предъявления условия – задания на установление
соответствия двух множеств.
Слайд 51
Задания 27 - 32
Проверяют усвоение следующих
элементов содержания:
Классификация и номенклатура органических соединений (27).
Степень окисления и
валентность химических элементов. Реакции окислительно-восстановительные (28).
Электролиз расплавов и растворов солей (29).
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная (30).
Характерные химические свойства неорганических веществ (31).
Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений (32).
Слайд 52
Пример задания 31
Установите соответствие между формулой вещества и
реагентами, с каждым из которых это вещество может взаимодействовать.
ФОРМУЛА
ВЕЩЕСТВА
А) Fe
Б) Cr2O3
В) H3PO4
Г) Na2CO3
РЕАГЕНТЫ
1) HBr, BaCl2, HNO3
2) Al(OH)3, SO2, Li3PO4
3) Ca, NH3, Zn(OH)2
4) H2SO4, KOH, Al
5) S, CuSO4, HCl
Слайд 53
Пример задания 32
Установите соответствие между формулами веществ и
реагентом, с помощью которого их можно различить.
ФОРМУЛЫ ВЕЩЕСТВ
А) H2O
и KOH(р-р)
Б) Fe(NO3)3(р-р) и FeCl3(р-р)
В) KBr(р-р) и AlBr3(р-р)
Г) Zn(OH)2 и Mg(OH)2
РЕАГЕНТ
1) NaОН(р-р)
2) AgNO3(р-р)
3) Н2О
4) H2SO4(разб.)
5) НСl(р-р)
Слайд 54
Задания 33 - 35
Представляют собой задания повышенного уровня
сложности.
По форме предъявления условия – задания на «множественный
выбор».
Слайд 55
Задания 33 - 35
Проверяют усвоение следующих элементов содержания:
Характерные
химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических
углеводородов (бензола и толуола). Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии (33);
Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, предельных карбоновых кислот, сложных эфиров (34).
Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки (35).
Слайд 56
Пример задания 35
И диметиламин, и анилин взаимодействуют с
1)
хлоридом кальция
2) гидроксидом натрия
3) бромоводородом
4) кислородом
5) серной кислотой
6) сульфатом
железа(II)
Слайд 57
Задания с развёрнутым ответом (36 - 40)
Проверяют усвоение
следующих элементов содержания:
Реакции окислительно-восстановительные (36).
Реакции, подтверждающие взаимосвязь различных
классов неорганических веществ (37).
Реакции, подтверждающие взаимосвязь органических соединений (38).
Расчеты по уравнениям реакций (39).
Нахождение молекулярной формулы вещества (40).
Слайд 58
Пример задания 36
Используя метод электронного баланса, составьте уравнение
реакции:
H2S + K2Cr2O7 + … … + Cr2(SO4)3 +
S + …
Определите окислитель и восстановитель.
Слайд 59
Пример задания 37
Смесь оксида
азота(IV) и кислорода пропустили через раствор гидроксида калия. Полученную
при этом соль высушили и прокалили. Остаток, полученный после прокаливания соли, растворили в воде и смешали с раствором иодида калия и серной кислотой. Образовавшееся в ходе этой реакции простое вещество прореагировало с алюминием.
Напишите уравнения четырёх описанных реакций.
Слайд 60
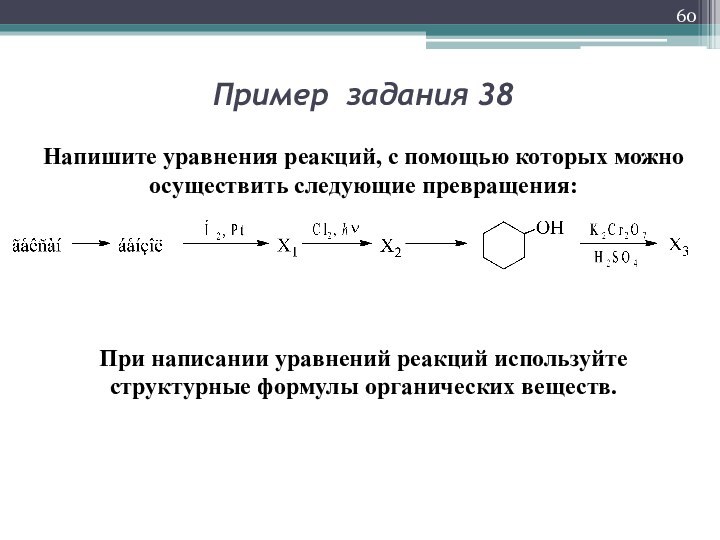
Пример задания 38
Напишите уравнения реакций, с помощью которых
можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные
формулы органических веществ.
:
.
Слайд 61
Пример задания 39
Фосфор массой 12,42 г прореагировал при нагревании с избытком хлора.
Полученный хлорид растворили в 700 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
Слайд 62
Пример задания 40
При сжигании образца некоторого
органического соединения массой 14,8 г получено 35,2 г углекислого
газа и 18,0 г воды.
Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди(II) образуется кетон.
На основании данных условия задания:
1) произведите вычисления необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с оксидом меди(II).
Слайд 63
Элементы ответа:
1) Найдено количество вещества продуктов сгорания:
Общая формула
вещества CxHyOz
n(CO2) = 35,2/44 = 0,8 моль; n(С)
= 0,8 моль
n(H2O) = 18,0/18 = 1,0моль; n(H) = 1,0 ∙2 = 2,0 моль;
m(O) = 14,8 – 0,8 ∙ 12 – 2 = 3,2 г;
n(O) = 3,2⁄16 = 0,2 моль
2) Определена молекулярная формула вещества:
Mист(CxHyOz) = 37 ∙ 2 = 74 г/моль;
x : y : z = 0,8 : 2 : 0,2 = 4 : 10 : 1
вычисленная формула C4H10O
Mвыч(CxHyOz) = 74 г/моль;
Молекулярная формула исходного вещества C4H10O
Слайд 64
Элементы ответа (продолжение)
3) Составлена структурная формула вещества:
4) Записано
уравнение реакции вещества с оксидом меди(II):