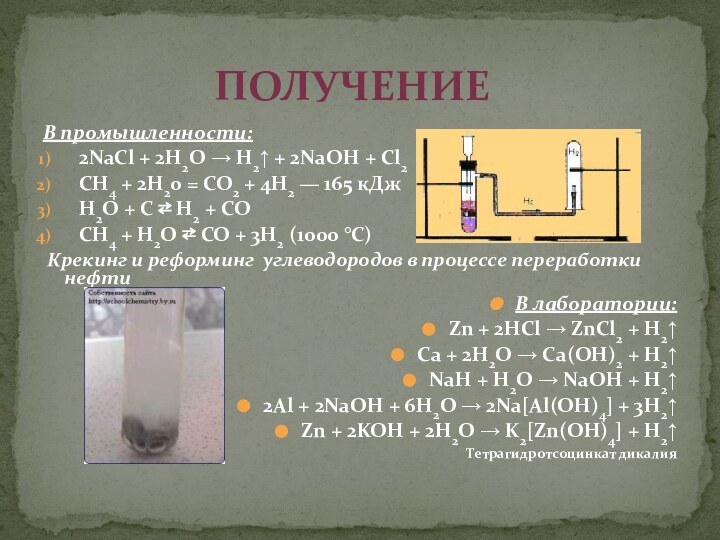
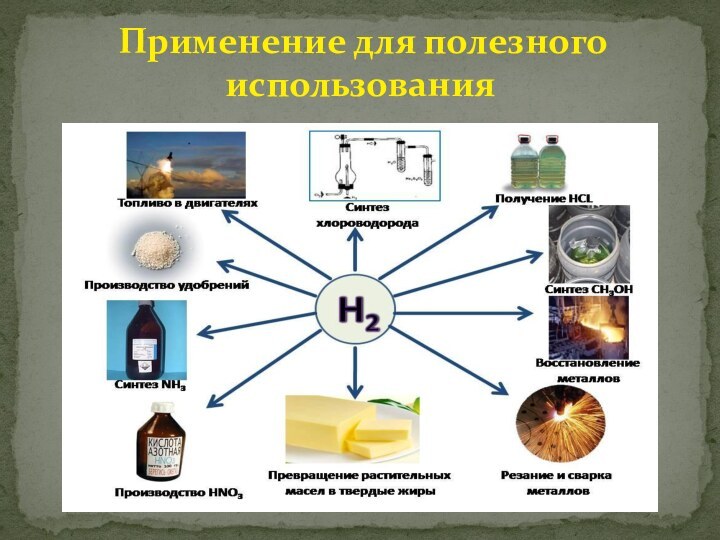
с атомным номером
1, атомная масса 1,00794. Характеризуя водород по положению в
периодической системе Менделеева,
Следует обратить внимание на особенности строения
Атома водорода — самого простейшего из химических
элементов (состоит из ядра, представляющего собой
один протон, и одного электрона).
Элемент водород расположен в первом периоде таблицы Менделеева. Его относят и к 1-й группе, и к 7-й группе.
Водород в ПСХЭ