- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Периодический закон и периодическая система химических элементов д.и.менделеева в свете учения о строении атома
Содержание
- 2. ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ АТОМАВ результате химических
- 4. МОДЕЛЬ СТРОЕНИЯ АТОМА ДЖ. ТОМСОНАВ 1904 г.
- 5. ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА Э. РЕЗЕРФОРДА согласно которой
- 6. КВАНТОВАЯ МОДЕЛЬ Н. БОРАПервый постулат. Электрон движется
- 7. ПРОТОННО-НЕЙТРОННАЯ ТЕОРИЯ ЯДРАВ 1932 г. была разработана
- 9. Атомное ядро каждого химического элемента характеризуется строго
- 10. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМАПод электронной оболочкой понимают совокупность
- 12. Электрон в атоме не имеет траектории движения,
- 13. ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯВ атомах химических элементов первый уровень
- 14. Каждую орбиталь могут занимать 2 электрона+10Ne1228↑↓↑↓↑↓↑↓↑↓1s22s22p6
- 15. Атомы элементов одного периода Периодической таблицы Д.И.Менделеева
- 16. к s-элементам относят элементы главных подгрупп I
- 18. ОТКРЫТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА Д. И. МЕНДЕЛЕЕВЫМОткрытию Периодического
- 19. В 1862 г. профессор Парижской высшей школы
- 21. В отличие от работ предшественников предложенная русским
- 23. В основу своей работы по классификации химических
- 24. На основании своих наблюдений 1 марта 1869
- 25. ВЫВОДЫВ результате мы пришли к нескольким важным
- 26. По горизонтали таблица Менделеева делится на семь
- 27. Период начинается активным металлом – переходит к
- 28. По вертикали химические элементы распределены по восьми
- 29. Скачать презентацию
- 30. Похожие презентации
ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ АТОМАВ результате химических реакций атомы не разрушаются, а лишь перегруппировываются: из атомов исходных веществ образуются новые комбинации тех же атомов, но уже в составе продуктов реакции. Иными словами, в химических реакциях атомы







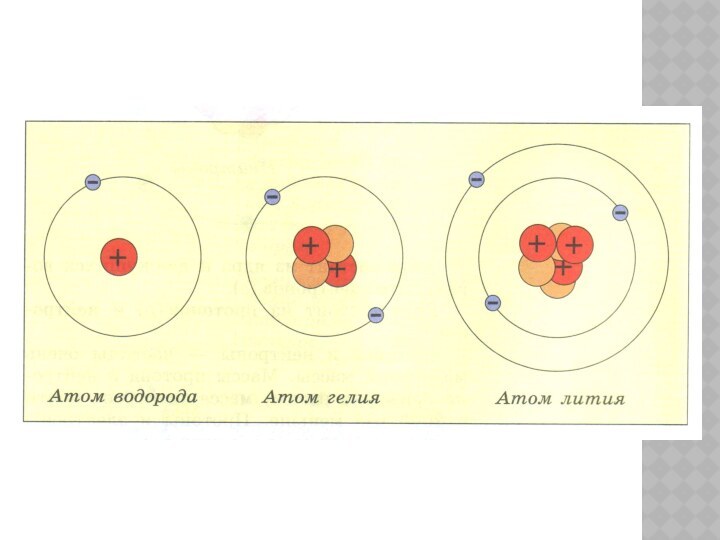




















Слайд 4
МОДЕЛЬ СТРОЕНИЯ АТОМА ДЖ. ТОМСОНА
В 1904 г. в
работе «О структуре атома» Дж.Томсон дал описание своей модели,
получившей образное название модели «пудинга с изюмом».Согласно этой модели атом подобен сферическому пудингу (или булочке с изюмом) с положительным зарядом. Внутрь сферы (пудинга) вкраплены отрицательно заряженные «изюмины» — электроны.
Электроны совершают колебательные движения, благодаря которым атом излучает электромагнитную энергию. В целом атом электронейтрален
Слайд 5
ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА Э. РЕЗЕРФОРДА
согласно которой атом
состоит из положительно заряженного ядра и электронов, движущихся вокруг
ядра по замкнутым орбитам подобно движению планет вокруг Солнца, не смогла объяснить излучение и поглощение энергии атомом.
Слайд 6
КВАНТОВАЯ МОДЕЛЬ Н. БОРА
Первый постулат. Электрон движется вокруг
ядра по строго определенным замкнутым стационарным орбитам в соответствии
с «разрешенными» значениями энергии Е1 Е2, ..., Еn. При этом энергия не поглощается и не излучается.Второй постулат. Электрон переходит из одного разрешенного энергетического состояния в другое, что сопровождается излучением или поглощением кванта энергии.
Слайд 7
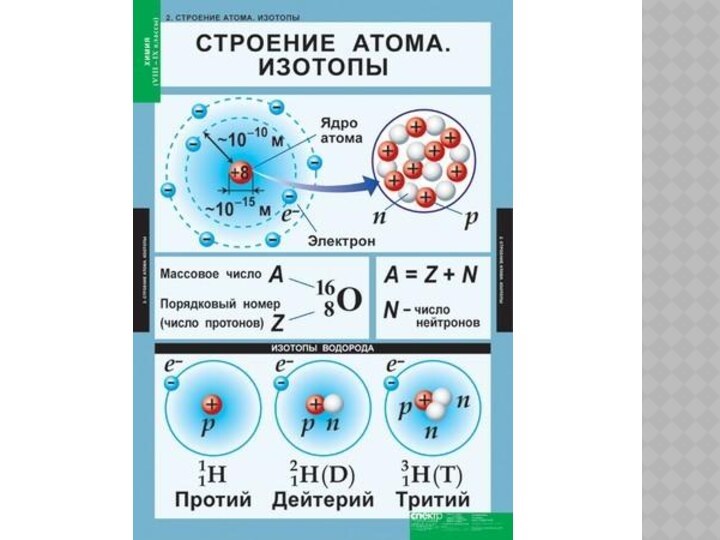
ПРОТОННО-НЕЙТРОННАЯ ТЕОРИЯ ЯДРА
В 1932 г. была разработана протонно-нейтронная
теория ядра, согласно которой ядра атомов состоят из протонов
и нейтроновНапример, в природе встречаются изотопы кислорода с массовыми числами 16, 17, 18 (160, 170, 180); изотопы хлора 35Сl и 37Сl; изотопы калия 39К и 40К
Слайд 9 Атомное ядро каждого химического элемента характеризуется строго определенным,
данным природой числом протонов в нем (порядковым номером в
Периодической системе химических элементов Д. И. Менделеева).А вот число нейтронов в атоме одного и того же элемента может быть разным. Следовательно, разными будут и относительные атомные массы таких разновидностей атомов химического элемента. Такие разновидности атомов, как вы знаете, называют изотопами.
Слайд 10
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА
Под электронной оболочкой понимают совокупность всех
электронов атома.
Важнейшей характеристикой электрона является энергия его связи с
атомом. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень.Наименьшей энергией обладают электроны первого энергетическою уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в Периодической таблице Д.И.Менделеева, которому принадлежит химический элемент: у атомов элементов первого периода — один уровень, второго периода — два уровня, седьмого периода — семь уровней.
Слайд 12 Электрон в атоме не имеет траектории движения, т.е.
можно говорить лишь о вероятности нахождения его в пространстве
вокруг ядра. Он может находиться в любой части пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда.Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называют орбиталью, или электронным облаком.
Существуют четыре типа орбиталей; их обозначают латинскими буквами: s, р, d, f.
s-Орбитали имеют сферическую форму, р-орбитали — форму гантели или объемной восьмерки, d-орбитали — форму листа клевера, f-орбитали — форму шестилепесткового цветка
Слайд 13
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
В атомах химических элементов первый уровень составляет
одна s-орбяталь, на которой находятся два s-электрона.
Второй энергетический
уровень также содержит s-орбиталь, но большего размера, так как запас энергии электронов на ней выше, чем у электронов первого уровня. Кроме того, на втором уровне будут содержаться также три p-орбитали. Это гантелеобразные орбитали одного размера, которые взаимно перпендикулярны подобно осям координат х, у, z. Третий энергетический уровень помимо одной и трех p-орбиталей содержит еще и пять d-орбиталей.
Четвертый энергетический уровень дополнительно к одной s-, трем р- и пяти d-орбиталям содержит также семь f-орбиталей.
Слайд 15 Атомы элементов одного периода Периодической таблицы Д.И.Менделеева отличаются
тем, что заряды их ядер возрастают на единицу (в
ядре на один протон становится больше), а, следовательно, на электронной оболочке становится на один электрон больше по сравнению с атомом предыдущего элемента.В зависимости от того, на какую орбиталь отправился последний электрон, химические элементы можно разделить на семейства (блоки): s, р, d, f
Слайд 16 к s-элементам относят элементы главных подгрупп I и
II групп Периодической системы химических элементов Д. И. Менделеева,
а также гелий;к р-элементам — элементы главных подгрупп П1 — VIII групп;
к d-элементам — элементы побочных подгрупп I — VIII групп;
к f-элементам — лантаноиды и актиноиды.
Слайд 18
ОТКРЫТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА Д. И. МЕНДЕЛЕЕВЫМ
Открытию Периодического закона
предшествовало накопление знаний о веществах и их свойствах. По
мере открытия новых химических элементов, изучения состава и свойств их соединений появлялись первые попытки классифицировать элементы по каким-либо признакам.Выдающийся шведский химик Й.Я.Берцелиус разделил все элементы на металлы и неметаллы на основании различий в свойствах образованных ими простых веществ и соединений (металлам соответствуют основные оксиды и основания, неметаллам — кислотные оксиды и кислоты).
В 1816 г. немецкий химик И.В.Деберейнер обнаружил сходство в тройках элементов, которые он назвал триадами. Действительно, похожими свойствами обладают литий, натрий и калий; сера, селен и теллур; хлор, бром и йод; кальций, стронций и барий.
Слайд 19 В 1862 г. профессор Парижской высшей школы А.Шанкуртуа
попробовал расположить химические элементы в порядке возрастания их атомных
масс по спирали на поверхности воображаемого цилиндра. Оказалось, что для элементов, находящихся друг под другом, характерно определенное сходство в химических свойствах.В 1865 г. английский химик Д. Ньюлендс расположил известные к тому времени элементы в порядке возрастания их атомных масс и обнаружил поразительное сходство между каждым восьмым элементом подобно строению музыкальной октавы, состоящей из восьми звуков. Свое открытие Д. Ньюлендс назвал законом октав
Слайд 21 В отличие от работ предшественников предложенная русским химиком
Д. И. Менделеевым Периодическая таблица химических элементов имела четкую
структуру в виде групп и периодов, в которой нашлось место не только для всех известных в то время элементов, но и были оставлены пустые места для еще не обнаруженных.Открытие Д. И. Менделеева позволило предсказать существование неизвестных элементов, спрогнозировать их свойства, исправить неверно определенные атомные массы уже известных элементов.
Слайд 23 В основу своей работы по классификации химических элементов
Д. И. Менделеев положил два их основных и постоянных
признака: атомную массу и свойства образуемых этими элементами веществ.Он выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях. Сопоставляя эти сведения, ученый составил естественные группы сходных по свойствам элементов.
При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно усиливаются или ослабевают), затем после резкого скачка периодически (т.е. через определенное число элементов) повторяются
Слайд 24 На основании своих наблюдений 1 марта 1869 г.
Д. И. Менделеев сформулировал Периодический закон:
Свойства простых тел, а
также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов (от их относительных атомных масс).На основании Периодического закона Д.И.Менделеев создал свою знаменитую таблицу химических элементов — графическое отображение Периодического закона.
Слайд 25
ВЫВОДЫ
В результате мы пришли к нескольким важным выводам.
Свойства
химических элементов находятся в периодической зависимости от величины положительного
заряда их атомных ядер.Причина сходства в свойствах элементов одной группы заключается в периодическом повторении конфигурации валентных электронов.
Номер внешнего энергетического уровня атома совпадает с номером периода, в котором расположен элемент.
Число валентных электронов, как правило, совпадает с номером группы элемента в Периодической системе и его высшей степенью окисления в соединениях.
Слайд 26 По горизонтали таблица Менделеева делится на семь периодов:
период I включает два элемента: водород Н и гелий
Не; период II начинается литием Li и оканчивается неоном Ne (8 элементов);
период III начинается натрием Na и оканчивается аргоном Аr (8 элементов).
периоды IV, V содержат по 18 элементов;
период VI включает 32 элемента;
период VII незаконченный; состоит пока из одного ряда.
Три первые периода, состоящие каждый из одного ряда, называют малыми периодами.
Периоды IV, V, VI включают по два ряда элементов; их называют большими периодами.
Слайд 27 Период начинается активным металлом – переходит к амфотерным
элементам – затем к неметаллам и заканчивается инертным газом
Слайд 28 По вертикали химические элементы распределены по восьми группам.
Каждая группа состоит из двух подгрупп — главной и
побочной. Подгруппа, в которую входят элементы и малых, и больших периодов, называют главной.
Подгруппа, в которую входят элементы только больших периодов, называют побочной.
Так, в главную подгруппу I группы входят литий, натрий, калий, рубидий и франций. Это подгруппа лития.
Побочная подгруппа I группы включает медь, серебро и золото (подгруппа меди).





























