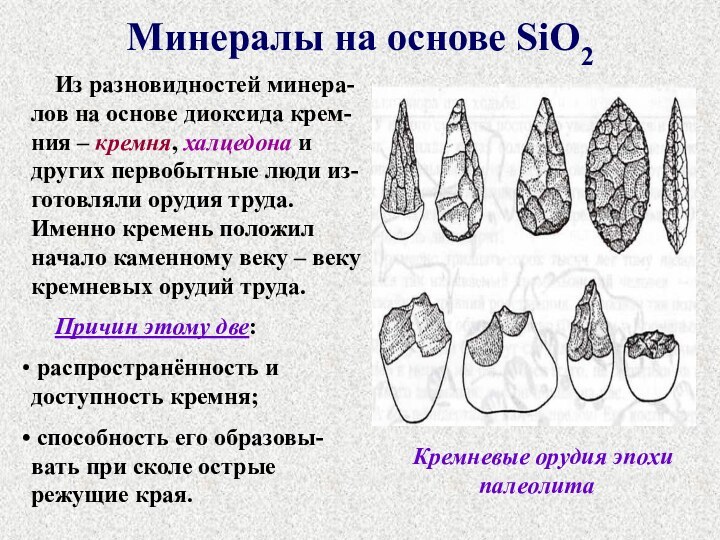
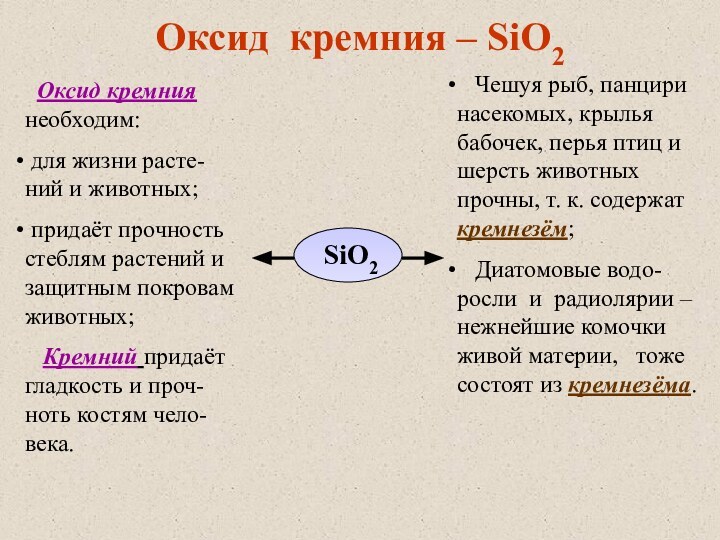
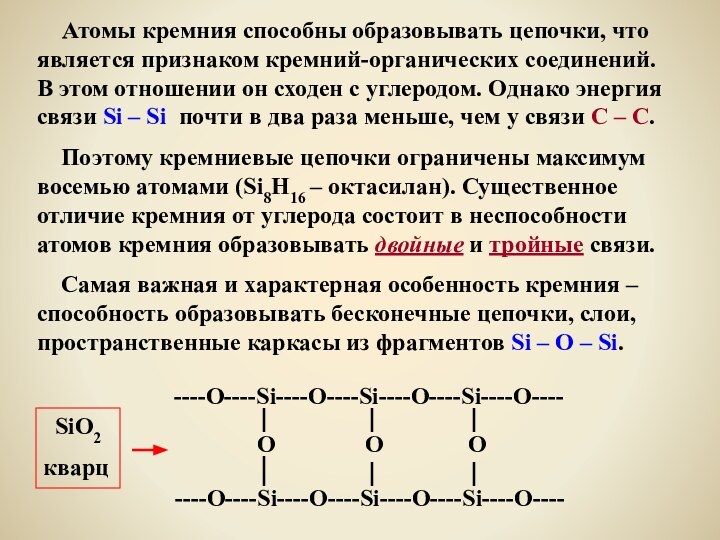
что является признаком кремний-органических соединений. В этом отношении он
сходен с углеродом. Однако энергия связи Si – Si почти в два раза меньше, чем у связи С – С.
Поэтому кремниевые цепочки ограничены максимум восемью атомами (Si8H16 – октасилан). Существенное отличие кремния от углерода состоит в неспособности атомов кремния образовывать двойные и тройные связи.
Самая важная и характерная особенность кремния – способность образовывать бесконечные цепочки, слои, пространственные каркасы из фрагментов Si – O – Si.
----О----Si----O----Si----O----Si----O----
O O O
----O----Si----O----Si----O----Si----O----
SiO2
кварц