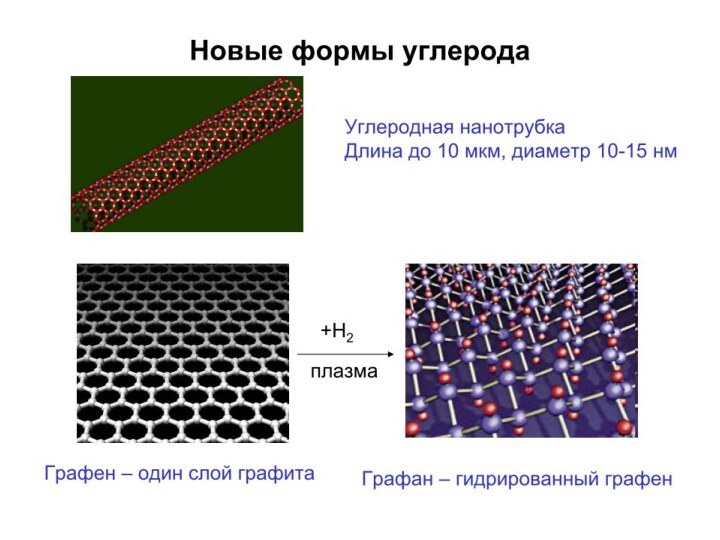
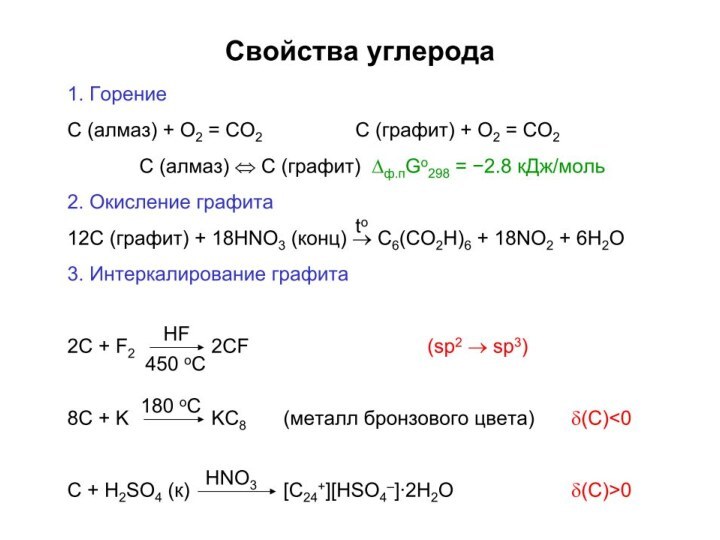
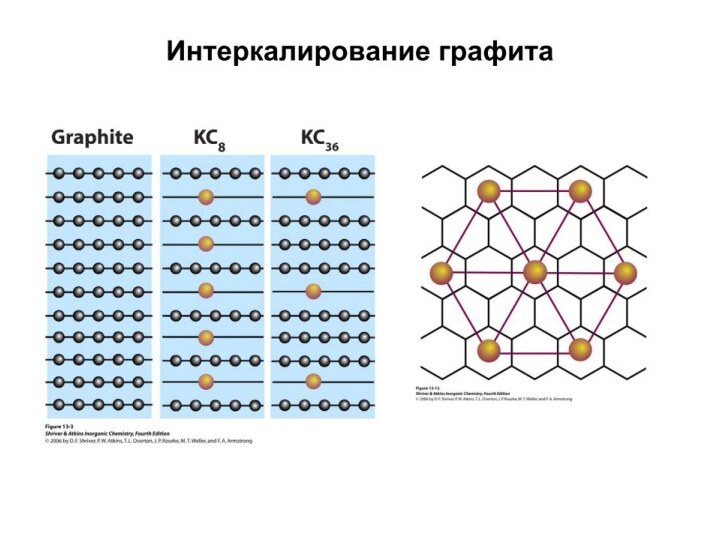
Слайд 3
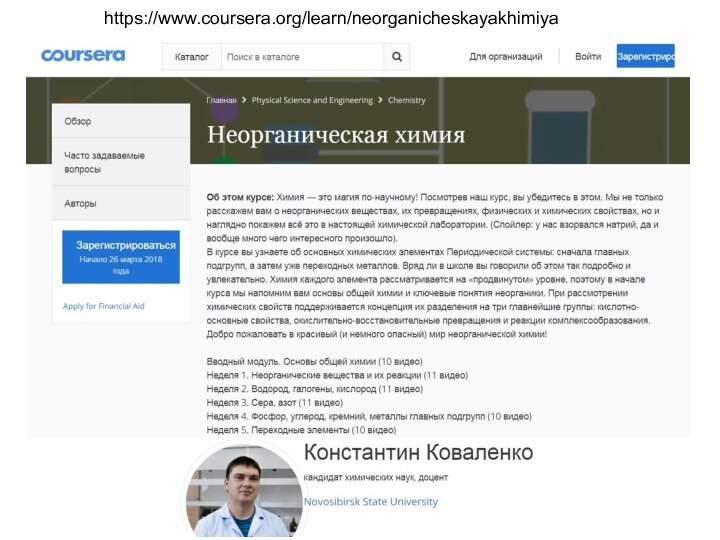
Электронные конфигурации в основном и возбужденном состоянии
ns2np2
CH4, CS2,
CO2, CH3CH2OH
CO, CN-
Валентность = 4
Валентность = 3
2 связи за
счет обобщения электронов
+ 1 связь донорно-акцепторная
Слайд 4
Распространенность и минералы
C – 11 место, CO2, CaCO3
(известняк, кальцит, мрамор), уголь, нефть, природный газ
Si – 2
место; SiO2 (кремнезем, кварц), силикаты, алюмосиликаты
Ge – 54 место, Cu3GeS4 (германит)
Sn – 27 место, SnO2 (касситерит)
Pb – 35 место, PbS (галенит), PbSO4 (англезит), PbCO3 (церуссит)
Слайд 5
Открытие элементов
C – известен с древнейших времен; лат.
«карбон» – уголь
Si – 1883 г., швед Берцелиус; от
лат. «силекс» – кремень
Ge - предсказан Менделеевым
в 1871 г., открыт нем. Винклером
в 1885 г., назван в честь Германии
Sn – известен давно, от лат. «станнум» – стойкий
Pb – известен давно, происхождение названия не ясно
Слайд 7
Простые вещества
ns2np2
Углерод богат на аллотропные модификации простого вещества!
-
графит (2d полимер)
- алмаз (3d полимер)
- карбин (1d полимер)
Слайд 8
ns2np2
Углерод богат на аллотропные модификации простого вещества!
- аморфный
углерод (= мелкие частицы графита)
Сажа
Кокс Древесный уголь
- фуллерены
Простые вещества
Слайд 9
Графит
Т. пл. 3800 °С, т. кип. 4000 °С,
плотность 2,27 г/см3, электропроводен, устойчив.
Типичный восст-ль (реагирует с водородом,
кислородом, фтором, серой, металлами).
Кристаллическая решетка слоистая (sp2-гибридизация).
Слайд 10
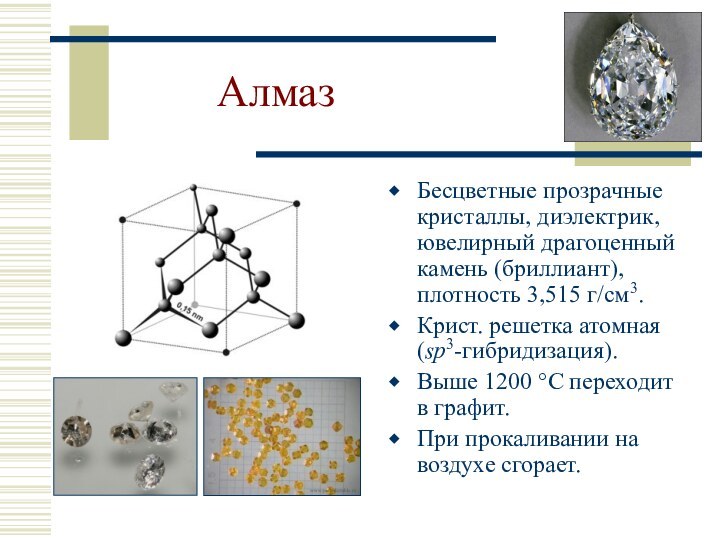
Алмаз
Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант),
плотность 3,515 г/см3.
Крист. решетка атомная (sp3-гибридизация).
Выше 1200 °С
переходит в графит.
При прокаливании на воздухе сгорает.
Слайд 11
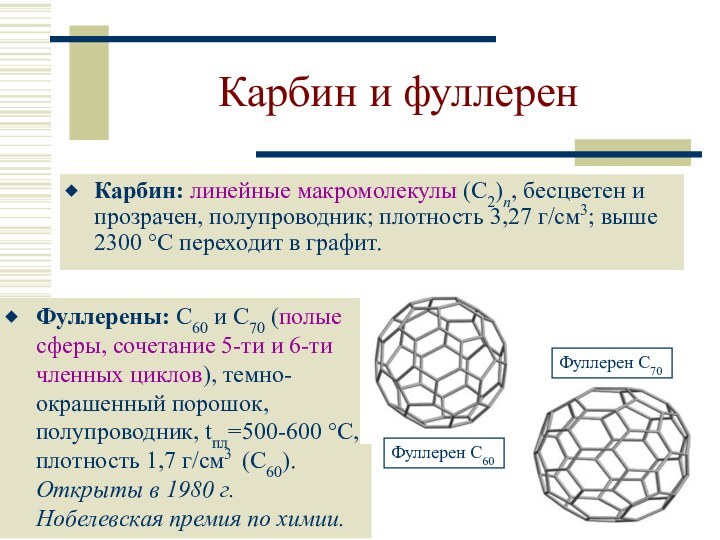
Карбин и фуллерен
Карбин: линейные макромолекулы (С2)n, бесцветен и
прозрачен, полупроводник; плотность 3,27 г/см3; выше 2300 °С переходит
в графит.
Фуллерены: С60 и С70 (полые сферы, сочетание 5-ти и 6-ти членных циклов), темно-окрашенный порошок, полупроводник, tпл=500-600 °C, плотность 1,7 г/см3 (С60). Открыты в 1980 г.
Нобелевская премия по химии.
Слайд 14
Основные степени окисления
+4 CO2, COCl2, CCl4, SCN-, Na2CO3,
KHCO3
+2 CN–, CO
0 C
–1 CaC2
–4 Al4C3
{C Ξ C}2–
Карбид (ацителенид) кальция
Карбид (метанид)
алюминия
Слайд 17
Карбиды
Карбиды подразделяются на следующие виды:
1) ионные / солеобразные
(CaC2, Al4C3);
2) молекулярные;
3) ковалентные или металлоидные (карборунд SiC, В4С);
4)
металлоподобные (цементит Fe3C, TiC, WC, ZrC и др.,
нет стехиометрии).
Слайд 18
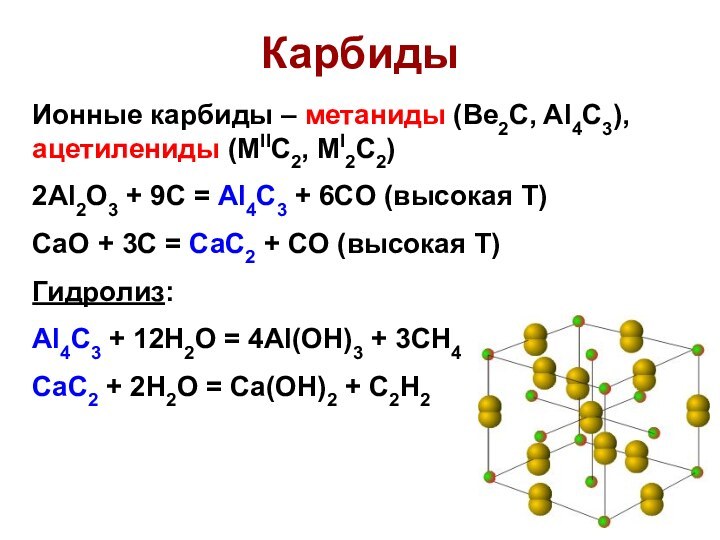
Карбиды
Ионные карбиды – метаниды (Be2C, Al4C3), ацетилениды (MIIC2,
MI2C2)
2Al2O3 + 9C = Al4C3 + 6CO (высокая Т)
CaO
+ 3C = CaC2 + CO (высокая Т)
Гидролиз:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
CaC2 + 2H2O = Ca(OH)2 + C2H2
Слайд 19
СО
1) Получение в промышленности:
CO2 + C кокс =
2CO (при Т)
С + H2O = CO + H2
(при Т)
2) Получение в лаборатории:
HCOOH = СO + H2O ( в конц. H2SO4)
H2C2O4 = СO + CO2 + H2O ( в конц. H2SO4)
Газ без цвета и запаха, легче воздуха, малорастворим
в воде, tкип. = –191,5 °С, ядовит («угарный газ»).
Слайд 20
Свойства СО
1) При н.у. нерастворим в воде, кислотах
и щелочах (несолеобразующий)
2) Но солеобразующий при 120
oC и 5 атм.:
CO + NaOHр-р= HCOONa
3) Восстановительные свойства (при Т):
2CO + O2 = 2CO2
CO + H2O = CO2 + H2
4CO + Fe3O4 = 3Fe + 4CO2 (пирометаллургия)
Слайд 21
Свойства СО
5) Комплексообразование:
CO образует прочные комплексы –
карбонилы:
Ni + CO = Ni(CO)4
Fe + 5CO =
Fe(CO)5
: C ::: O
Обнаружение СО:
а) PdCl2 + CO + H2O = Pd↓ + CO2 + 2HCl
б) I2O5 + 5CO = I2 + 5CO2
Слайд 22
СO2
1) Получение в промышленности:
СaCO3 = CaO + CO2
(Т)
С + O2 = CO2 (Т)
2) Получение в лаборатории
(ап. Киппа):
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Бесцветный газ, без запаха, тяжелее воздуха, умеренно растворим в воде (при комн. т. в 1 л воды ~ 1,7 л CO2)
В тв. сост. («сухой лёд») – молекулярная крист. решетка; tвозгонки = –78 °С, tпл. = –57 °С (Р = 5 атм)
Слайд 23
Свойства СO2
1) Не поддерживает горение
2) Окислитель:
а) активные металлы
(Mg, Na, K) горят в СО2:
2Mg + CO2 =
2MgO + C
б) при высокой температуре:
2Fe + CO2 = 2FeO + C
Слайд 24
Моногидрат CO2 . H2O и угольная кислота H2CO3
В водном растворе:
CO2 (г) + H2O ⮀ CO2 .
H2O ⮀ H2CO3
H2CO3 – слабая двухосновная кислота:
H2CO3 + H2O ⮀ HCO3– + H3O+ ; KK = 4,27 · 10–7
HCO3– + H2O ⮀ CO32– + H3O+ ; KK = 4,68 · 10–11
Соли – карбонаты и гидрокарбонаты M2CO3 и MHCO3 подвергаются гидролизу (рН > 7).
Большинство карбонатов (исключая M = Na+, K+, NH4+) малорастворимы в воде.
Но гидрокарбонаты (MHCO3) хорошо растворимы.
Слайд 26
Галогениды и оксогалогениды углерода
CX4: X = F, Cl,
Br, I (газ ? твердое),
не реагируют с водой
(хотя термодинамически эти реакции разрешены)
СCl4 + 4Na = 4NaCl + C (ВЗРЫВ)
СO + Cl2 = COCl2
Фосген – газ, сильно ядовит
COCl2 + H2O = CO2 + 2HCl
Слайд 27
Соединения С с S
CS2 – сероуглерод, tкип. =
44 оС,
легко возгорается, растворитель для P4, S8, I2,
смол, масел и т. п.
Получение:
C + 2S = CS2 (пары серы и раскаленный уголь)
Свойства:
CS2 + K2S = K2CS3 (тиокарбонат калия)
K2CS3 + 2HCl = 2KCl + H2CS3
тиоугольная к-та Ka1 = 2.10–3, Ka2 = 7.10–9
H2CS3 = H2S + CS2 (медленно при Т)
Слайд 28
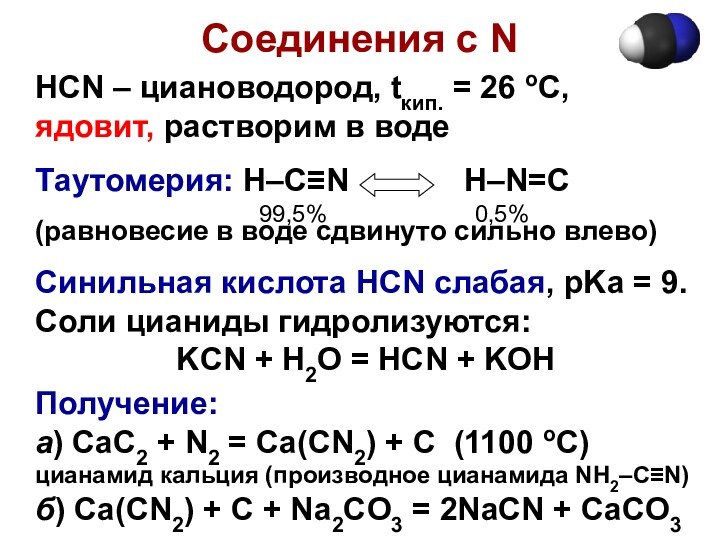
Соединения с N
HCN – циановодород, tкип. = 26
оС, ядовит, растворим в воде
Таутомерия: H–C≡N
H–N=C
(равновесие в воде сдвинуто сильно влево)
Синильная кислота HCN слабая, pKa = 9.
Соли цианиды гидролизуются:
KCN + H2O = HCN + KOH
Получение:
а) CaC2 + N2 = Ca(CN2) + C (1100 oC)
цианамид кальция (производное цианамида NH2–C≡N)
б) Ca(CN2) + C + Na2CO3 = 2NaCN + CaCO3
99,5%
0,5%
Слайд 29
Получение кремния:
SiO2 +2C = 2CO + Si (1900oC)
SiO2
+ 2Mg = 2MgO + Si (при Т)
Si +
2Cl2 = SiCl4 (при Т)
SiCl4г + 2H2г = Siтв. + 4HClг
Кремний
Получение монокристаллического Si
Метод Чохральского
99.99999999%
Слайд 30
Свойства кремния
1) Реакции с простыми веществами:
Si + O2
= SiO2 (при Т)
Si + 2Cl2 = SiCl4 (при
Т)
Si + C = SiC (2000oC) карбид кремния
2Si + N2 = 2SiN (+ Si3N4) (2000oC)
Si + 2Mg = Mg2Si (+ MgxSiy) (при Т) – силициды
2) Химическое растворение
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO↑ + 8H2O
Si + 2KOH + H2O = K2SiO3 + 2H2↑
Слайд 31
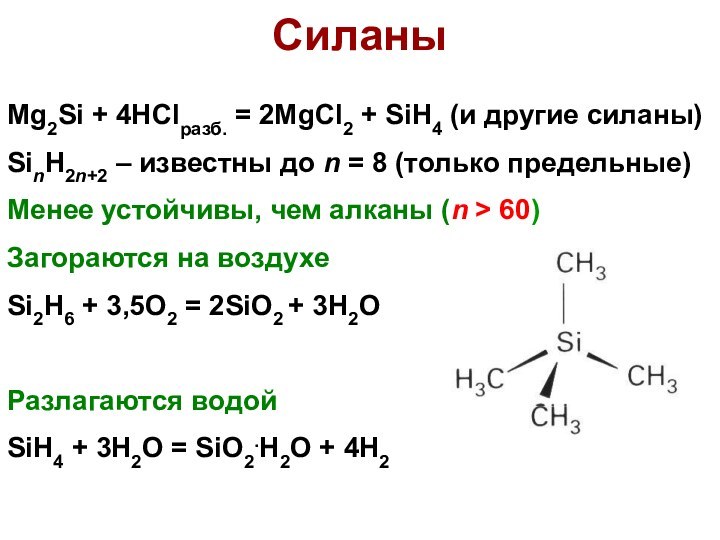
Cиланы
Mg2Si + 4HClразб. = 2MgCl2 + SiH4 (и
другие силаны)
SinH2n+2 – известны до n = 8 (только
предельные)
Менее устойчивы, чем алканы (n > 60)
Загораются на воздухе
Si2H6 + 3,5O2 = 2SiO2 + 3H2O
Разлагаются водой
SiH4 + 3H2O = SiO2.H2O + 4H2
Слайд 32
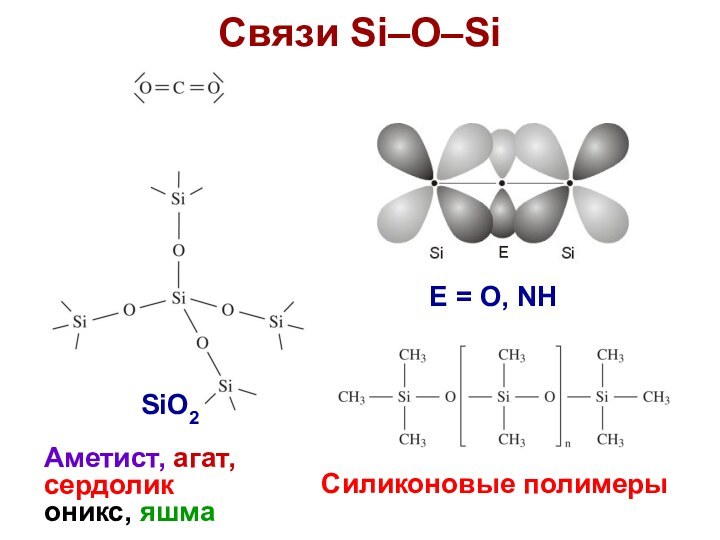
Связи Si–O–Si
SiO2
Аметист, агат,
сердолик
оникс, яшма
E = O, NH
Cиликоновые полимеры
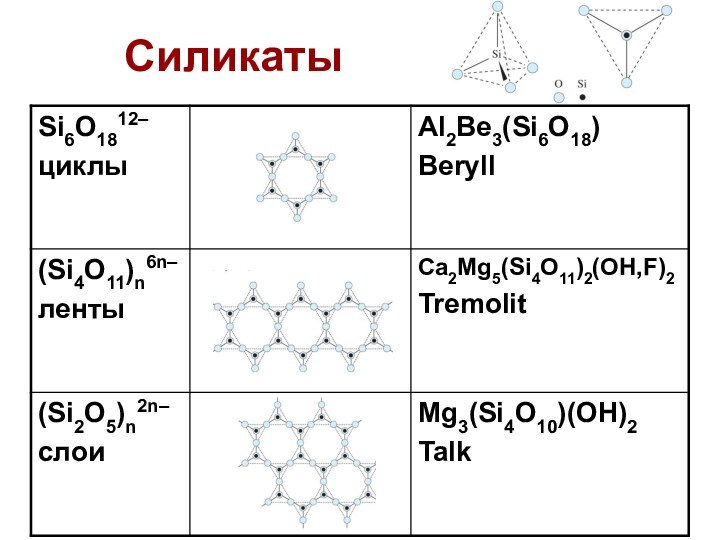
Слайд 36
SiO2
Свойства SiO2:
Н/р в воде, минеральных кислотах, растворах
щелочей
SiO2 + 6HF = H2[SiF6] + 2H2O
SiO2
+ 2NaOHтв. = Na2SiO3 + H2O (сплавление)
Слайд 37
Кремневые кислоты
Получение: действие минеральных к-т на
р-ры силикатов;
гидролиз галогенидов:
Na2SiO3 + HCl xSiO2·yH2O +
NaCl (гель)
Высушивание – силикагель (адсорбент)
Соли:
1) растворимые – K2SiO3, Na2SiO3 (жидкое стекло)
2) нерастворимые – ПРИРОДНЫЕ СИЛИКАТЫ.
Гидролиз: SiO32– + H2O = HSiO3– + OH–
–H2O
дисиликат Si2O52–
мета H2SiO3, орто H4SiO4
Слабее угольной: pKa1 = 10, pKa2 = 13
Слайд 38
Ge, Sn, Pb
Увеличение металлических свойств в ряду Ge–Sn–Pb
Простые
вещества:
Ge – структура алмаза, по свойствам похож на
Si, полупроводник.
Sn – α (серое, <13.2°C), β (белое, от 13.2 до 161°C),
γ (белое, от 161°C до tпл. = 232°C). Переход β ? α ускоряется при низкой Т («оловянная чума»).
Pb – металл, кристалл. решетка кубическая гранецентрированная.
Слайд 40
Свойства Ge, Sn, Pb
1) С кислотами неокислителями:
Ge
нет реакции.
Sn + 2HCl = SnCl2 + H2
(Pb в HClконц.)
В ЭХРН: Zn… Al… Sn… Pb H Cu…Ag Hg
2) C кислотами окислителями:
Э + HNO3 разб. = Э(NO3)2 + NO + H2O
Э = Sn, Pb
Э + 4HNO3 конц. = H2ЭO3 + 4NO2 + H2O
Э = Ge, Sn (xSnO2·yH2O β-оловянная кислота, x > y)
Э + 4H2SO4 конц. = Э(SO4)2 + 2SO2 + 4H2O
Э = Ge, Sn
Слайд 41
Pb + 3H2SO4 конц. = Pb(HSO4)2 + SO2
+ 2H2O
3) С щелочами:
Ge – нет реакции,
Sn
+ KOH + 2H2O = K[Sn(OH)3] + H2
в избытке щелочи K4[Sn(OH)6]
(Pb до K2[Pb(OH)4])
Ge, Sn, Pb
Слайд 42
ЭО2 (Э = Ge, Sn, Pb)
GeO2 + 4HClконц.
= GeCl4 + 2H2O
GeO2 + 2NaOHр-р + 2H2O =
Na2[Ge(OH)6]
GeO2 + 2NaOHрасплав = Na2GeO3 + H2O
Слайд 43
Кислоты Э4+ (Э = Ge, Sn)
xЭО2·yH2O – неопределенный
состав.
α и β-формы xЭО2·yH2O (x
β)
Растворы GeO2 в воде, очень слабая кислота: pKa = 10.
Получение оловянных кислот (α и β-формы):
Sn4+ + 4NH3 + 4H2O = Sn(OH)4↓ + 4NH4+ α
SnCl4 + 4H2O = Sn(OH)4↓ + 4HCl α
Sn + 4HNO3 конц. = H2SnO3↓ + 4NO2 + H2O β
Слайд 44
Оловянные кислоты
xSnО2.yH2O
α: x < y, растворима в
к-тах и щелочах
Sn(OH)4 + 2H2SO4 разб. = Sn(SO4)2 +
4H2O
Sn(OH)4 + 2KOHр-р = K2[Sn(OH)6]
Старение оловянных кислот:
α ? β (потеря воды)
β: x ≥ y, НЕ растворима в к-тах и щелочах
Слайд 45
Соединения Pb4+
Pb(OAc)2 + CaOCl2 + H2O = PbO2↓+
CaCl2 + 2HOAc
PbO2 + H2SO4 конц. = Pb(SO4)2 +
2H2O (Гидролиз!)
Сильный окислитель:
PbO2 + 4HCl = PbCl2 + Cl2 + 2H2O
Плюмбаты:
PbO2 тв + CaO тв = CaPbO3 (мета) – нагрев
Ca2PbO4 (орто)
В растворах [Pb(OH)6]2–
Слайд 46
Свинцовый сурик
6PbO + O2 = 2Pb3O4 (400-500 oC)
красно-оранжевый
PbII2PbIVO4
(ортоплюмбат свинца)
2Pb3O4 = 6PbO +
O2 (> 500 oC)
Pb3O4 + 4HNO3 р-р = PbO2↓ + 2Pb(NO3)2 + 2H2O
Слайд 47
Соединения Э2+ (Э = Ge, Sn, Pb)
Ox-Red свойства
Уменьшение восстановительных свойств в ряду Ge–Sn–Pb (для Э2+)
Соединения
Sn2+ – удобные мягкие восстановители
Кислотно-основные свойства
ЭО и Э(ОН)2 – амфотерные, но с преобладанием основных свойств
Для ЭО и Э(ОН)2 основные св-ва в ряду Ge–Sn–Pb увеличиваются
Слайд 48
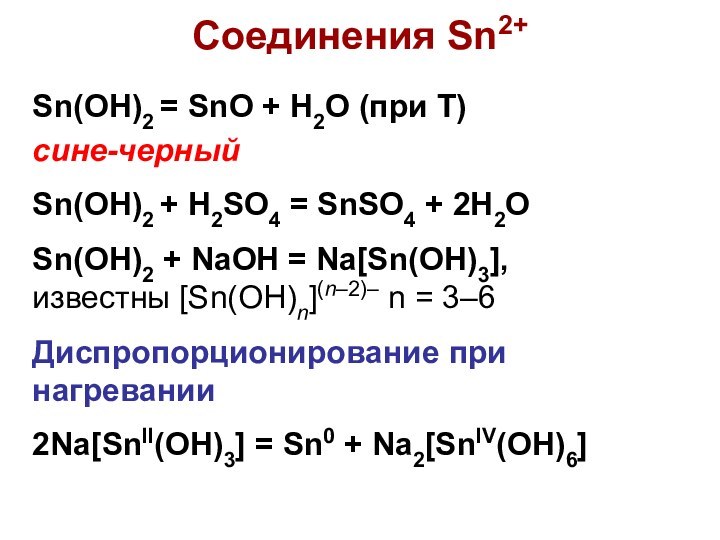
Соединения Sn2+
Sn(OH)2 = SnO + H2O (при Т)
сине-черный
Sn(OH)2 + H2SO4 = SnSO4 + 2H2O
Sn(OH)2 + NaOH
= Na[Sn(OH)3],
известны [Sn(OH)n](n–2)– n = 3–6
Диспропорционирование при нагревании
2Na[SnII(OH)3] = Sn0 + Na2[SnIV(OH)6]
Слайд 49
Растворимые соли SnX2:
X = Cl, Br, I,
NO3, ½SO4
Гидролиз:
Sn2+ + H2O = Sn(OH)+ + H+
Комплексообразование:
SnCl2 + Cl– конц. = [SnCl3]–
(пирамидальное строение, донор эл. пары:
[PtCl3(SnCl3)]2–, [PtCl2(SnCl3)2]2– и др.)
Соединения Sn2+
Слайд 50
Соединения Pb2+
PbO – желтый или красный
2Pb + O2
= 2PbO (в расплаве свинца)
PbO2 = PbO + 1/2O2
(при Т)
PbO2 (290-320 ºС) → Pb2O3 (390-420 ºС) → Pb3O4 (530-550 ºС) → РbO
PbO + 2AcOH = Pb(OAc)2 + H2O
Pb(OH)2 + 2HCl = PbCl2 + 2H2O
Pb(OH)2 + 2NaOH = Na2[Pb(OH)4]
Растворимые в воде соли:
Pb(NO3)2, Pb(OAc)2 – свинцовый сахар.
Нерастворимые в воде соли:
PbX2 (X = F, Cl, Br, I, ½SO4, ½S, ½СО3…)
Слайд 51
Примеры Ox-Red
Sn2+ – удобный мягкий восстановитель
2MnO4– +
5Sn2+ + 16H+ = 2Mn2+ +5Sn4+ + 8H2O
2MnO4– +
[Sn(OH)3]– + 3OH– = 2MnO42– + [Sn(OH)6]2–
PbO2 сильный окислитель, особенно в кислой среде
5PbO2 + 2Mn2+ +4H+ = 5Pb2+ + 2MnO4– + 2H2O
4PbO2 тв. + H2Sгаз = PbSO4 + 3PbO + H2O (воспламенение)