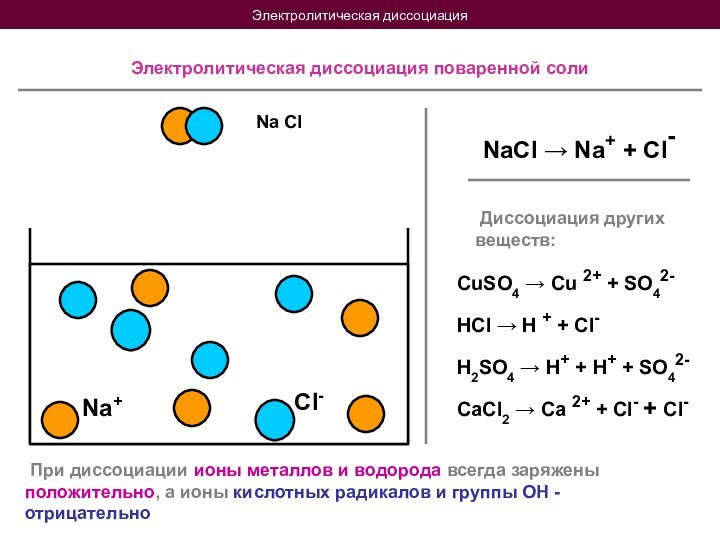
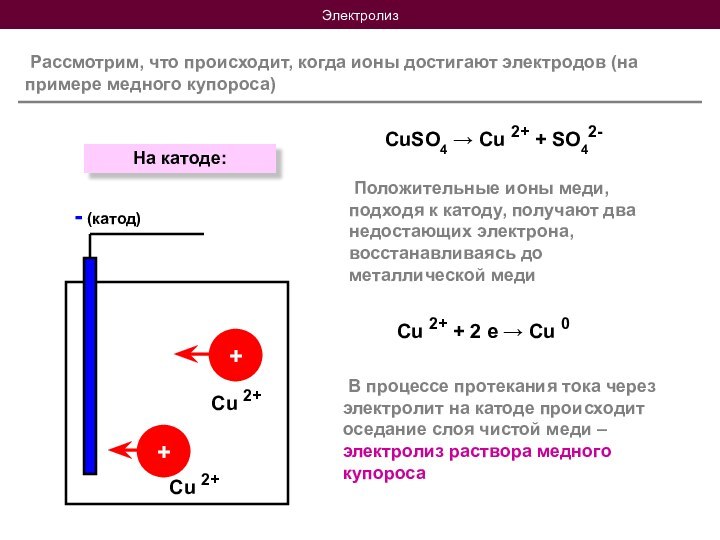
можно разделить на 2 группы:
ЖИДКОСТИ
ПРОВОДЯЩИЕ
НЕПРОВОДЯЩИЕ
Содержащие свободные заряженные частицы
(диссоциирующие) - электролиты Не содержащие свободные заряженные частицы (недиссоциирующие)
К ним относятся растворы (чаще всего водные) и расплавы солей, кислот и оснований
К ним относятся дистилированная вода, спирт, минеральное масло…
Электролитической диссоциацией называется распад нейтральных молекул вещества в растворителе на положительные и отрицательные ионы