Слайд 2
Раствор – гомогенная система, переменного химического состава, состоящая
из двух и более компонентов: растворитель и растворенное вещество
(вещества).
Классификация растворов
по агрегатному состоянию:
газовые(воздух), жидкие(морская вода),
твердые (сплавы)
по составу растворителя (водные,
аммиачные, бензольные и др.)
Слайд 3
П
По размеру частиц или по степени измельченности
(дисперстности):
Взвеси (грубодисперстные системы) - размер частиц 10-3 -10-5
см. Взвеси - очень непрочные, гетерогенные системы.
Грубодисперсные системы обычно бывают
в виде суспензий, эмульсий, аэрозолей.
Приведите примеры природных грубодисперсных систем?
Слайд 4
Коллоидные растворы - размер частиц
10-5 - 10-7
см. Примером коллоидных ДС служат растворы клея и
желатины.
Коллоидные растворы отличаются тем, что их частицы сильно рассеивают проходящий через них свет и делают заметным путь пропущенного светового луча (эффект Тиндаля).
Истинные растворы –
размер частиц 10-7 - 10-8 см, это гомогенные, устойчивые ДС.
Слайд 5
по отношению к равновесию (растворимое вещество – раствор)
(
насыщенный, ненасыщенный,
перенасыщенный)
Насыщенный раствор – находится в равновесии с твердым не растворившемся веществом, т.е. скорость растворения равна скорости его кристаллизации.
Концентрация насыщенного раствора наз. растворимостью с указанием температуры, при которой она определена.
Слайд 6
Растворимость - число моль растворенного
в-ва в одном
литре раств-ля (в состоянии насыщения)
Коэфф. растворимости - масса раств-го
компонента в 100 г. раств-ля
Ненасыщенный раствор - содержит раств-го в-ва меньше равновесного кол-ва, т.е. скорость растворения больше скорость кристаллизации.
Перенасыщенный раствор - скорость кристаллизации больше скорость растворения.
Si =
ni
V
[моль/л]
Слайд 7
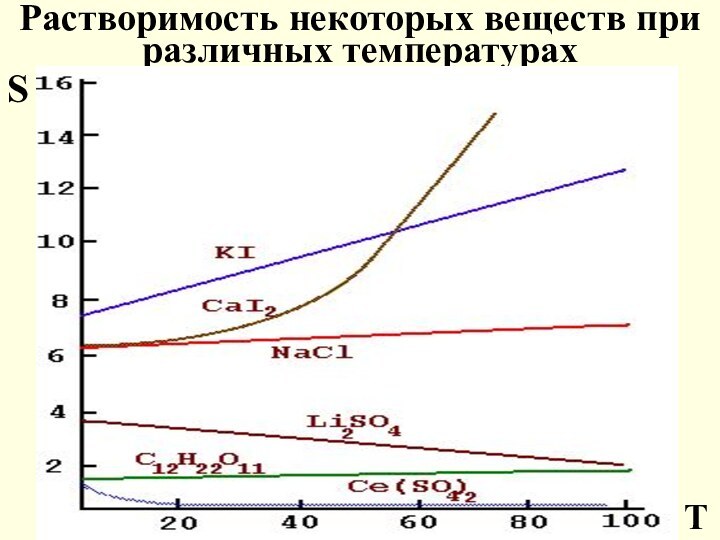
Растворимость некоторых веществ при различных температурах
S
T
Слайд 8
Способы выражения концентрации растворов
Слайд 9
Массовая доля (ω) - отношение массы раств-го в-ва
к общей массе раствора:
ω =
m2
m1 +m2
[%]
Слайд 10
2) Мольная доля (N) - отношение числа моль
раств-го в-ва к общему числу моль всех в-в,
образующих раствор:
Слайд 11
3) Моляльность(Сm) - отношение числа моль растворенного
вещества к массе растворителя:
;[моль/кг]
Слайд 12
Молярная концентрация вещества (См) – отношение числа моль
растворенного вещества к объему раствора
;[моль/л]
Слайд 13
2)Молярная конц-ция эквивалентов в-ва (Сэ) –
кол-тво (моль)
эквивалентов
растворенного вещества в 1 л раствора.
Сэ =
m1
Mэ•V
;[моль/л]
Слайд 14
3) Титр (Т) - масса (г) растворенного вещества
в 1 мл р-ра
;[г/мл ]
Слайд 15
Химическая теория растворов
Физико-химическая теория растворов разработана
Д.И. Менделеевым,
И.А. Каблуковым,
В.А. Кистяковским и др.
Основной принцип теории:
между компонентами р-ров образуются хим. соединения определенного состава - сольваты (гидраты)
Слайд 16
Между частицами внутри сольватов существует сильное взаимодействие и
часто они образуют комплексы, в которых осуществляется донорно-акцепторное взаимодействие
[Cu(H2O)6]Cl2
[Fe(H2O)6]Cl3
[Be(H2O)4]Cl2
Слайд 17
Механизм растворения
твердого вещества в жидкости состоит
в том, что молекулы растворителя образуют с поверхностными молекулами
(атомами, ионами) химические связи, при этом ослабляются связи этих молекул внутри твердого вещества
Слайд 19
В итоге образовавшийся комплекс отрывается и диффундирует в
р-р
Этот процесс обратим и с увеличением концентрации в-ва скорость
обратного процесса (кристаллизации) становится все больше, сравниваясь со скоростью растворения
Слайд 21
Влияние природы вещества на растворимость
Растворение - это химическое
взаимодействие, которое проявляется в изменении объема раствора и тепловом
эффекте
Слайд 22
Если тип межмолекулярных связей в компонентах р-ра и
между ними одинаков, то возможны любые соотношения между компонентами
р-ра
Подобное растворяется в подобном
Слайд 23
Примеры:
бесконечная растворимость спирта в воде (водородные связи)
орг. в-в в орг-ких жидкостях (ван-дер-ваальсовы силы)
ограниченная раств-сть
солей (ионная связь) в воде (водородная связь)
Слайд 24
Раств-сть полярных в-в опр-ся природой раств-ля. Большое значение
имеет его диэл-кая проницаемость (ε) : чем она больше,
тем легче диссоциация на ионы, т.к.
По этой причине многие соли лучше растворяются в воде (ε = 80), чем в спирте (ε = 25)
Слайд 25
Термодинамика растворения
При растворении происходит три процесса: 1)
перехода компонентов из индивидуального состояния в раствор (фазовый переход);
2) гидратация;
3) диффузия
Энтальпия растворения равна сумме энтальпий этих процессов:
ΔНр-ния = ΔНф.п + ΔНгидр
Слайд 26
Экзотермическое растворение - при растворении газа или жидкости
энтальпия фазового перехода меньше энтальпии гидратации и растворение сопровождается
выделением тепла.
Эндотермическое растворение – при растворении кристаллических веществ требуется значительная энергия (энергия кристаллической решетки) на их разрушение, которая больше энтальпии гидратации, и в этом случае процесс растворения сопровождается поглощением тепла.
Слайд 27
При растворении газов энтропия уменьшается.
При растворении твердых веществ
увеличивается.
Растворение жидкостей сопровождается также увеличением энтропии.
Образование раствора происходит самопроизвольно,
энергия Гиббса процесса растворения отрицательна:
ΔGр-ния = ΔНр-ния – Т·ΔSр-ния < 0
Слайд 28
Взаимное влияние на растворимость
Слайд 29
При условии ΔGр-ния< 0, раствор является ненасыщенным.
При
увеличении концентрации раствора энтропия уменьшается, и энтропийный фактор становится
равным энтальпийному. Наступает состояние равновесия, при котором ∆Gр-ния= 0. Такой раствор называется насыщенным.
При охлаждении образуются пересыщенные растворы.
Слайд 30
Растворимость газов
в жидкостях и тв. телах идет без
разрушения крист. решетки
теплота растворения определяется теплотой гидратации, которая
всегда ΔН < 0 (при нагревании растворимость ум-ся)
уменьшается объем газа при его поглощении (ΔV< 0), что соответствует ΔS < 0
это приводит к уменьшению растворимости с ув-ем температуры
Слайд 31
Закон Генри
Растворимость газа в жидкостях (и в твердых
веществах) при постоянной температуре пропорциональна его давлению:
Si = K•Pi
Для смеси газов их раств-сти пропорциональны парциальным давлениям
Слайд 33
Свойства разбавленных растворов неэлектролитов
Р-ры неэлектролитов по свойствам приближаются
к идеальным газам
Их свойства пропорциональны конц-циям компонентов, они аддитивны
(обусловлены коллективом частиц), поэтому их называют коллигативными св-вами
Слайд 34
Коллигативные свойства
давление пара раств-ля над раствором
температура кипения
температура замерзания
осмотическое
давление
Слайд 35
I закон Рауля
Обозначения:
Растворенное вещество - нелетучее
Р1
давление пара растворителя над раствором
P10 - давление пара
над чистым растворителем
N1 и N2 мольные доли растворителя и раств-го в-ва
Слайд 36
Давление пара идеального раствора при различных С (оба
летучие)
Р°А+Р°В=РР
Слайд 37
Если одно из веществ нелетучее
Для чистого растворителя:
N1
= 1 ; P1 = P10 =
K
Для р-ра : P1 = P10 . N1
т. к. N1 = 1 - N2 , то P1 = P10 (1 - N2 )
P1 - P10 = P10 N2
ΔР = P10 N2
Понижение давления насыщ.пара растворителя над раствором пропорционально мольной доле раствор-го в-ва
Слайд 38
II закон Рауля
Повышение температуры кипения и понижение температуры
замерзания р-ров пропорциональны моляльной концентрации растворенного вещества
ΔTk =
E•Cm
Е - эбулиоскопическая константа;
Сm - моляльная концентрация, моль/кг
ΔTз = K•Cm
К - криоскопическая константа
Слайд 39
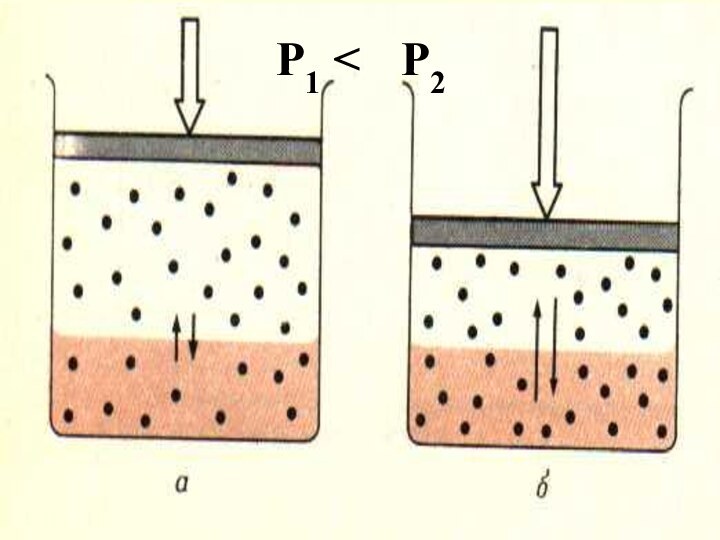
Закон Вант-Гоффа
Осмос - явление односторонней диффузии через полупроницаемую
перегородку
Осмотическое давление равно тому давлению, которое имело бы раств-ное
вещество, будучи в газообразном состоянии в объеме раствора
Слайд 40
Растворы имеющие одинаковые осмотические давления наз изотоническими.
Гипертонический раствор
– имеет большее осмотическое давление, чем раствор сравнения.
Гипотонический р-р
- имеет меньшее осмотическое давление, чем раствор сравнения.
Слайд 42
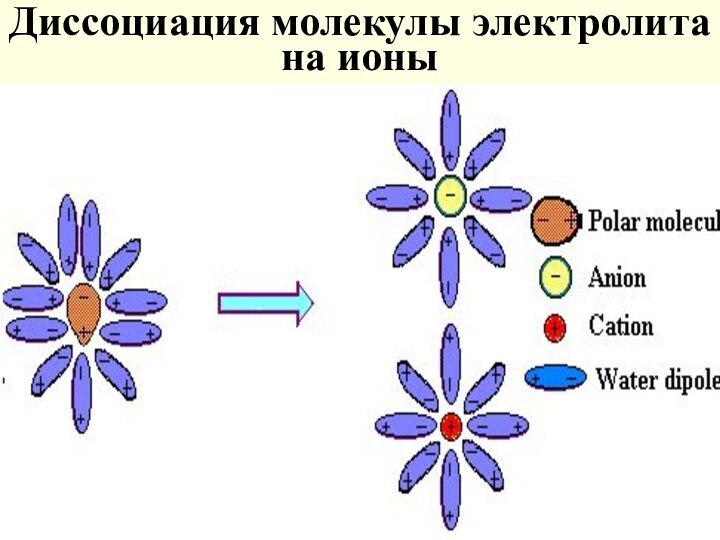
Теория электролитической диссоциации
(С. Аррениус 1887 г.)
объясняет
отклонения ряда растворов от законов Рауля и Вант-Гоффа
Эти
растворы обладали электропроводностью большей, чем чистый растворитель
Слайд 43
Основные положения:
Растворяясь, в-во диссоц-ет на ионы
Ионы в р-ре
гидратируются (сольватируются)
Сильно разб-е р-ры электролитов приближаются к идеальным
с учетом числа частиц образующихся в растворе
Слайд 44
Конц. р-ры отклоняются от свойств идеальных р-ров из-за
сильного взаимодействия противоионов, которые образуют сложные частицы, что уменьшает
их количество
Слайд 46
Диссоциация молекулы электролита на ионы
Слайд 47
Характеристики растворов электролитов
Степень диссоциации электролитов (α) -
отношение числа распавшихся молекул к общему числу растворенных и
зависит от концентрации раствора
[ доля от 1 или %]
λ∞ - электропр-ость при ∞ разбавлении
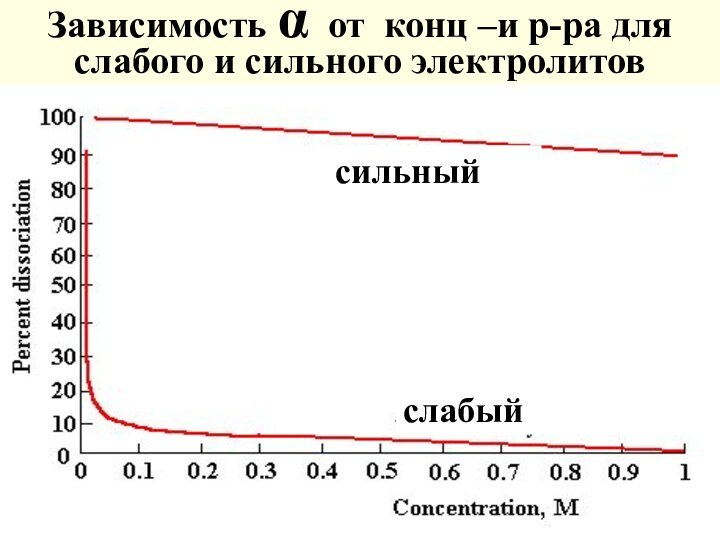
Электролиты делят на слабые (α<0,03), средние (0,03<α<0,3), сильные (α >0,3)
Слайд 48
Зависимость α от конц –и р-ра для слабого
и сильного электролитов
сильный
слабый
Слайд 49
Константа диссоциации
Это константа равновесия электрол-кой диссоциации
KnAm= nKm+ + mAn-
С СК СА
слабые
электролиты - КД<10-2
сильные электролиты - КД>10-2
Слайд 50
Для слабых электролитов (1-α) ≈ 1 и однозарядных
ионов (n = m = 1)
Закон разбавления
Оствальда
Слайд 51
Изотонический коэффициент (i)
- отношение общего числа частиц
в р-ре к числу раств-ных молекул
В р-рах электролитов
реально существующее число частиц > числа растворенных молекул
Поэтому вводится поправочный коэффициент (i), учитывающий изменение числа частиц:
i =
nреал
nобщ
Слайд 53
Кажущаяся степень диссоциации
KnAm= nKm+ + mAn-
α - кажущаяся степень диссоциации сильных электролитов (<100 %) т.к. установлено наличие ассоциатов, агрегатов из гидратированных противоионов
; α
Слайд 54
Обменные реакции в растворах электролитов
Диссоциация многоосновных кислот и
многокислотных оснований идет ступенчато
H3PO4 = H2PO4– + H+
К1 = 7,4⋅10 –3
H2PO4– = НPO42– + H+ К2 = 6,3⋅10–8
НPO42– = PO43– + H+ К3 = 4,4⋅10–13
Слайд 55
Растворимые средние соли (Na2CO3, NaCl, K2SO4 и др.)
- обычно сильные электролиты и диссоц-ют в воде нацело
Кислые
соли диссоциируют на катион металла и гидроанион:
NaHCO3 = Na+ + HCO3–
Основные соли - на гидроксокатион и анион:
MgOHCl = MgOH+ + Cl–
Слайд 56
Правило Бертолле
Равновесие в ионных реакциях смещено в сторону
образования нерастворимых соед-ний, газов и слабых электролитов
К1А1
+ К2А2 = К1А2 + К2А1
К1А1 = К1+ + А1-
Слайд 57
Правило Бертолле
а) Кр > 1 ; К11• К22
> К12 • К21
б) Кр < 1 ; К11• К22 < К12 • К21
в) Кр → ∞ реакция необратима
Слайд 58
Ионное произведение воды
Вода - слабый электролит
Н2О =
Н+ + ОН–
Ионное произведение воды:
Kд.[H2O] = 1,86.10–16.55,5 =
= [H+].[OH–] = 10–14 = Кw
Кw не зависит от конций ионов
Слайд 59
Водородный показатель
Кислотность или основность водных растворов характеризуется конц-ей
[Н+] или [ОН–] ионов
Удобнее использовать логарифмическое выражение:
рН = -lg
[H+] и pOH = -lg [OH–]
Для воды [Н+] = [ОН–] = 10–7
рН = рОН = 7 - нейтральная среда
Слайд 60
Если в растворе:
[Н+] > [ОН–], то рН
< 7,
а рОН > 7 – это кислые
растворы
[Н+] < [ОН–], то рН > 7,
а рОН < 7 – это щелочные р-ры
pН + pOH = 14
Слайд 61
Произведение растворимости
Для трудно растворимых соед-ний
Ag2СO3 (тв) ↔
2Ag+ р + CO32- р
ПРAg2CO3 – произведение растворимости
Слайд 62
Ув-ие или ум-ие одной из концентраций ионов приведет
к изменению другой
ПР связано с раств-стью (S)
Для
электролита, имеющего катион и анион равного заряда вытекает:
ПР = S2 или
Слайд 63
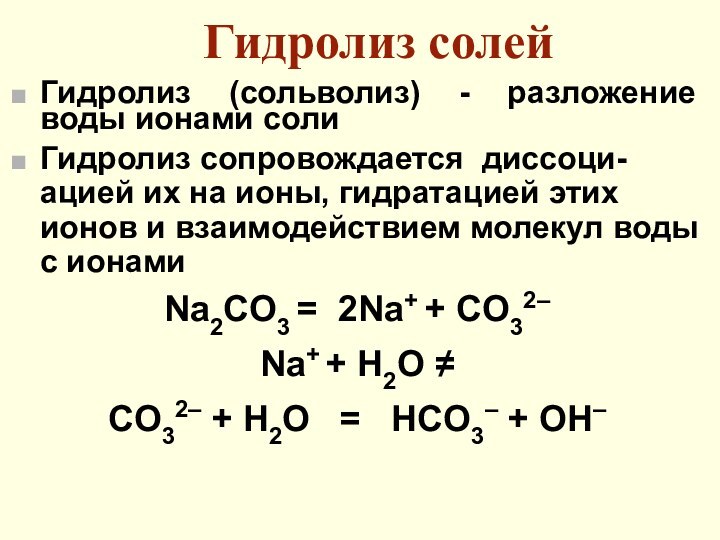
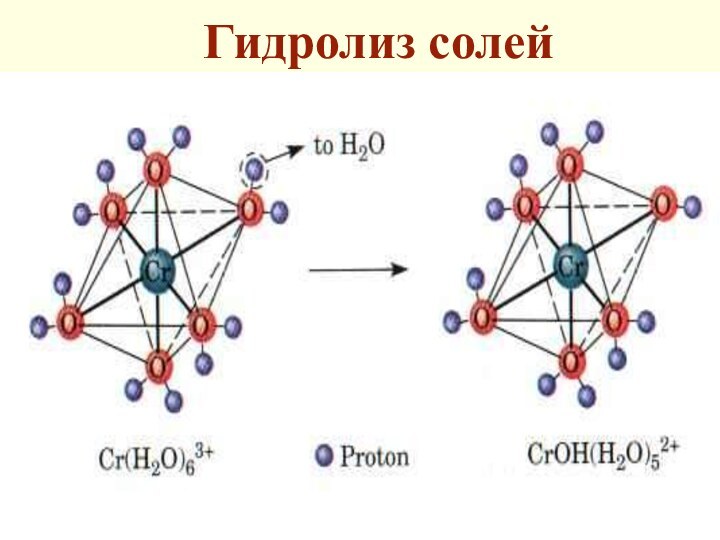
Гидролиз солей
Гидролиз (сольволиз) - разложение воды ионами соли
Гидролиз сопровождается диссоци-ацией их на ионы, гидратацией этих ионов
и взаимодействием молекул воды с ионами
Na2CO3 = 2Na+ + CO32–
Na+ + H2O ≠
CO32– + H2O = HCO3– + OH–
Слайд 65
Закономерности гидролиза
При гидролизе (сольволизе) идет разрыв ков-ной полярной
связи в молекуле раств-ля и образование новой связи с
ионом соли
Гидролиз тем легче, чем > степень ионности связи в раств-ле и < между молекулой раств-ля и ионом соли
Чем > поляризация, тем < ионность и > ковалентность и тем полнее идет гидролиз (сольволиз)
Слайд 66
Сильному гидролизу подвергаются:
— катионы с сильно поляризующей
способностью (Al3+, Fe3+, Bi3+)
— анионы с сильной
поляризуемостью (CO32–, SO32–, NO2–, CN–, S2– и др.)
Не гидролизуются:
— слабо поляризующие катионы I и II группы (Na+, Ca2+и др.)
— слабо поляризуемые анионы (Hal– , NO3–, SO42–, MnO4–, ClO4–, Cr2O72–)
Слайд 67
Сильно поляризующие катионы образуют слабые основания
сильно поляризуемые
анионы образуют слабые кислоты
Закономерности гидролиза р-ров солей:
— гидролизуются
катионы слабых оснований и анионы слабых кислот;
Al3+ + H2O = Al(OH)2+ + H+
SO32– + H2O = HSO32– + OH–
— не гидролизуются анионы сильных кислот и катионы сильных оснований
Слайд 68
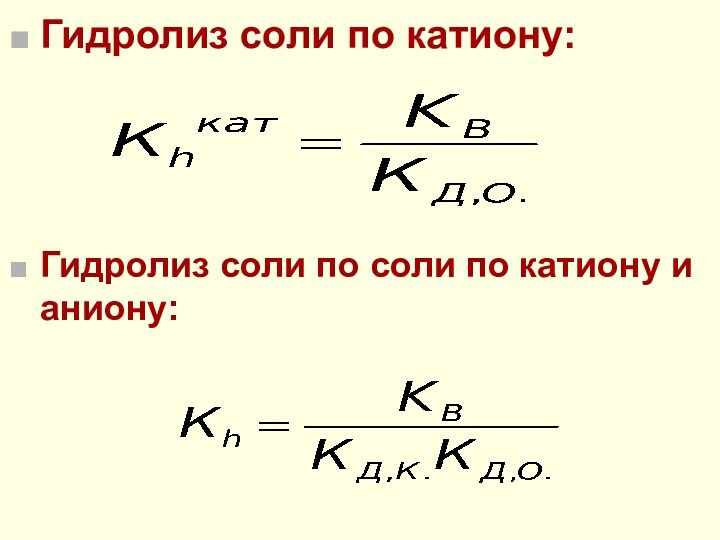
Количественные характеристики гидролиза
h - степень гидролиза (доля гидролизованных
частиц)
Кh - константа гидролиза
Пример: А– + Н2О =
НА + ОН–
h =
nгидр
nобщ









![Растворы 3) Моляльность(Сm) - отношение числа моль растворенного вещества к массе растворителя: ;[моль/кг]](/img/tmb/11/1065547/8a28de2e2e74495de1b1a796033af8a2-720x.jpg)
![Растворы Молярная концентрация вещества (См) – отношение числа моль растворенного вещества к объему раствора ;[моль/л]](/img/tmb/11/1065547/e90c0eb38ec892ec4b6cb636b5ffe4d8-720x.jpg)

![Растворы 3) Титр (Т) - масса (г) растворенного вещества в 1 мл р-ра ;[г/мл ]](/img/tmb/11/1065547/7ba956e927938e00c313e51fa421cfdc-720x.jpg)


































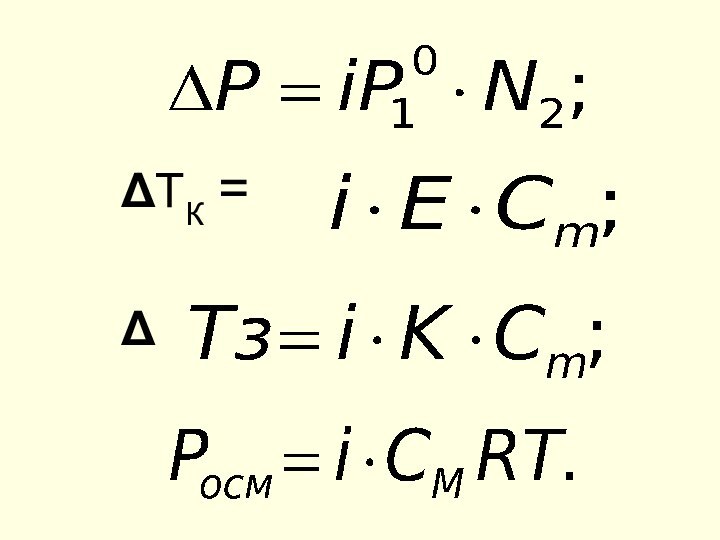






![Растворы Водородный показательКислотность или основность водных растворов характеризуется конц-ей [Н+] или [ОН–] ионовУдобнее](/img/tmb/11/1065547/6005149f18b3cba61147f76ab74c9484-720x.jpg)
![Растворы Если в растворе: [Н+] > [ОН–], то рН < 7, а рОН](/img/tmb/11/1065547/0a75cf389ade365bce92b5b488c7aaf7-720x.jpg)