- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Растворы. Свойства растворов. (Тема 3)
Содержание
- 2. Несколько индивидуальных веществ могут образовывать гетерогенные системы: а) механические смеси; б) дисперсные системы; гомогенные системы: а) растворы.
- 3. Растворы – это гомогенные системы, состоящие из
- 4. По агрегатному состоянию растворы различают : а) газообразные, б) жидкие и в) твёрдые
- 5. В растворе выделяют растворённое вещество и растворитель.
- 6. Состав раствора Наиболее часто для выражения состава раствора употребляются следующие величины: а) доля и б) концентрация.
- 7. Массовая доля растворённого вещества (ω) отношение массы
- 8. Например В 5 кГ раствора содержится 750 г
- 9. Объёмная доля растворенного вещества отношение объёма растворён-ного
- 10. Мольная доля растворенного вещества отношение числа молей
- 11. Массовая концентрация раствора (А) количество растворённого вещества в
- 12. Молярная концентрация раствора /молярность/ ( См) количество растворённого вещества в молях в 1000 мл раствора.
- 13. Например В 100 мл раствора содержится 25,2г сульфита
- 14. Моляльная концентрация раствора /моляльность/ (Сm) количество растворённого вещества в молях в 1000 г растворителя.
- 15. Например В 250 г воды растворено 50г йодида
- 16. Эквивалентная концентрация раствора /нормальность/ (Сн) количество растворённого вещества в эквивалентах в 1000 мл раствора.
- 17. Химическим эквивалентом называется такое количество вещества, которое
- 18. Формулы для вычисления эквивалентных масс сложных веществЭкислоты
- 19. Формулы для вычисления эквивалентных масс сложных веществ Эоснования
- 20. Формулы для вычисления эквивалентных масс сложных веществ
- 21. Тепловой эффект растворения (энтальпия растворения) Растворение – физико-химический
- 22. При растворении веществ в жидком растворителе происходят
- 23. 2. Процесс образования связи между молекулами (ионами)
- 24. Теплота растворения включает в себя два слагаемых:ΔНраств. = ΔНразруш.+ ΔНсольват.
- 25. Если ΔНразруш. > ΔНсольват.,
- 26. Если ΔНразруш. < ΔНсольват.,
- 27. При растворении происходит химическое взаимодействие растворённого вещества
- 28. Взаимодействие происходит за счёт сил Ван-дер-Ваальса, поэтому
- 29. Однако для большинства соединений при переходе растворенного
- 30. Например Na2SO3 – безводный, М(Na2SO3) = 126г/мол;
- 31. Свойства растворов
- 32. Давление насыщенного пара над раствором
- 33. Переход молекул вещества из жидкости в газообразное
- 34. Если жидкость находится в замкнутом сосуде, то
- 35. Давление, которое оказывает пар, находящийся в равновесии
- 36. Давление насыщенного пара зависит от природы жидкости и температуры и не зависит от количества жидкости.
- 37. Поверхность раствора вещества менее летучего, чем растворитель,
- 38. Поэтому число молекул растворителя, испаряющихся за единицу
- 39. Следовательно, при одной и той же температуре
- 40. Количественно эта зависимость выражается законом Р. Рауля:
- 41. (Р0 – Р) / Р0 = N
- 42. Идеальный раствор – раствор, в котором межмолекулярные
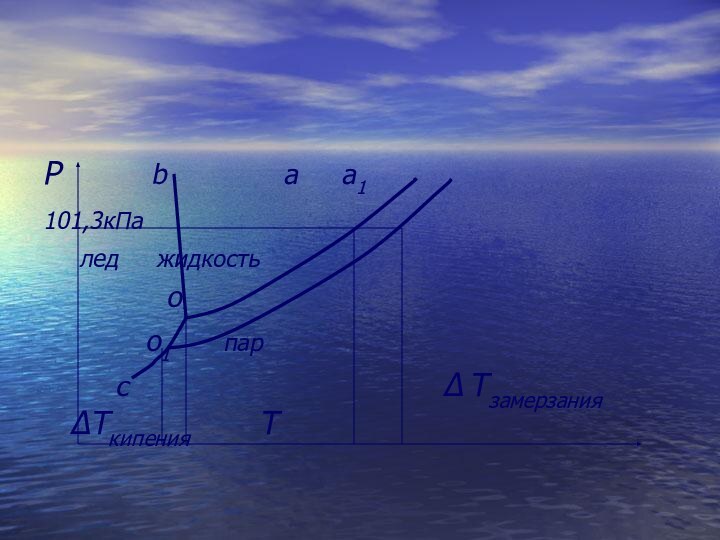
- 43. Температура кипения и температура замерзания раствора
- 44. По мере повышения температуры жидкости в открытом
- 45. Кипение - это процесс испарения жидкости в объеме жидкости
- 46. Температура, при которой давление насыщенного пара жидкости становится равным внешнему давлению, называется температурой кипения жидкости
- 47. Над твёрдыми телами также есть пар, который
- 48. Согласно закону Р. Рауля давление насыщенного пара
- 49. Р b а
- 50. Следовательно, при одном и том же внешнем
- 51. Количественно эта зависимость установлена Р Раулем: «Повышение
- 52. ΔТкип. = Е · Сm ,
- 53. Эбулиоскопическая постоянная показывает повышение темпера-туры кипения, а
- 54. Неэлектролиты и электролиты
- 55. Свойства растворов относятся к коллигативным свойствам, т.е.
- 56. Например При растворении 0,1 моля хлорида натрия в
- 57. Ван-Гофф ввел в уравнение Р.Рауля поправочный коэффи-циент,
- 58. Растворы, в которых не происходит диссоциация растворенного
- 59. Растворы, в которых растворен-ное вещество распадается на ионы, называются растворами электро-литов. Растворы электролитов являются ионными проводниками.
- 60. Теория электролитической диссоциации Аррениуса 1.При растворении
- 61. Согласно современной теории растворов диссоциация происходит в
- 62. Хорошо диссоциируют вещества с ионной и ковалентной
- 63. На диссоциацию электролитов в значительной степени
- 64. Диссоциация кислот: НСl =
- 65. Диссоциация оснований: NaOH =
- 66. Диссоциация солей: NaCl
- 67. Сильные и слабые электролиты
- 68. Изучение коллигативных свойств растворов электролитов показало, что
- 69. Долю молекул, распавшихся на ионы, характеризуют степенью
- 70. Например КА ⇔ К+ + А- α =
- 71. Электролиты, для которых при эквивалентной концентрации растворов
- 72. К сильным электролитам относятся: соли растворимые в воде; основания
- 73. Электролиты, для которых при эквивалентной концентрации растворов
- 74. К слабым электролитам относятся: соли не растворимые в
- 75. Слабые электролиты имеют различную степень диссоциации, которая зависит от концентрации электролита и температуры раствора.
- 76. Чтобы исключить влияние концентрации электролита для характеристики диссоциации, используют константу диссоци-ации.
- 77. Так как диссоциация является обратимым процессом КА
- 78. Константа равновесия в этом случае характеризует электроли-тическую
- 79. Например Для одной и той же температуры KД
- 80. Электролитическая диссоциация воды. Водородный показатель. Нейтральная, кислая и основная среды
- 81. Вода является очень слабым электролитом. Электролитическая диссоциация воды выражается следующим уравнением:Н2О Н+ + ОН-
- 82. Это обратимый процесс. Константа диссоциации воды запишется:KД
- 83. Это уравнение показывает, что при постоянной температуре
- 84. Растворы, в которых [Н+] = 10-7
- 85. Растворы, в которых [Н+] > 10-7 мол/л
- 86. Растворы, в которых [Н+] < 10-7 мол/л
- 87. Скачать презентацию
- 88. Похожие презентации
Несколько индивидуальных веществ могут образовывать гетерогенные системы: а) механические смеси; б) дисперсные системы; гомогенные системы: а) растворы.
















































































![Растворы. Свойства растворов. (Тема 3) Это обратимый процесс. Константа диссоциации воды запишется:KД = [Н+] ∙ [ОН-] /](/img/tmb/15/1469805/195ce45f1affbc0c2ac0ac5fac43bbc8-720x.jpg)

![Растворы. Свойства растворов. (Тема 3) Растворы, в которых [Н+] = 10-7 мол/л – нейтральные растворы. В](/img/tmb/15/1469805/981f17ae22db857fc70121180d43cdd0-720x.jpg)
![Растворы. Свойства растворов. (Тема 3) Растворы, в которых [Н+] > 10-7 мол/л – кислые растворы. В кислых](/img/tmb/15/1469805/b4476ee717d741e92492332c43265690-720x.jpg)
![Растворы. Свойства растворов. (Тема 3) Растворы, в которых [Н+] < 10-7 мол/л – щелочные растворы. В щелочных](/img/tmb/15/1469805/504449c36ecf02ecb4afc44d0bad644a-720x.jpg)
![Растворы. Свойства растворов. (Тема 3) Для характеристики среды пользуются не значением концентрации ионов водорода [Н+], а величиной](/img/tmb/15/1469805/6aa5e013fd5d7126c3927f8195046e3a-720x.jpg)
Слайд 2
Несколько индивидуальных веществ могут образовывать
гетерогенные системы:
а)
механические смеси;
Слайд 3
Растворы – это гомогенные системы, состоящие из двух
или более веществ, относительные количества которых могут изменяться в
широких пределах и между которыми возможно химическое взаимодействие.
Слайд 5
В растворе выделяют растворённое вещество и растворитель.
Растворителем
называют то вещество, которое в чистом виде существует в
таком же агрегатном состоянии, что и раствор.Если оба вещества до растворения находились в одном и том же агрегатном состоянии, то растворителем считается вещество, находящееся в большем количестве.
Слайд 6
Состав раствора
Наиболее часто для выражения состава раствора
употребляются следующие величины:
а) доля и
б) концентрация.
Слайд 7
Массовая доля растворённого вещества (ω)
отношение массы растворённого
вещества к общей массе раствора.
mрастворенного вещества ∙ 100
ω =
--------------------------------;% масс mраствора
Слайд 8
Например
В 5 кГ раствора содержится 750 г хлорида
калия. Рассчитать массовую долю растворенного вещества.
Решение
750 ∙ 100
ω =
-------------- = 15% масс 5000 Ответ Массовая доля хлорида калия в растворе составляет 15% масс
Слайд 9
Объёмная доля растворенного вещества
отношение объёма растворён-ного вещества
к сумме объемов растворённого вещества и растворителя до приготовления
раствора.Vрастворенного вещества ∙ 100
ω = --------------------------------; %об. Vр.в. + V растворителя
Слайд 10
Мольная доля растворенного вещества
отношение числа молей растворённого
вещества к общему числу молей всех веществ, образующих раствор.
N
= n р.в. / nр.в.+ nрастворителя
Слайд 11
Массовая концентрация раствора (А)
количество растворённого вещества в 1000
мл раствора. Обычно пользуются единицей г/л.
Растворимость нитрата свинца в
воде при температуре 18оС равна 517г/л
Слайд 12
Молярная концентрация раствора /молярность/ ( См)
количество растворённого
вещества в молях в 1000 мл раствора.
Слайд 13
Например
В 100 мл раствора содержится 25,2г сульфита натрия.
Рассчитать молярную концентрацию раствора.
Решение.
Рассчитаем молярную массу сульфита натрия
(Na2SO3)М = (2∙23 + 32 3∙16) =126г/моль
Определим количество сульфита натрия, содержащегося в 1000 мл раствора
m =25,2 ∙1000 /100 =252г
Рассчитаем количество молей сульфита натрия, содержащихся в 1000мл раствора (молярную концентрацию)
n = m / М = 252 / 126 = 2 моля
Ответ: Молярная концентрация раствора равна 2 мол/л
Слайд 14
Моляльная концентрация раствора /моляльность/ (Сm)
количество растворённого вещества
в молях в 1000 г растворителя.
Слайд 15
Например
В 250 г воды растворено 50г йодида натрия.
Рассчитать моляльную концентрацию раствора.
Решение.
Рассчитаем молярную массу йодида натрия (NaJ)
М = ( 23 + 127 ) =150г/моль
Определим количество йодида натрия, содержащегося в 1000 г воды
m =50 ∙1000 /250 =200г
Рассчитаем количество молей йодида натрия, содержащихся в 1000г воды (моляльную концентрацию)
n = m / М = 200/ 150= 1,3 моля
Ответ: Моляльная концентрация раствора равна 1,3мол/кГ воды
Слайд 16
Эквивалентная концентрация раствора /нормальность/ (Сн)
количество растворённого вещества
в эквивалентах в 1000 мл раствора.
Слайд 17
Химическим эквивалентом называется такое количество вещества, которое соединяется
с 1 молем атомов водорода или замещает то же
количество атомов водорода в химических соединениях.Эквивалентной массой называется масса 1 эквивалента вещества.
Слайд 18
Формулы для вычисления эквивалентных масс сложных веществ
Экислоты =
Мкислоты / основность кислоты
Например
Серная кислота H2SO4
Мкислоты = (1 ∙
2 + 32 + 4 ∙ 16) = 98 г/мольЭкислоты = 98 / 2 = 49г/моль
Слайд 19
Формулы для вычисления эквивалентных масс сложных веществ
Эоснования =
Моснования / кислотность основания
Например
Гидроксид бария Ba(OH)2
Моснования = (137+2 ∙
16+2 ∙ 1) = 171г/мольЭоснования = 171 / 2 = 85,5 г/моль
Слайд 20
Формулы для вычисления эквивалентных масс сложных веществ
М соли
Э СОЛИ = ------------------------------------
Число
атомов металла ∙ Валентность металлаНапример
Сульфат алюминия Al2(SO4)3
Г- М соли = (2 ∙27+ 3 ∙32 +12 ∙16) = 342г
Э СОЛИ = 342 / 2 ∙ 3 = 57 г/моль
Слайд 21
Тепловой эффект растворения (энтальпия растворения)
Растворение – физико-химический процесс.
Процессы растворения сопровожда-ются выделением или поглощением тепла.
Тепловой эффект
растворения, отнесённый к одному молю растворенного вещества, называется теплотой растворения. Размерность кДж/моль.
Слайд 22 При растворении веществ в жидком растворителе происходят два
процесса:
1.Процесс разрушения химичес-ких и межмолекулярных связей в растворённом веществе,
требую-щий затраты энергии эндотермический процесс, ∆Нразруш.> 0
Слайд 23
2. Процесс образования связи между молекулами (ионами) растворённого
вещества и молекулами растворителя (процесс называется сольватация), сопровождающийся выделением
энергииэкзотермический процесс, ∆Нсольват.< 0)
Слайд 25
Если ΔНразруш. > ΔНсольват.,
ΔНраств.
> 0,
т.е. при растворении наблюдается эндотермический тепловой эффект
(раствор охлаждается). Это происходит при растворении твердых веществ.
При растворении кристаллов NH4Cl в воде раствор охлаждается.
Слайд 26
Если ΔНразруш. < ΔНсольват.,
ΔНраств.
< 0,
т.е. при растворении наблюдается экзотермический тепловой эффект
(раствор нагревается).Это происходит при растворении газообразных и жидких веществ.
При растворении H2SO4 в воде раствор сильно нагревается.
Слайд 27
При растворении происходит химическое взаимодействие растворённого вещества и
растворителя.
Образующиеся при этом соединения называются сольватами, а в
случае водных растворов – гидратами.
Слайд 28
Взаимодействие происходит за счёт сил Ван-дер-Ваальса, поэтому сольваты
(гидраты) – соединения менее прочные, чем обычные химические соединения.
Слайд 29
Однако для большинства соединений при переходе растворенного вещества
из раствора в твёрдую фазу (процесс кристаллизации) вместе с
растворенным веществом переходят в твердую фазу и молекулы воды. Эту воду называют кристаллизационной водой, а сами соединения -кристаллогидратами.
Слайд 30
Например
Na2SO3 – безводный,
М(Na2SO3) = 126г/мол;
Na2SO3
· 7H2O – кристаллический. М(Na2SO3·7H2O) =252г/мол.
Отсюда следует, что
100г кристаллического сульфита натрия содержат только 50г сульфита натрия.
Слайд 33
Переход молекул вещества из жидкости в газообразное состояние
называется испарением. Обратный переход из газо-образного состояния в жидкость
называется конденсацией. Испарение твердых тел называют сублимацией.
Слайд 34
Если жидкость находится в замкнутом сосуде, то достигается
равновесие, когда скорость испарения жидкости равна скорости конденсации пара.
Это динамическое равновесие.
Пар, находящийся в динами-ческом равновесии со своей жидкостью, называется насыщенным паром.
Слайд 35
Давление, которое оказывает пар, находящийся в равновесии с
жидкостью, называют давлением насыщенного пара этой жидкости. Это максимальное
давление пара, которое развивается жидкостью при данной температуре.
Слайд 36
Давление насыщенного пара зависит от природы жидкости и
температуры и не зависит от количества жидкости.
Слайд 37
Поверхность раствора вещества менее летучего, чем растворитель, в
отличие от поверхности растворителя частично занята молекулами растворённого нелетучего
вещества.Раствор Растворитель
Слайд 38
Поэтому число молекул растворителя, испаряющихся за единицу времени
с единицы поверхности раствора меньше, чем с единицы поверхности
раство-рителя.
Слайд 39
Следовательно, при одной и той же температуре давление
насыщенного пара над раствором всегда будет ниже давления насыщенного
пара над растворителем.
Слайд 40
Количественно эта зависимость выражается законом Р. Рауля:
«В
идеальных растворах при постоянной температуре величина относительного понижения давления
насыщенного пара растворителя над раствором равна молярной доле растворенного нелетучего вещества».
Слайд 41
(Р0 – Р) / Р0 = N ,
где Р0 - давление насыщенного пара растворителя,
Р -
давление насыщенного пара растворителя над раствором,N - мольная доля растворенного вещества.
Слайд 42
Идеальный раствор – раствор, в котором межмолекулярные силы
равны. Если растворенное вещество А и растворитель В образуют
идеальный раствор, то силы между молекулами А…А, В…В и А…В равны.На практике – это очень разбавленные растворы неэлектролитов
Слайд 44
По мере повышения температуры жидкости в открытом сосуде
давление насыщенного пара над ней растёт до тех пор,
пока не сравняется с внешним давлением - жидкость закипает
Слайд 46
Температура, при которой давление насыщенного пара жидкости становится
равным внешнему давлению, называется температурой кипения жидкости
Слайд 47
Над твёрдыми телами также есть пар, который определяет
давление насыщенного пара твердых веществ.
Температура замерзания (кристаллизации) жидкости
– это температура, при которой давление насыщенного пара жидкости равно давлению насыщенного пара над твердым веществом.
Слайд 48
Согласно закону Р. Рауля давление насыщенного пара над
раствором нелетучего вещества ниже давления пара над чистым растворителем.
Следовательно
раствор необходимо нагреть до более высокой температуры, чтобы достичь внешнего давления и охладить до более низкой температуры, чтобы достичь давления насыщенного пара над кристаллом (см. рис.).
Слайд 50
Следовательно, при одном и том же внешнем давлении
температура
кипения раствора выше температуры кипения чистого растворителя, а температура
замерзания раствора ниже температуры замерзания чистого растворителя
Слайд 51
Количественно эта зависимость установлена Р Раулем:
«Повышение температуры
кипения или понижение темпера-туры замерзания идеального раствора не зависит
от природы растворенного вещества и прямо пропорционально моляльной концентрации растворённого вещества»
Слайд 52
ΔТкип. = Е · Сm ,
ΔТзам.
= К · Сm ,
где Сm –
моляльная концентрация раствора, мол/Кг,Е – эбуллиоскопическая постоянная, град/мол,
К – криоскопическая постоянная, град/мол.
Слайд 53
Эбулиоскопическая постоянная показывает повышение темпера-туры кипения, а криоскопическая
постоянная понижение темпера-туры замерзания раствора, в котором в 1
кГ растворителя содержится один моль растворен-ного вещества.Для воды Е = 0,52 град/мол,
К = 1,86 град/мол.
Слайд 55
Свойства растворов относятся к коллигативным свойствам, т.е. к
таким свойствам, которые зависят от концентрации частиц в растворе.
Изучение свойств растворов различных веществ показало, что наблюдаются отклонения от закона Р. Рауля.
Слайд 56
Например
При растворении 0,1 моля хлорида натрия в 1000
г воды понижение температуры замерза-ния раствора составило не 0,186ОС,
а 0,318оС, т.е. примерно в 2 раза больше теории.
Слайд 57
Ван-Гофф ввел в уравнение Р.Рауля поправочный коэффи-циент, который
назвал изотони-ческим коэффициентом – отношение наблюдаемого значе-ния к расчетному
значению ( I )
Слайд 58
Растворы, в которых не происходит диссоциация растворенного вещества
на ионы, называются растворами неэлектролитов.
Система характеризуется отсутствием ионов
в растворе и не обладает ионной проводимостью.
Слайд 59
Растворы, в которых растворен-ное вещество распадается на ионы,
называются растворами электро-литов.
Растворы электролитов являются ионными проводниками.
Слайд 60
Теория электролитической диссоциации Аррениуса
1.При растворении электролитов происходит
диссоциация (распад) их молекул на заряженные частицы – ионы.
2.При
диссоциации устанавливается термодинамическое равновесие между образовавшимися ионами и молекулами.3.Величина заряда иона совпадает с валентностью атома элемента или кислотного остатка, а число положительных зарядов равно числу отрицательных зарядов.
4.В целом раствор нейтрален. Растворы электролитов проводят электрический ток. Они являются проводниками « второго рода».
Слайд 61
Согласно современной теории растворов диссоциация происходит в результате
взаимодействия структурных частиц растворённого вещества (молекул, ионов) с молекулами
растворителя.
Слайд 62
Хорошо диссоциируют вещества с ионной и ковалентной полярной
связью. Неполярные и мало-полярные вещества не диссоциируют или диссоциируют
очень мало.
Слайд 63
На диссоциацию электролитов в значительной степени влияет
полярность растворителя.
Чем выше полярность растворителя, тем выше степень
диссоциации электролита.
Слайд 64
Диссоциация кислот:
НСl = H+
+ Cl-
H2SO4 = 2H+ + SO42-
CH3COOH ⇔ H+ +
CH3COO-С точки зрения электролитической диссоциации, кислотами называются электролиты, образующие при диссоциации в водных растворах ионы водорода (Н+).
Слайд 65
Диссоциация оснований:
NaOH = Na+
+ OH-
Ba(OH)2 = Ba2+ + 2OH-
NH4OH ⇔ NH4+ +
OH-С точки зрения электролитической диссоциации, основаниями называются электролиты, которые при диссоциации в водном растворе образуют гидроксид-ионы (ОН-).
Слайд 66
Диссоциация солей:
NaCl =
Na+ + Cl-
NiSO4 = Ni2+ + SO42-
K3PO4 = 3K+
+ PO43-С точки зрения электролитической диссоциации, солями называются электролиты, которые при диссоциации в водном растворе образуют ионы металлических элементов /катионы/ (за исключением NH4+) и ионы кислотного остатка /анионы/.
Слайд 68
Изучение коллигативных свойств растворов электролитов показало, что в
растворах присутствуют наряду с ионами и молекулы, так как
диссоциация происходит не полностью, т.еКА <=> К+ + А-
Слайд 69
Долю молекул, распавшихся на ионы, характеризуют степенью диссоциации
(α).
Степень диссоциации – отношение числа распавшихся на ионы
молекул (n) к общему числу растворённых молекул (N):α = n / N.
Слайд 70
Например
КА ⇔ К+ + А-
α = 20
%. Это значит, что из 100 молекул электролита 20
молекул распалось на ионы и в растворе присутствует 40 ионов, а также 80 нераспавшихся молекул. Всего в растворе будет присутствовать 120 частиц.Изотонический коэффициент равен 1,2
Слайд 71
Электролиты, для которых при эквивалентной концентрации растворов Cн
= 0,01-0,1мол/л, степень диссоциации (α) больше 50% относят к
сильным.Принято, что сильные электролиты при растворении в воде полностью диссоциируют на ионы (в растворе присутствуют только в виде ионов).
Слайд 72
К сильным электролитам относятся:
соли растворимые в воде;
основания элементов
I и II групп главных подгрупп Периодической системы
элементов Д.Менделеева;кислоты Н2SO4 , HNO3 , HCl, HBr, HJ, HMnO4 , HClO4 , HCl03 и др.
Слайд 73
Электролиты, для которых при эквивалентной концентрации растворов Cн
= 0,01-0,1мол/л, степень диссоциации (α) меньше 50 % относят
к слабым.Принято, что слабые электролиты при растворении в воде лишь частично диссоциируют на ионы (в растворе присутствуют в основном в молекулярном виде).
Слайд 74
К слабым электролитам относятся:
соли не растворимые в воде;
основания
не растворимые в воде, за исключением NH4OH, а также
элементов I и II групп главных подгрупп;кислоты органические (СН3 СООН), H2S, H2SO3 , H2CO3 , H2SiO3 , H3BO3 , H3PO4
к слабым электролитам относится вода
Слайд 75
Слабые электролиты имеют различную степень диссоциации, которая зависит
от концентрации электролита и температуры раствора.
Слайд 76
Чтобы исключить влияние концентрации электролита для характеристики диссоциации,
используют константу диссоци-ации.
Слайд 77
Так как диссоциация является обратимым процессом КА К+
+ А-, то по закону действующих масс:
Vпр = кпр
∙ [KA] ; Vоб = коб ∙ [K+] ∙ [A-] .В состоянии равновесия
Vпр = Vоб ; кпр ∙ [KA] = коб ∙ [K+] ∙ [A-] ,
отсюда KД = кпр / к об
KД = [K+] ∙ [A-] / [KA]
Слайд 78
Константа равновесия в этом случае характеризует электроли-тическую диссоциацию
электроли-та и называется константой диссоциации / KД /.
KД
зависит от температуры и не зависит от концентрации раствора. По величине KД можно судить о силе электролита.
Слайд 79
Например
Для одной и той же температуры
KД (NH4OH)
= 1,79∙10-5;
KД (СН3СООН) = 1,75∙10-5;
KД (HСN) =
4,79∙10-10. Самым слабым электролитом является HСN, имеющая наименьшее значение константы диссоциации
Слайд 80
Электролитическая диссоциация воды.
Водородный показатель.
Нейтральная, кислая и
основная среды
Слайд 81
Вода является очень слабым электролитом.
Электролитическая диссоциация воды
выражается следующим уравнением:
Н2О Н+ + ОН-
Слайд 82
Это обратимый процесс.
Константа диссоциации воды запишется:
KД =
[Н+] ∙ [ОН-] / [Н2О],
умножим левую и правую части
выражения на [H2O],тогда Кд∙[H2O] = [Н+]∙[ОН-],
где Кд∙[H2O] называется ионным произведением воды – это практи-чески постоянная величина.
Слайд 83
Это уравнение показывает, что при постоянной температуре произведение
концентрации ионов водорода и гидроксид-ионов есть величина постоянная.
При 220С
[Н+]∙[ОН-] = 10-14 мол/л. В воде [Н+] = [ОН-] = 10-7 мол/л.
Слайд 84
Растворы, в которых [Н+] = 10-7 мол/л
– нейтральные растворы.
В нейтральных растворах присутствуют ионы H+
и OH- в равных количествах. Концентрации ионов равны 10-7 мол/л.