Урок разработан ведущим учителем химии и биологии МОУ «Староибрайкинской средней школы» Аксубаевского района РТ Нафигуллиной М.М.
Тема: Методика изучения трудноусваимовых учащимся тем из курса химии.»Гидролиз»
Тип урока: Урок совершенствование знаний, умений и навыков.
Слайд 3
Цель урока: Развивать у
школьников логическое мышление, глубже изучать учебный материал по данной
теме, углублять и закреплять знания, полученные при изучении других разделов школьного курса химии, а также из вузовской программы, основываясь на реальных примерах из области гидролиза солей, проанализировать общие принципы решения и оформления гидролитических задач, готовить учащихся к вступительным экзаменам в вузы (к ЕГЭ).
Слайд 4
Методы урока: Фронтальный опрос, работа
у доски (письменно), работа у мультимидейного экрана (устно), самостоятельная
работа при составлении синквейна, групповая работа, работа в парах.
Средства обучения: Таблицы элементов Д.И.Менделеева, таблицы растворимости солей, кислот, оснований в воде, таблица по среде (индикаторов),таблица электролитов и неэлектролитов, карточки с дифференцированными заданиями из ЕГЭ в компьютере, индикаторы и соли для практической работы, презентация на тему «Гидролиз» составленная самостоятельно учениками.
Слайд 5
Ход урока:
В начале урока перед решением задач надо
вспомнить законы и закономерности гидролиза.
Сильные электролиты: а)Почти
все соли б)H₂SO₄, HNO₃, HCI, HBr, HJ, HMnO₄, HCIO₃,HCIO₄ в)Основания щелочных и щелочноземельных металлов.
Слабые электролиты: а)Все органические кислоты(НСООН,СН₃СООН) б)H₃PO₄,H₂CO₃,H₂SO₃, H₂S, HNO₂,HCIO,H₂SiO₃. в)Основания металлов:Mg(OH)₂,Be(OH)₂,NH₄OH. г)Н₂О.
Неэлектролиты: Оксиды, гидроксиды, сахар, спирты.
Слайд 6
Синквейн
Это стихотворение, которое требует изложение большого объема информации
в кратких выражениях, что позволяет описывать и рефлексировать по
определенному поводу.
Слово синквейн происходит от французского, означающего пять. Значит синквейн стихотворение, состоящее из пяти строк.
1-я строка – название синквейна.
2-я строка – два
прилагательных.
3-я строка – три глагола.
4-я строка – фраза на тему синквейна.
5-я строка – существительное.
Слайд 8
Синквейн №1
Гидролиз.
Ионная, обратимая.
Гидролизуется, протекает, сообщает.
Идет между солью и
водой.
Обмен.
Слайд 9
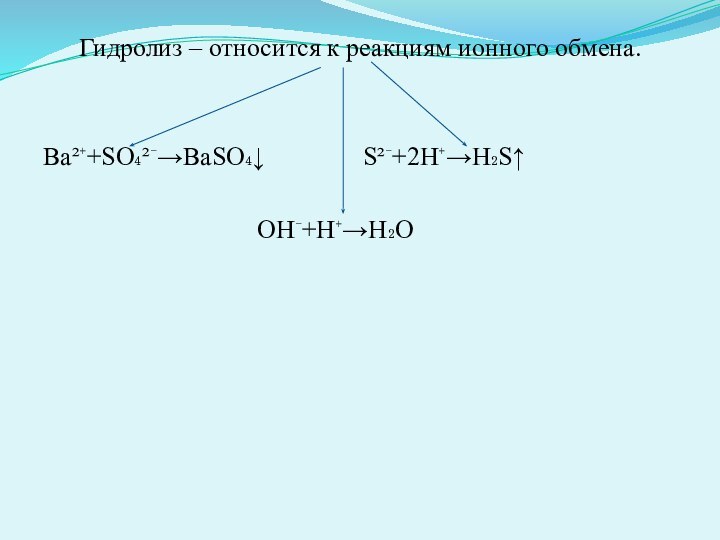
Гидролиз – относится к реакциям ионного обмена.
Ва²⁺+SO₄²⁻→BaSO₄↓
S²⁻+2H⁺→H₂S↑
OH⁻+H⁺→H₂O
Слайд 10
Если реакции протекают в растворе, то уравнения следует
записывать в ионном виде, даже если в них участвуют
неэлектролиты.
1.Оксиды с кислотами: СаО+2НСI→СаСI₂+Н₂О
СаО+2Н⁺→Са²⁺+Н₂О
2.Оксиды с щелочами: SO₃+2NaOH→Na₂SO₄+H₂O
SO₃+2OH⁻→SO₄²⁻+H₂O
3.Металлы с кислотами:Zn⁰+2HI→Zn²⁺CI₂+H₂⁰↑
Zn⁰+2H⁺→Zn²⁺+H₂⁰↑
Слайд 11
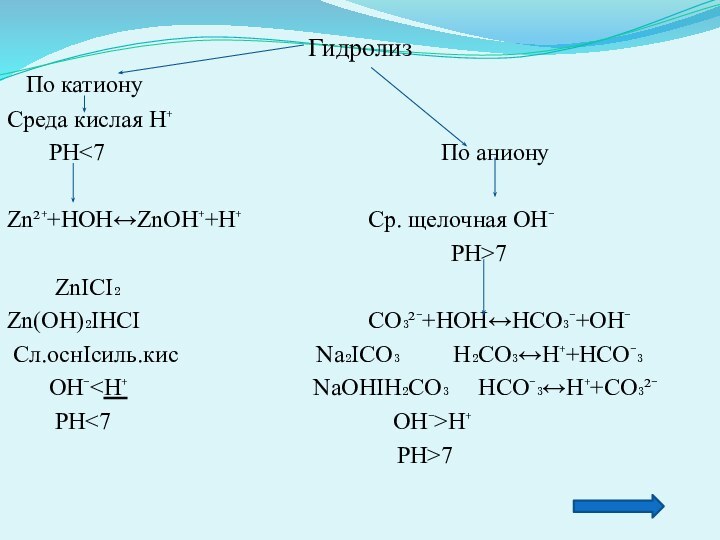
Гидролиз
По катиону
Среда кислая Н⁺
РН<7 По аниону
Zn²⁺+HOH↔ZnOH⁺+H⁺ Ср. щелочная ОН⁻
РН>7
ZnΙCI₂
Zn(OH)₂ΙHCI СО₃²⁻+НОН↔НСО₃⁻+ОН⁻
Сл.оснΙсиль.кис Na₂ΙCO₃ H₂CO₃↔H⁺+HCO⁻₃
ОН⁻<Н⁺ NaOHΙH₂CO₃ HCO⁻₃↔H⁺+CO₃²⁻
РН<7 OH⁻>H⁺
PH>7
Слайд 12
По катиону, по аниону
Не подвергается
Ср.нейтр.
Ср.слабощел.
NaCI+H₂O↔NaOH+HCI
СН₃СООNH₄+H₂O↔ (NH₄)₂CO₃+H₂O↔
CH₃COOH+NH₄OH NH₄OH+NH₄HCO₃ Ср. нейтраль.
CH₃COO⁻+NH₄⁺+HOH↔ 2NH₄⁺+CO₃²⁻+HOH↔ Н⁺=ОН⁻
CH₃COOH+NH₄OH NH₄⁺+OH⁻+NH₄⁺+HCO₃⁻ РН=7
H⁺=OH⁻ Cтепень дисс.NH₄OH>
PH=7 степени дисс. иона НСО₃⁻
Слайд 13
ЕГЭ
Задачи по катиону:
232. Укажите вещество, которое гидролизуется по
катиону:
1.Ва(NO₃)₂ 2.KCI 3.Na₂S
4.FeCI₃
FeCI ₃+H₂O↔Fe OHCI₂+HCI
Fe³⁺+3CI⁻+HOH↔FeOH²⁺+2CI⁻+H⁺+CI⁻
Fe³⁺+HOH↔FeOH²⁺+H⁺ (Ответ:4)
242.Укажите, в водном растворе какой соли концентрация ионов водорода больше концентрации гидроксид-ионов:
1.К₂СО₃ 2.Na₂SO₄ 3.NH₄CI 4.NaCI
Концентрация Н⁺ больше концентрации ионов ОН⁻ в кислой среде. Кислую среду в результате гидролиза имеют соли, образованные слабым основанием и сильной кислотой. В задании это NH₄CI, потому что– NH₄CI=NH₄⁺+CI
NH₄⁺+HOH=NH₄OH+H⁺
NH₄CI+H₂O=NH₄OH+HCI
(Ответ:3)
Слайд 14
Синквейн №2
Гидролиз.
Кислый, положительный.
Образует, гидролизует, протекает.
Между слабым основанием и
сильной кислотой.
По катиону.
Задачи по аниону:
233.Укажите вещество,
которое гидролизует по аниону:
KCN
NaNО₃
Cr₂(SO₄)₃
CaCI₂
KСN+H₂O↔KOH+HCN
CN⁻+HOH↔OH⁻+HCN
CN⁻+HOH↔OH⁻+HCN
(Ответ:1)
Слайд 16
Синквейн №3
1.Гидролиз.
2.Щелочной, отрицательный.
3.Образует, гидролизует, протекает.
4.Между сильным основанием и
слабой кислотой.
5.По аниону.
Слайд 17
ЕГЭ
Не подвергается:
234.Укажите, какая соль не подвергается гидролизу в
водных растворах:
FeCI₃ 2.KCIO₄ 3.K₂CO₃ 4.Ca(NO₂)₂
KCIO₄+H₂O↔KOH+HCIO₄
K⁺+CIO₄⁻+HOH↔KOH+HCIO₄
(Ответ:2)
*А25(8)Укажите, какая соль не подвергается гидролизу:
АI₂S₃ 2.Na₃PO₄ 3FeCI₃ 4.KJ
Слайд 18
Синквейн №4
Гидролиз.
Нейтральный, также(как у воды).
Не образует, не участвует,
не нарушается.
Между сильным основанием и сильной кислотой.
Не подвергается.
Слайд 19
ЕГЭ
Задачи по катиону и по аниону:
7-Г. И по
катиону и по аниону гидролизуется:
Бромид калия
Ацетат натрия
Хлорид аммония
Сульфид аммония
1.KBr
–не подвергается 2.CH₃COONa –по аниону
3.NH₄CI –по катиону 4.(NH₄)₂S–по катиону
по аниону(Ответ:4)
Слайд 20
Синквейн №5
Гидролиз.
Нейтральная, слабощелочная.
Связывают, смешивают, образуют(слабощелочную).
Между слабым основанием и
слабой кислотой.
По катиону и по аниону.
Слайд 21
ЕГЭ
По среде:
235.Укажите раствор, который имеет кислую среду:
Нитрата бария
3.карбоната натрия
Сульфата калия
4.хлорида аммония
1.Ba(NO₃)₂-нейтр. 2.K₂SO₄-нейтр. 3.Na₂CO₃-щел. 4.AICI₃-кислая (Ответ:4)
236.Укажите раствор, который имеет щелочную среду:
Хлорида калия 3.сульфида натрия
Сульфата цинка 4.сульфата меди(II)
1.KCI-нейтр. 2.ZnSO₄-кисл. 3.Na₂S-щел. 4.CuSO₄-кисл.
Na₂S+H₂O↔NaOH+NaHS
S²⁻+HOH↔OH⁻+HS⁻
S²⁻+HOH↔OH⁻+HS⁻ (Ответ:3)
Слайд 22
В3(4)Название соли
Среда раствора
Метилат натрия А)Кислая
Хлорид бария Б)Нейтральная
Нитрит калия В)Щелочная
Нитрат ртути(ΙΙ)
1.HCOONa-щел. 2.BaCI₂-нейтр. 3.KNO₂-щел.
4.Hg(NO₃)₂-кисл. 1 2 3 4
В Б В А
*В3(1)Название соли Среда раствора
Ацетат калия А)Кислая
Сульфит натрия Б)Нейтральная
Нитрат лития В)Щелочная
Хлорид цинка
Слайд 23
Синквейн №6
Гидролиз.
Кислая, щелочная.
Сообщает, распределяет, приобретает.
Между основанием и кислотой.
Среда.
Слайд 24
ЕГЭ
Индикатор:
А25(3)Лакмус окрасится в синий цвет в растворе:
С₂Н₅ОН -неэлектролит
3.Na₃PO₄-кислая
ZnCI₂ -щелочная
4.Na₂SO₄-нейтральная
(Ответ:3 Так как лакмус окрасится в синий цвет в щелочной среде)
А25(4) Метилоранж примет красную окраску:
NaOH -неэл 2.Na₂CO₃-щел 3.NaF -щел 4.AI₂(SO₄)₃-к
(Ответ:4 Так как метилоранж примет красную окраску в кислой среде)
241.Укажите, в каком растворе фенофталин приобретает малиновую окраску:
Zn(NO₃)₂-к 2.(NH₄)₂SO₄ - к 3.Na₂CO₃-щ 4.BaCI₂-нейт
(Ответ:3 так как фенофталин приобретает малиновую окраску в щелочной среде)
Слайд 25
ЕГЭ
А(37).Лакмус изменяет окраску на красную в растворах:
А)Хлорида
натрия
Г)Сульфата аммония
Б)Хлороводородная кислота Д)Гидроксида натрия
В)Карбоната натрия Е)Хлорида цинка
А.NaCI-нейтр. Б.HCI-кис B.Na₂CO₃-щел
Г.AI₂(SO₄)₃-кис Д.NaOH-щел E.ZnCI₂-кис
(Ответ:Б.Г.Е. так как лакмус изменяет окраску на красный в кислой среде)
*А25( 4)Метилоранж примет красную окраску в растворе:
1.NaOH 2.NaF 3.Na₂CO₃ 4.AI₂(SO₄)₃
Слайд 26
ЕГЭ
Способность к гидролизу:
238.Какой ион способен участвовать в реакции
гидролиза солей?
Na⁺ 2.SO₄²¯ 3.Cu²⁺ 4.CI⁻ (Ответ:3
так как здесь только Cu⁺является ионом слабого электролита. Он способен образовывать с ионами воды слабые(малодиссоцирированные) электролиты.)
В3(9) Формула соли Способность к гидролизу
1.ВаSO₄ А)По катиону
2.Na₂CO₃ Б )По аниону
3.CuSO₄ В)По катиону по аниону
4.Cr(NO₃)₃ Г)Не подвергается
5.(NH₄)₂CO₃ 1-Б. 2- Ж. 3-Е. 4-Г.
*В3(6)Формула соли Способность к гидролизу
1.NH₄NO₂ А)По катиону
2.Na₃PO₄ Б)По аниону
3.FeCI₃ В)По катиону по аниону
4.Ba(NO₃)₂ Г)Гидролизу неподвергается
Слайд 27
*В4(10)Формула соли:
Способность к гидролизу:
А)FeCI₃
1.По катиону
Б)AI₂S₃ 2.По аниону
B)(CH₃COO)₂Cu 3.По катиону по аниону
Г)(CH₃COO)₂Ba 4.Не подвергается
Д)KJ
*В3(3)Формула соли: Способность к гидролизу:
1.Cr₂(SO₄)₃ А)По катиону
2.Na₂SO₃ Б)По аниону
3.BaCI₂ В)По катиону по аниону
4.AI₂S₃ Г)Гидролизу неподвергается
Слайд 28
ЕГЭ
239.Укажите формулу пропущенного вещества в уравнениях реакции гидролиза:
Na₂CO₃+H₂O↔… +NaOH (Пропущенным веществом является: NaHCO₃)
240.Укажите формулу пропущенного
вещества в уравнениях реакции гидролиза: FeCI₃+H₂O↔…+HCI (Пропущенным веществом является:FeOHCI₂.)
В3(2)Формула соли: Уравнение гидролиза:
1.Na₂SiO₃ A)Na⁺+H₂O↔NaOH+H⁺
2.AI(NO₃)₃ Б)AI³⁺+H₂O↔AIOH²⁺+H⁺
3.CH₃COONa B)NH₄⁺+H₂O↔NH₃+H₃O⁺
4.NH₄NO₃ Г)CH₃COO⁻+H₂O↔CH₃COOH+H⁺↑
Д)CH₃COO⁻+H₂O↔CH₃COOH+OH⁻
1 2 3 4 E)CH₃COONa+H₂O↔CH₃COOH+Na⁺+OH⁻
З Б Д В Ж)NO₃⁻+H₂O↔HNO₃+OH⁻
З)SiO₃²⁻+H₂O↔HSiO₃⁻+OH⁻
A)CH₃COO⁻+H₂O↔CH₃COOH+OH⁻
2.K₂SO₃ Б)NH₄⁺+H₂O↔NH₃×H₂O+H⁺
3.CH₃COOK В)Zn²⁺+H₂O↔ZnOH⁺+H⁺
4.NH₄CI Г)SO₃²⁻+H₂O↔HSO₃⁻+OH⁻
Д)Zn²⁺+2H₂O↔Zn(OH)₂+2H⁺
243.Отметьте соли, которые необратимо гидролизуются:
1.ZnCI₂ и KNO₃
2.Cr₂(CO₃)₃ и NaH
3.CaCO₃ и MgCO₃
4.Na₂CO₃ и NaCI (Из предложенных солей только Cr₂(CO₃)₃ и NaH гидролизуется необратимо. Соль Cr₂(CO₃)₃ образована слабым основанием и слабой кислотой. Гидролиз идет по катиону по аниону, сопроваждается выделением осадка и газа. Вывод из зоны реакции продуктов приводит к полному гидролизу соли. Ответ:2