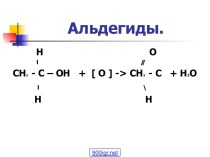
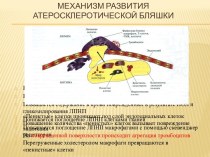
таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы
I группы) литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами.
Эти металлы получили название щелочных, потому что большинство их соединений растворимы в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов.