- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Степень окисления
Содержание
- 2. Степень окисленияЦель урока:Научиться, каким образом, определяется степень
- 3. Образовательные результаты:Личностные: Умение работать в группах и
- 4. Образовательные результаты: 2. Метапредметные: Определить самим тему и цель урока, решить проблемуДелать выводы и умозаключения
- 5. Образовательные результаты:3. Предметные: Разобрать понятие «Степень окисления»
- 6. ВосстановителиВосстановители -это атомы, молекулы или ионы, которые
- 7. ОкислителиОкислители - это атомы, молекулы или ионы,
- 8. Примеры важнейших восстановителей и окислителей.
- 9. ОПРЕДЕЛЕНИЕ:Степень окисления – это условный заряд атомов
- 10. ОПРЕДЕЛЕНИЕ
- 11. Степень окисленияпеременнаяCl,P,SeотрицательнаяS-2 ,N-3 ,O-2положительнаяNa,Al,CaпостояннаяH,K,Znст.о. элементов впростых веществахFe0,Cl20,H20
- 12. Степень окисления бывает: «+», «-», «0».I.
- 13. Степень окисления может иметь отрицательное, положительное
- 14. Отрицательное значение степени окисления имеют те
- 15. Фтор всегда имеет С.О. (- 1) во
- 16. Нулевое значение степени окисления имеют
- 17. Положительное значение степени окисления имеют
- 18. Какие степени окисления у серы?S+16 ))) 1s22s22p63s23p43d0 2 8 686S*S**3p4S*
- 19. Табл. 1:Степени окисления элементов в соединениях:I –
- 20. Определить степени окисления. Пример: Cl2O7Выпишем степень окисления
- 21. Определение С.О. в других соединениях. Дана
- 22. Дано: нитрат железа
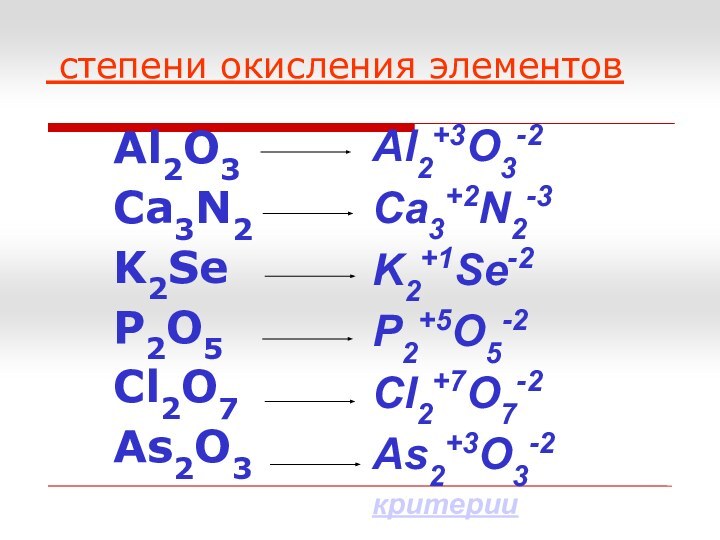
- 23. Определите степени окисления элементовAl2O3Ca3N2K2SeP2O5Cl2O7As2O3
- 24. степени окисления элементовAl2O3Ca3N2K2SeP2O5Cl2O7As2O3Al2+3O3-2Ca3+2N2-3K2+1Se-2P2+5O5-2Cl2+7O7-2As2+3O3-2критерии
- 25. ТЕСТ
- 26. 1. Степень окисления – это величина: а) а) переменная, б) б) постоянная, в) в) постоянная и переменная.
- 27. Правильно!!!!Перейти к следующему вопросу
- 28. Не правильно…Вернуться
- 29. 2. Высшая степень окисления фосфора равна: а) а) номеру группы, т.е. 5 б б) нулю, в) трем.
- 30. Правильно!!!!Перейти к следующему вопросу
- 31. Не правильно…Вернуться
- 32. 3. Вещество, формула которого Р2О5, называется а) оксид
- 33. Правильно!!!!Перейти к следующему вопросу
- 34. Не правильно…Вернуться
- 35. 4. Степень окисления хлора равна -1 в: а) Cl2O3 б) PCl5, в) Cl2.
- 36. Правильно!!!!Перейти к следующему вопросу
- 37. Не правильно…Вернуться
- 38. 5. Состав оксида серы (II) выражается формулой а) SO2, б) SO, в) SO3.
- 39. Правильно!!!!конец
- 40. Не правильно…вернуться
- 41. Критерии оценкиЕсли выполнено всё правильно – оценка
- 42. Домашнее задание:§43, прочитать табл.20 рассмотреть,Стр 152 Упр.6 – слабым (письменно)Упр 5 – сильным (устно)© Осиевская И.А.
- 43. 1. Понравился ли урок?2. Чем? 3. Было
- 44. Скачать презентацию
- 45. Похожие презентации
Степень окисленияЦель урока:Научиться, каким образом, определяется степень окисления в формулах веществ и наоборот - уметь составлять формулы, зная степени окисления.











































Слайд 3
Образовательные результаты:
Личностные:
Умение работать в группах и самостоятельно.
Развить
умение самоконтроля и самооценки.
Развить умение взаимопроверки и взаимоконтроля
Отношение к
труду
Слайд 4
Образовательные результаты:
2. Метапредметные:
Определить самим тему и цель урока,
решить проблему
Делать выводы и умозаключения
Слайд 5
Образовательные результаты:
3. Предметные:
Разобрать понятие «Степень окисления» и
её значением.
Давать определение «Степень окисления»
– Научиться определять степени
окисления в формулах.– Развивать умение составлять формулы, зная степень окисления
Слайд 6
Восстановители
Восстановители -
это атомы, молекулы или ионы, которые отдают
электроны.
Процесс отдачи электронов атомами, молекулами или ионами называется окислением.
Слайд 7
Окислители
Окислители -
это атомы, молекулы или ионы, которые
принимают электроны.
Процесс присоединения электронов атомами, молекулами или ионами называется
восстановлением.
Слайд 8
Примеры важнейших восстановителей и окислителей.
Восстановители:
металлы; водород; уголь;
оксид углерода (II) СО; сероводород Н2S; аммиак NH3,' соляная кислота HC1 и т. д.Окислители:
галогены; кислород О2 азотная НNО3 и серная Н2S04 кислоты; перманганат калия КМn04 и др.
Слайд 9
ОПРЕДЕЛЕНИЕ:
Степень окисления – это условный заряд атомов химического
элемента в соединении, вычисленный на основе предположения, что все
соединения состоят только из ионов.© Осиевская И.А.
Слайд 10
ОПРЕДЕЛЕНИЕ
Степень окисления – число условно отданных или принятых электронов.
Ca+2O-2 K+13P+5O-24
При записи степени окисления знаки (+) или (-) ставят перед цифрой, цифра «1» пишется.
Слайд 11
Степень окисления
переменная
Cl,P,Se
отрицательная
S-2 ,N-3 ,O-2
положительная
Na,Al,Ca
постоянная
H,K,Zn
ст.о. элементов в
простых веществах
Fe0,Cl20,H20
Слайд 12
Степень окисления бывает:
«+», «-», «0».
I. Степень окисления
«0» - ноль:
1. Простые вещества: Н2, Са, О2, К…
2.
Сложные в-ва (в сумме): Са+2О-2(+2 – 2 =0)
© Осиевская И.А.
Слайд 13 Степень окисления может иметь отрицательное, положительное или
нулевое значения, которые обычно ставятся над символом элемента сверху,
например:Na+12S-2, Mg+23N-32, H+13N-3, Cl02
Слайд 14 Отрицательное значение степени окисления имеют те атомы,
которые приняли электроны от других атомов, то есть атомы
более электроотрицательных элементов.Ряд электроотрицательности
неметаллов
H, As, I, Si, P, Se, C, Br, CI, N, O, F.
Металлы всегда имеют только положительную степень окисления.
Слайд 15 Фтор всегда имеет С.О. (- 1) во всех
соединениях.
Кислород, второй после фтора по значению Э.О. элемент,
почти всегда имеет степень окисления (— 2), кроме соединений со фтором, например:Na+12O-2, Fe+32O-23, нo O+2F2-1 .
Слайд 16 Нулевое значение степени окисления имеют атомы
в молекулах простых веществ и атомы в свободном состоянии,
например:Н20, ,N0, ,Fe0, Al0, Cl0, N20, Na0.
Слайд 17 Положительное значение степени окисления имеют те
атомы, которые отдают свои электроны другим атомам, то есть
атомы менее электроотрицательных элементов.Металлы в соединениях всегда имеют положительную степень окисления:
Cu+2 Na+ AI+3 Mg+2
Слайд 19
Табл. 1:Степени окисления элементов в соединениях:
I – группа:
С.О. +1 Na+1Cl, K+1Cl…
II
- группа: С.О. +2 Сa+2Cl2…III - группа: С.О. +3 Al+3Cl3…
Кислород: С.О. -2 Na+12О-2, Сa+2О-2.
Водород: С.О. +1, с металлами -1.
F (фтор) С.О. -1,
Cl (хлор) С.О -1 почти всегда.
© Осиевская И.А.
Слайд 20
Определить степени окисления.
Пример: Cl2O7
Выпишем степень окисления кислорода.
Обозначим
неизвестную с.о. хлора через Х:
Cl2+х O7-2 ,
3. составим
уравнение:2∙х+(-2)∙7=0
2∙х -14=0
2∙х=+14
Х=+7
Ответ: Cl2+7O7-2
© Осиевская И.А.
Слайд 21
Определение С.О. в других соединениях.
Дана формула:
К3РО4 фосфата калия.
По ПСХЭ определяем С.О. кислорода
( 8 – 6 = 2 ),так как Э.О.кислорода больше, чем калия и фосфора, то С.О. кислорода = -2,
а у калия постоянная С.О., равная № группы в ПСХЭ и составляет +1.
По уравнению (+1.3 +Х +-2.4=0), Х=+5.
К+3Р+5О-24
Слайд 22 Дано: нитрат железа (III)
Fe(NO3)3
реобразуем формулу: FeN3O9
C.О. кислорода -2, железа +3, так как она указана в скобках римской цифрой, С.О. железа переменная.
Определяем С.О.азота по уравнению: (+3+3х+9*(-2)=0), отсюда С.О.азота +5.
Fe+3(N+5O3-2)3
Проверка: +3+(3.+5+9*(-2))=0.
Слайд 24
степени окисления элементов
Al2O3
Ca3N2
K2Se
P2O5
Cl2O7
As2O3
Al2+3O3-2
Ca3+2N2-3
K2+1Se-2
P2+5O5-2
Cl2+7O7-2
As2+3O3-2
критерии
Слайд 26
1. Степень окисления – это величина:
а) а) переменная,
б)
б) постоянная,
в) в) постоянная и переменная.
Слайд 32
3. Вещество, формула которого Р2О5, называется
а) оксид фосфора
б)
оксид фосфора (оксид фосфора (Vоксид фосфора (V)
в) оксид фосфора
(II)
Слайд 41
Критерии оценки
Если выполнено всё правильно – оценка «5»,
Если
выполнены 1 задание неправильно – оценка «4»
Если выполнено неправильно
2 задания – оценка «3».Если выполнено неправильно 3 задания – оценка «2».
Слайд 42
Домашнее задание:
§43, прочитать
табл.20 рассмотреть,
Стр 152 Упр.6 –
слабым (письменно)
Упр 5 – сильным (устно)
© Осиевская И.А.
Слайд 43
1. Понравился ли урок?
2. Чем?
3. Было ли
трудно?
4. Что именно?
«Испытание натуры трудно, но приятно, полезно
и свято» М.В.Ломоносов:
РЕФЛЕКСИЯ