- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему нуклеиновые кислоты
Содержание
- 2. Обратимые и необратимые реакцииНеобратимыми называют химические реакции,
- 3. Обратимые и необратимые реакцииПри каких условиях данная реакция будет обратимой? Необратимой?
- 4. Химическое равновесиеСостояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
- 5. Смещение химического равновесияПринцип Ле Шателье (1884г.):
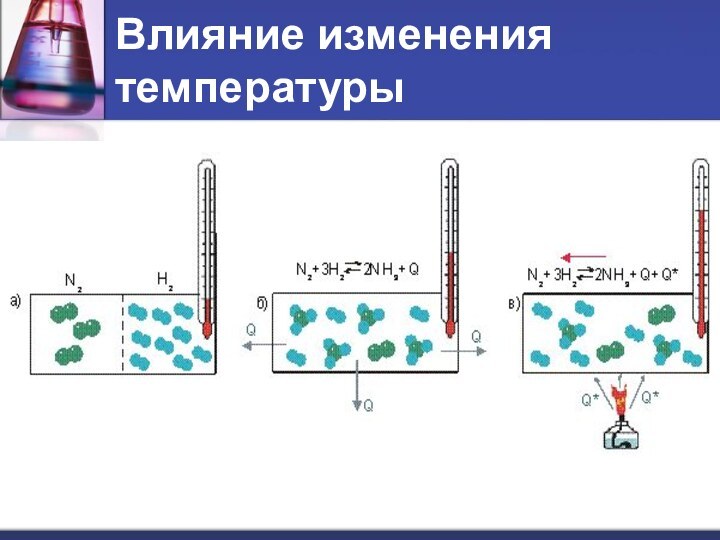
- 6. Влияние изменения температуры
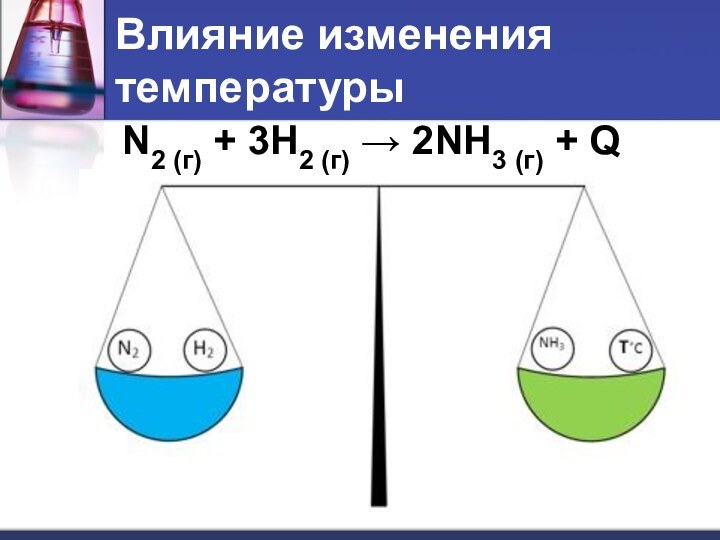
- 7. Влияние изменения температурыN2 (г) + 3H2 (г) → 2NH3 (г) + Q
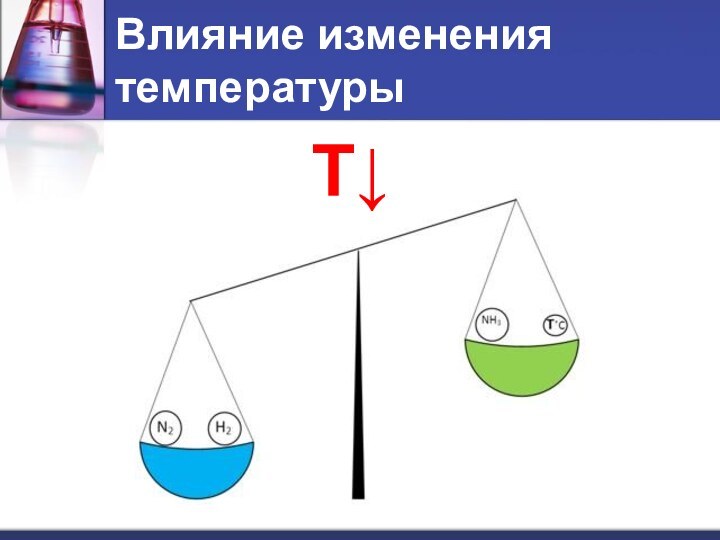
- 8. Влияние изменения температурыT↓
- 9. При повышении температуры равновесие смещается в сторону
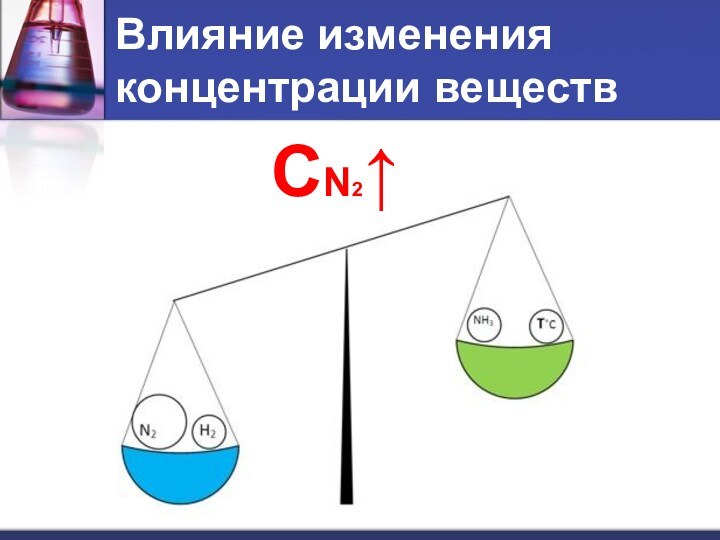
- 10. Влияние изменения концентрации веществСN2↑
- 11. Влияние изменения концентрации веществПри увеличении концентрации одного
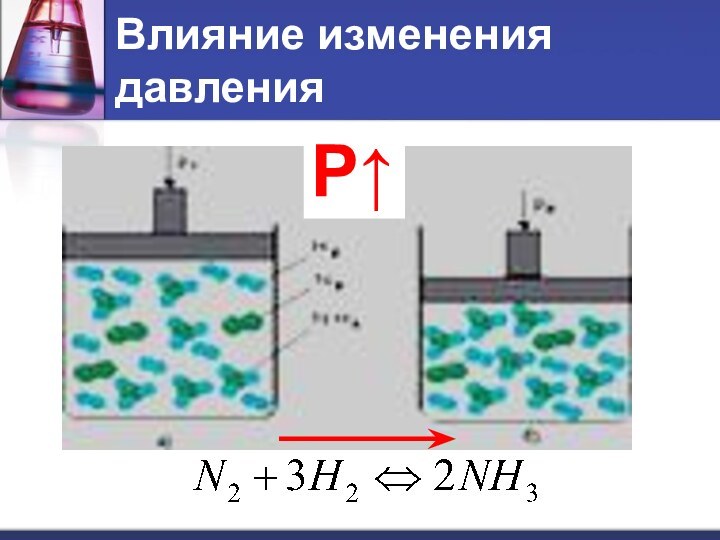
- 12. Влияние изменения давленияР↑
- 13. Влияние изменения давленияПри увеличении давления равновесие смещается
- 14. Катализатор:не влияет на смещение химического равновесия (он лишь ускоряет процесс его достижения)
- 15. Скачать презентацию
- 16. Похожие презентации
Обратимые и необратимые реакцииНеобратимыми называют химические реакции, протекающие только в одном направлении. Обратимыми называют реакции, протекающие при одних и тех условиях и в прямом, и в обратном направлениях.