- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Строение атома
Содержание
- 2. СТРОЕНИЕ АТОМА
- 3. Студент должен:Знать:Основные положения теории строения атома (ядра
- 4. Атом - сложная частица, состоящая из положительно
- 6. Протоны, нейтроны и электроны называются элементарными частицами. Символы
- 7. Изотопы-атомы одного химического элемента, имеющие одинаковое число
- 8. Для строгого описания движения электронов вокруг атомного
- 9. Если l=0, то орбиталь называется s-орбиталь (движение
- 10. ml-магнитное квантовое число- характеризует проекцию магнитного момента
- 11. Атомная орбиталь- это совокупность положений электрона в
- 12. ms-спиновое квантовое
- 13. Если атом находится в основном состоянии (не
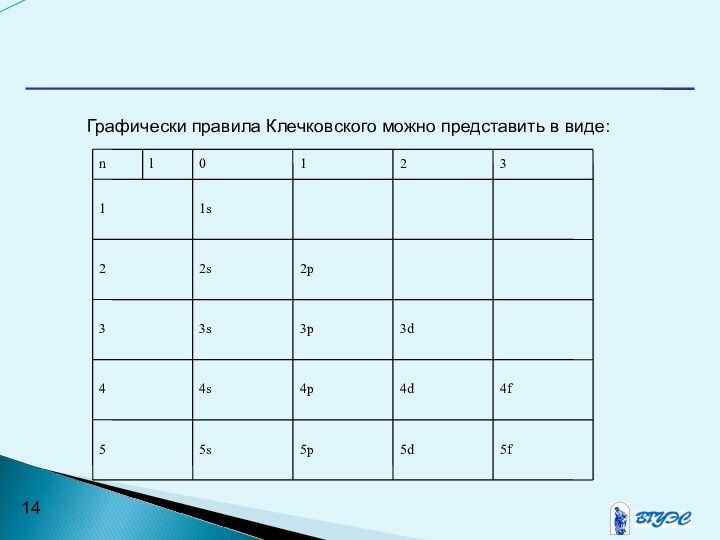
- 14. Графически правила Клечковского можно представить в виде:
- 15. Заполнение электронами орбиталей происходит в следующем порядке:
- 16. Максимальное число электронов на уровне N=2n2, где
- 17. Правило Хунда. Внутри подуровня электроны заполняют орбитали
- 18. Число электронов в атоме определяется порядковым номером
- 19. Если до полного или половинного заполнения d-подуровня
- 20. Электроны в атоме можно разделить на два
- 21. Скачать презентацию
- 22. Похожие презентации
СТРОЕНИЕ АТОМА


















Слайд 3
Студент должен:
Знать:
Основные положения теории строения атома (ядра и
состояния электронов), формулировку периодического закона
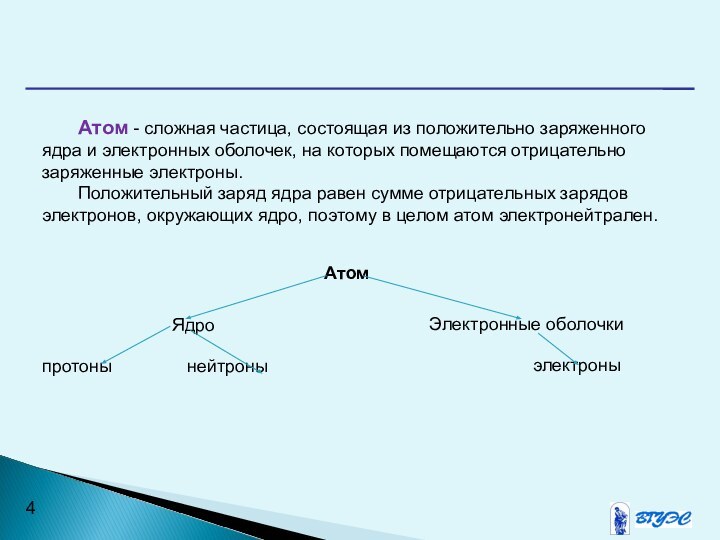
объяснять периодичность изменения их свойствСлайд 4 Атом - сложная частица, состоящая из положительно заряженного
ядра и электронных оболочек, на которых помещаются отрицательно заряженные
электроны.Положительный заряд ядра равен сумме отрицательных зарядов электронов, окружающих ядро, поэтому в целом атом электронейтрален.
протоны нейтроны
Атом
Электронные оболочки
Ядро
электроны
Слайд 6
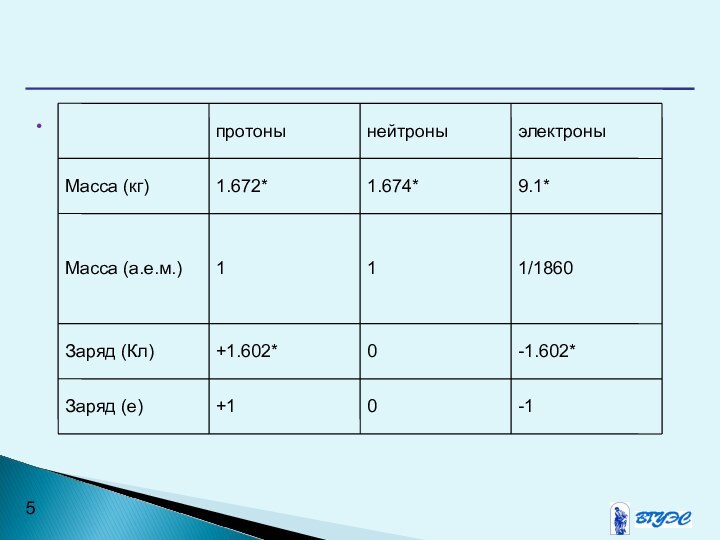
Протоны, нейтроны и электроны называются элементарными частицами.
Символы химических
элементов представляются обычно в виде:
где Х-символ элемента;
a-массовое число (сумма
числа протонов и нейтронов);b-порядковый номер элемента (число протонов);
с-заряд иона.
Природные химические элементы существуют в виде смеси изотопов.
Слайд 7 Изотопы-атомы одного химического элемента, имеющие одинаковое число протонов,
но разные массовые числа (число нейтронов). Например, природный хлор
существует в виде двух изотопов : , ядро которого содержит 17 протонов и 18 нейронов, и (17 протонов и 20 нейтронов).Атомная масса элемента, приведенная в периодической системе элементов, есть средняя масса его природных изотопов:Слайд 8 Для строгого описания движения электронов вокруг атомного ядра
необходимо использовать понятие корпускулярно- волнового дуализма электрона (электрон обладает
одновременно свойствами частицы и волны).Состояние (поведение) электрона в атоме характеризуется набором констант, которые называются квантовыми числами.
n-главное квантовое число- определяет общий запас энергии электрона, т.е энергетический уровень.n=1,2,3…
l-орбитальное квантовое число- определяет форму электронной орбитали (энергетический подуровень).l=0,1,2…(n-1).
Слайд 9 Если l=0, то орбиталь называется s-орбиталь (движение электрона
по сфере). При l=1 мы имеем р-орбиталь (гантелевидная форма
движения). Формы движения электронов по d- и f-орбиталям (l=2 и 3 соответственно) имеют еще более сложный вид.Число подуровней на энергетическом уровне совпадает с его номером. Так, для первого уровня (n=1) существует только один подуровень (l=1), то есть 1s-орбиталь. Аналогично для n=2 (второй уровень) имеем два подуровня (l=0,1) или 2s,2p-орбитали и т.д.
Слайд 10 ml-магнитное квантовое число- характеризует проекцию магнитного момента электрона
на внешнее магнитное поле, то есть определяет ориентацию электронной
орбитали в пространстве. Его значения определяются орбитальным квантовым числом:ml =
При значении орбитального квантового числа l=0 магнитное квантовое число имеет одно возможное значение (ml =0), то есть возможен только один способ ориентации s-орбитали в пространстве. Аналогично получаем, что для р-орбиталей (l=1, ml =-1,0,+1) существует три возможных способа ориентации (вдоль осей координат), для d-орбиталей- пять возможных способов ориентации и т.д.
Слайд 11 Атомная орбиталь- это совокупность положений электрона в атоме,
характеризуемых определенными значениями главного, орбитального и магнитного квантовых чисел.
Условно атомные орбитали обозначают в виде клетки (энергетической ячейки):1s
2s 2p
3s 3p 3d
Слайд 12 ms-спиновое квантовое число-
определяет собственный момент вращения электрона. Это квантовое число вытекает
не из решения уравнения Шредингера, а из анализа атомных спектров . Спиновое квантовое число может принимать два значения: ms=Условно электроны, имеющие разные значения спинового квантового числа, обозначаются противоположно направленными стрелками: ↑↓.
Слайд 13 Если атом находится в основном состоянии (не обладает
избыточной энергией), то его электроны занимают наиболее низкие по
энергии орбитали. Энергия электрона в многоэлектронных атомах зависит не только от его притяжения к ядру, но и от отталкивания от других электронов. Взаимное влияние приводит к тому, что энергия электронов зависит не только от главного, но и от орбитального квантового числа.Правила Клечковского:
1.Увиличение энергии электронных подуровней идет в порядке увеличения суммы главного и орбитального квантовых чисел (n+l).
2. В случае равенства суммы (n+l) увеличение энергии подуровней идет в порядке увеличения главного квантового числа.
Слайд 15 Заполнение электронами орбиталей происходит в следующем порядке: 1s,2s,2p,3s,3p,4s,5s,4d,5p
и т.д.
Принцип Паули. В атоме не может существовать двух
электронов с одинаковым набором квантовых чисел. В связи с тем, что каждая электронная орбиталь характеризуется набором трех квантовых чисел (главного, орбитального и магнитного), электроны на одной орбитали могут отличаться только значением спинового квантового числа ( ms= )
Следствием принципа Паули является то, что на одной орбитали не может находиться более двух электронов.
Слайд 16
Максимальное число электронов на уровне N=2n2, где n-главное
квантовое число.
В связи с вышесказанным на первом энергетическом уровне
может максимально находиться два электрона: или 1s2;На втором энергетическом уровне-8 электронов:
или 2s22p6 и т.д
Слайд 17 Правило Хунда. Внутри подуровня электроны заполняют орбитали таким
образом, чтобы суммарному спиновое квантовое число было максимальным (орбитали
подуровня сначала заполняются по одному электрону и только после этого происходит спаривание).Например, четыре электрона на р-подуровне можно расположить двумя разными способами:
или
Так как в первом случае суммарное спиновое число больше, то заполнение электронами р-орбиталей идет именно этим способом.
Слайд 18 Число электронов в атоме определяется порядковым номером элемента
в периодической системе. Используя правила размещения электронов в атоме,
для атома натрия (11 электронов) можно получить следующую электронную формулу:11Na: 1s22s22p63s1
Электронная формула атома титана:
22Ti: 1s22s22p63s23p64s23d2
Слайд 19
Если до полного или половинного заполнения d-подуровня (d5
или d10- конфигурации)не хватает одного электрона, то происходит «проскок
электрона»-переход на d-подуровень одного электрона с соседнего s-подуровня. В результате электронная формула атома хрома имеет вид 24Cr: 1s22s22p63s23p64s13d5, а не 1s22s22p63s23p64s23d4.Число электронов в отрицательно заряженном ионе- анионе- превышает число электронов нейтрального атома на величину заряда иона: 16S2-:1s22s22p63s23p6 (18 электронов).
При образовании положительно заряженного иона- катиона- электроны прежде всего уходят с подуровней с большим значением главного квантового числа: 24Cr3+: 1s22s22p63s23p64s03d3 (21 электрон).
Слайд 20
Электроны в атоме можно разделить на два типа:
внутренние и внешние (валентные). Внутренние электроны занимают полностью завершенные
подуровни, имеют низкие значения энергии и не участвуют в химических превращениях элементов.Валентные электроны – это все электроны последнего энергетического уровня и электроны незавершенных подуровней.
Валентные электроны принимают участие в образовании химических связей. Особую активность имеют неспаренные электроны. Число неспаренных электронов определяет валентность химического элемента.
Если на последнем энергетическом уровне атома имеются пустые орбитали, то возможно распаривание на них валентных электронов (образование возбужденного состояния атома).





























