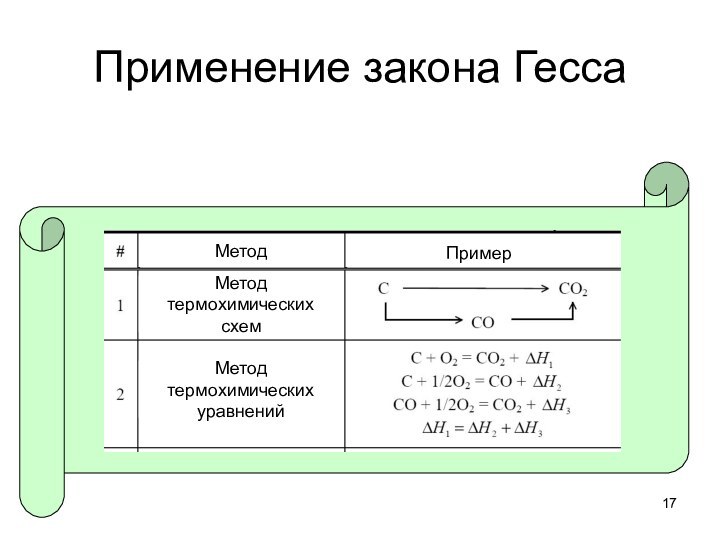
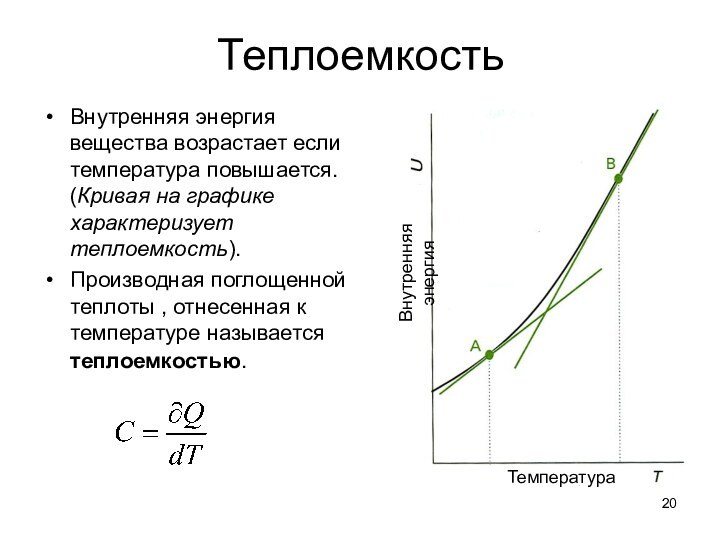
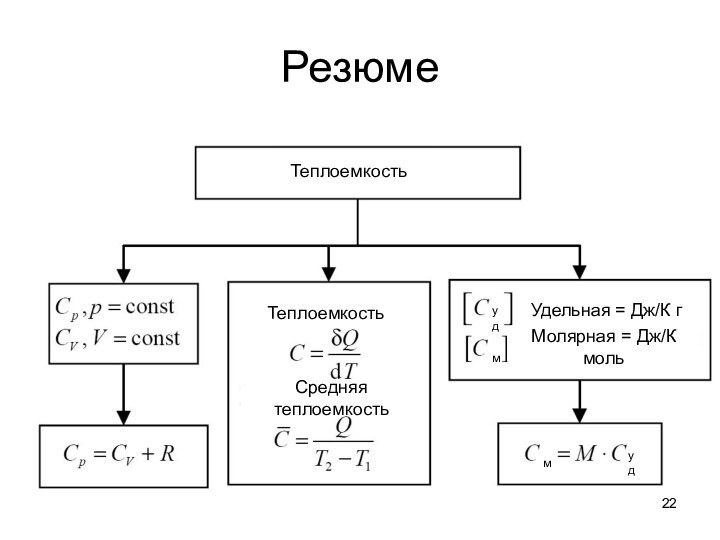
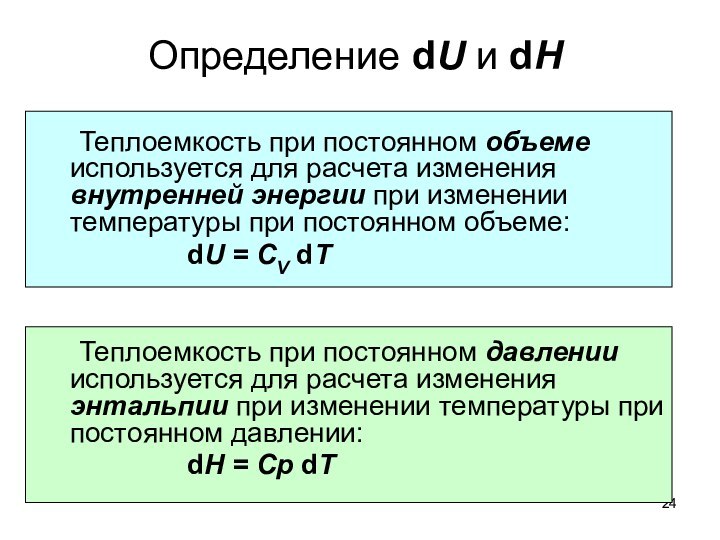
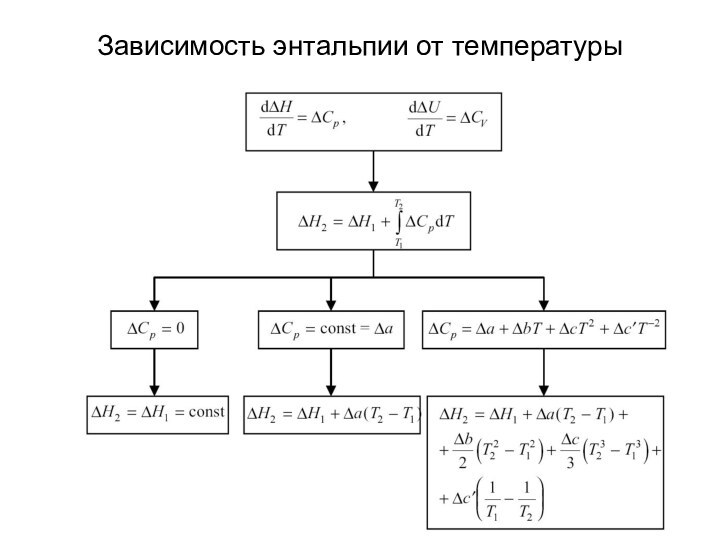
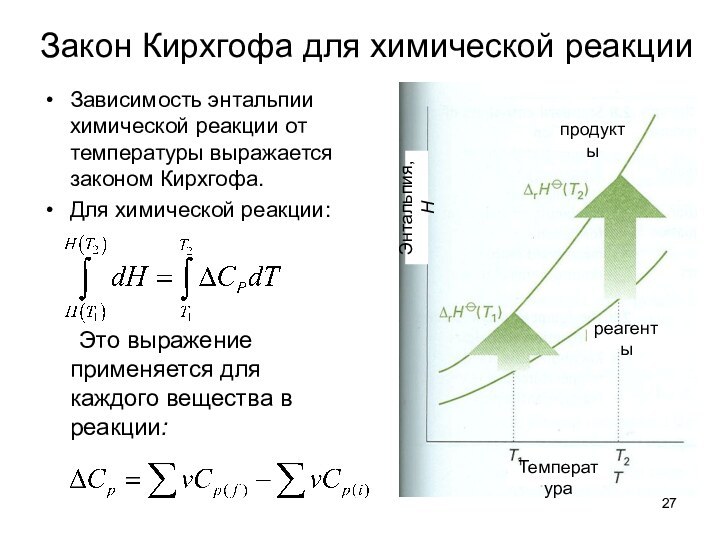
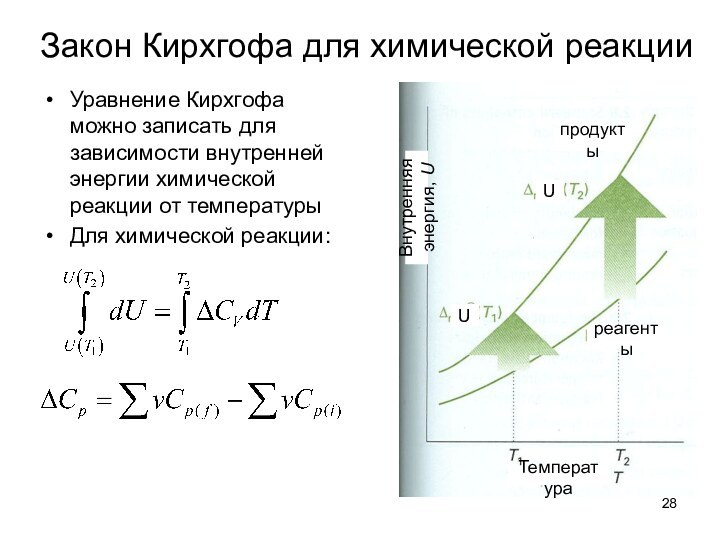
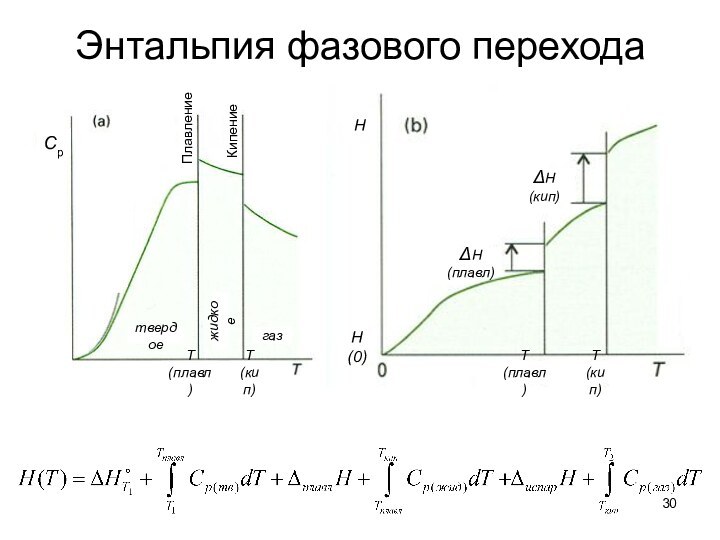
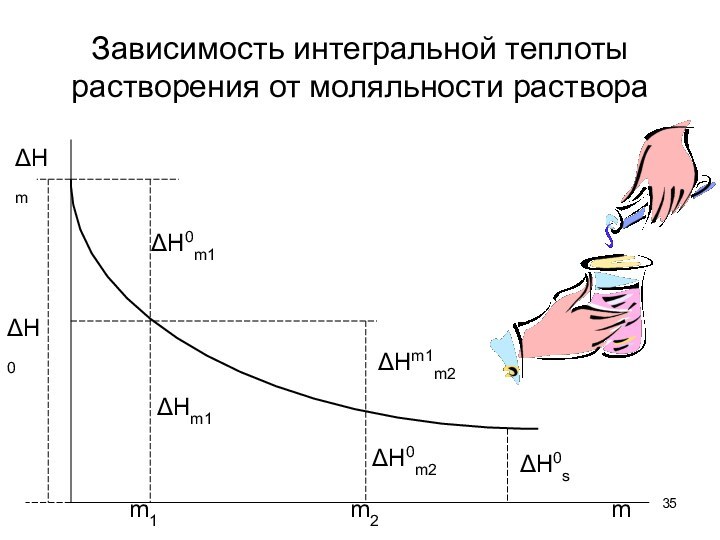
тепловые эффекты химических реакций.
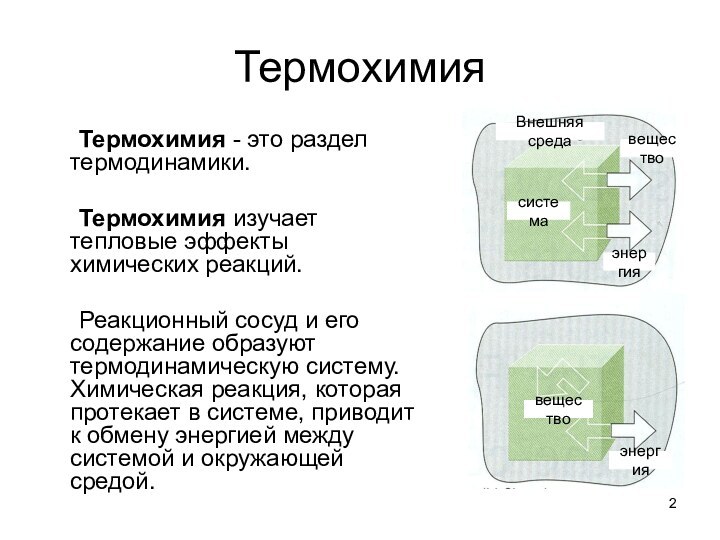
Реакционный сосуд и его содержание
образуют термодинамическую систему. Химическая реакция, которая протекает в системе, приводит к обмену энергией между системой и окружающей средой. система
вещество
Внешняя среда
энергия
вещество
энергия