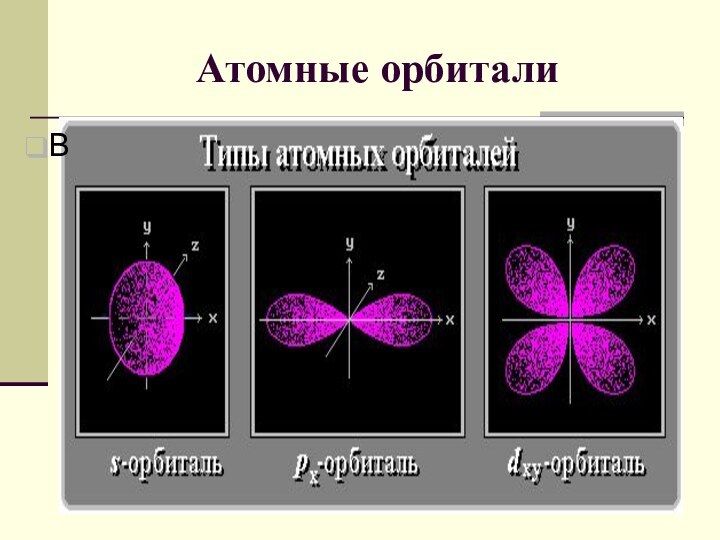
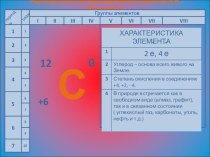
электрона подчиняется законам квантовой механики. Связь между волновыми и корпускулярными
свойствами электрона отражает соотношение де Бройля: l =h/mv ,где l - длина волны электрона;m - его масса; v - скорость; h = 6.62Ч10-34 ДжЧс - постоянная Планка.
Свойства электрона