Слайд 2
Урок-игра
Девиз: «Все познается в сравнении».
Слайд 3
Повторение основных понятий темы:
ОКСИДЫ, КИСЛОТЫ,
ОСНОВАНИЯ, СОЛИ.
Слайд 4
оксиды
Na2O
MgO
BaO
Mn2O7
SiO2 тв
CO2
H2O
Чем особенен оксид водорода?
газы
Несолеобразующие
Солеобразующие
Основные
оксиды
Кислотные
оксиды
FeO
CaO
SO2
N2O3
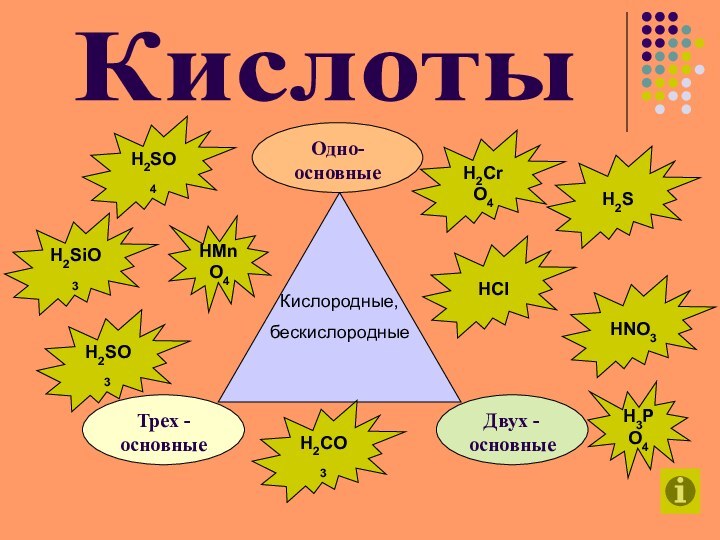
Слайд 5
Кислородные,
бескислородные
HCl
H2SO4
H2SO3
H2CO3
HNO3
H2S
H3PO4
H2SiO3
H2CrO4
HMnO4
Кислоты
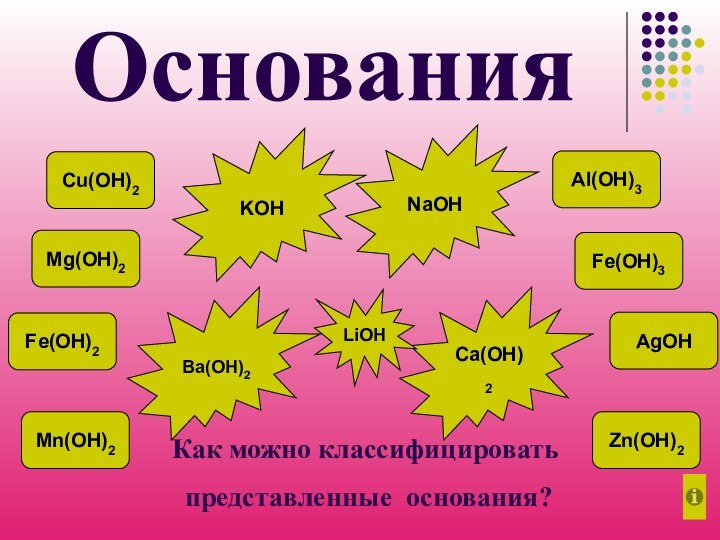
Слайд 6
Как можно классифицировать
представленные основания?
Cu(OH)2
Al(OH)3
Fe(OH)3
Mg(OH)2
Ba(OH)2
Ca(OH)2
KOH
NaOH
LiOH
AgOH
Fe(OH)2
Mn(OH)2
Zn(OH)2
Основания
Слайд 7
Разделите соли на растворимые и не растворимые.
Дайте названия опираясь на признаки: средние, кислые, основные.
У
вас так получилось?
Меn+ Аm - (анион кислотного остатка)
NaCl
Na2CO3
CuSO4
Al(NO3)3
NaHCO3
Mg(HSO4)2
(CuOH)2CO3
BaCl2
FeCl3
FeS
Na3PO4
KNO3
Соли
Слайд 8
Какая связь называется генетической ?
Генетическая связь
Слайд 9
Сколько генетических рядов можно
выделить и какие они?
Два
генетических ряда: ряд Ме и не Ме.
Слайд 10
Ряд не Ме:
неметалл → кислотный оксид → кислота
→ соль.
P → P2O5 → H3PO4 → Ca3(PO4)2
неметалл →
кислотный оксид → соль → кислота → кислотный оксид → неметалл.
Si → SiO2 → Na2SiO3 → H2SiO2 → Si
Ряд Ме:
металл → основной оксид → основание (щелочь) → соль.
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
металл → основный оксид → соль → основание основный → оксид → металл.
Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu
Слайд 11
Проведение конкурсов
1. Нужно организовать 3 команды:
Команда №1 –
«Атом»,
№2
– «Молекула»,
№3 – «Ион».
2. Игра состоит из нескольких конкурсов с разными заданиями, которые оцениваются баллами. В конце урока, баллы будут подсчитаны и выставлены соответствующие оценки.
3. Капитан команды назначает своих участников по каждому конкурсу.
4. Если кто-либо в команде в течении всей игры не принимает в ней участие, то баллы снимаются со всей команды.
Слайд 12
Конкурс № 1 «Теоретическая разминка.»
Правила игры:
1. Каждая команда
по очереди отвечает на вопросы представленные на слайде.
Максимальная оценка
за конкурс – 3 балла. (1 балл за каждый правильный ответ).
Слайд 13
«Атом»: Сколько классов сложных веществ неорганической химии вам
известно?
Ответ. Четыре (оксиды, основания, кислоты, соли).
«Молекула»: Сложные вещества, состоящие
из двух элементов, один из которых кислород.
Ответ. Оксиды.
«Ион»: Сложные вещества, состоящие из атомов водорода и кислотных остатков.
Ответ. Кислоты.
Слайд 14
«Атом»: Сложные вещества, состоящие из атомов металла и
одной или несколько гидроксильных групп.
Ответ. Основания.
«Молекула»: Сложные вещества, состоящие
из атомов металла и кислотного остатка.
Ответ. Соли.
«Ион»: Назовите вещество, которое одновременно и оксид и гидрид.
Ответ. Вода.
Слайд 15
«Атом»: Соли, содержащие кислотный остаток азотной кислоты.
Ответ. Нитраты.
«Молекула»:
Вещества, которые под действием щелочей и кислот меняют свой
цвет.
Ответ. Индикаторы.
«Ион»: Соли, содержащие кислотный остаток сероводородной кислоты.
Ответ. Сульфиды.
Слайд 16
Конкурс № 2 «Найди родственников»
Из дидактических карточек
с формулами веществ.
За 1 мин необходимо выбрать из
предложенного перечня веществ:
для команды «Атом» все - оксиды и соли,
команды «Молекула» все - основания и соли, команды «Ион» все - кислоты и соли,
записать их в таблицу.
Дать им названия.
Максимальная оценка за конкурс – 6 баллов. (0,5 баллов за каждый правильный ответ).
Слайд 17
Конкурс № 3 «Третий лишний»
За 1 мин
необходимо найти на каждой строке лишнюю формулу вещества и
объяснить, почему именно эта формула лишняя.
Максимальная оценка за конкурс – 3 балла.
Слайд 18
Задание команде «Атом»: Найти лишнюю формулу, вычеркнуть ее
и назвать класс веществ:
1. CO2
Fe(OH)3 SO3
2. AgNO3 NaOH Cu(OH)2
Задание команде «Молекула»: Найти лишнюю формулу, вычеркнуть ее и назвать класс веществ:
1. HCl Al(OH)3 H2SO4
2. MgSO4 FeS K2O
Задание команде «Ион»: Найти лишнюю формулу, вычеркнуть ее и назвать класс веществ:
1. СuCl2 HNO3 H3PO4
2. Al2O3 H2S N2O5
Слайд 19
Конкурс № 4 «Экспертиза»
Каким способом можно распознать
кислоты, не пробуя их на вкус?
Какие индикаторы вы знаете?
Что такое качественные реакции?
Как действуют кислоты и щелочи на индикаторы?
Слайд 20
Таблица изменения окраски индикаторов.
Слайд 21
Задание команде «Атом»:
NaOH 2. HCl
3. NaCl
Задание команде
«Молекула»:
1.KBr 2.H2SO4 3.KOH
Задание команде «Ион» :
1.HNO3 2.KI 3. LiOH
За 1 минуту, используя индикатор, необходимо распознать, в какой пробирке находится каждое вещество, и объяснить почему.
Записать уравнения диссоциации электролитов.
Сравните свои выводы со слайдом. Максимальная оценка 6 баллов.
Слайд 22
Уравнения диссоциации электролитов (вещества, которые в растворе и
расплаве проводят электрический ток).
Слайд 24
Конкурс № 5 «Восстанови запись»
За 3 мин
необходимо: дописать пропущенные вещества, расставить коэффициенты и указать тип
реакции.
Затем команды обмениваются выполненными заданиями и проверяют их в течение 1 минуты.
Каждое правильно записанное уравнение реакции оценивается в 1 балл (максимальная оценка 3 балла).
Слайд 25
Решение задания конкурса «Восстанови запись»
Задание команде «Атом».
СuO +
2 HCl = CuCl2 + H2O (тип реакции обмена)
Mg
+ Cl2 = Mg Cl2 (тип реакции соединения)
2Fe(OH)3 = 3H2O + Fe2O3 (тип реакции разложения)
Задание команде «Молекула».
Ca + Br2 = Ca Br2 (тип реакции соединения)
Cu(OH)2 = H2O +CuO (тип реакции разложения)
Zn + H2SO4 = ZnSO4 + H2 (тип реакции замещения)
Задание команде «Ион».
Na2O + 2HCl = 2NaCl +H2O (тип реакции обмена)
2Al(OH)3 = Al2O3+ 3H2O (тип реакции разложения)
Mg + H2SO4= MgSO4+ H2 (тип реакции замещения)
Слайд 26
Конкурс № 6 «Блиц».
Каждая по очереди команда дает
ответ на задаваемый вопрос.
Вопросы будут представлены на слайде.
Каждый правильный
ответ оценивается в 1 балл (максимальная оценка 3 балла).
Слайд 27
Задание команде «Атом». Сектор
«Кислоты».
Какая кислота содержится в
желудочном соке человека:
1) Серная 2) Соляная 3) Фосфорная.
Какая кислота
используется в аккумуляторах:
1)Серная 2) Соляная 3) Фосфорная
Какая кислота содержится в составе газированного напитка «Пепси-кола»:
1) Серная 2) Соляная 3) Фосфорная
Слайд 28
Задание команде «Молекула». Сектор
«Основания».
1.Какая щелочь используется для
побелки стволов деревьев с малой концентрацией:
1)Гидроксид калия 2) гидроксид
кальция 3) гидроксид натрия
Какая щелочь называется каустической содой и применяется для производства искусственного волокна, а также для очистки продуктов нефтепереработки.
1)Гидроксид калия 2) гидроксид кальция 3) гидроксид натрия
Какая щелочь более опасна:
1)Гидроксид калия 2) гидроксид кальция 3) гидроксид натрия
Слайд 29
Задание команде «Ион». Сектор «Соли».
0,9 % раствор какой
соли называют физраствором и применяют при потере крови:
1)хлорид натрия
2) нитрат серебра 3) хлорид кальция.
5% раствор какой соли применяют при аллергической реакции детям:
1)хлорид натрия 2) нитрат серебра 3) хлорид кальция.
Какая соль применяется под названием «ляпис» и применяется в медицине для прижигания бородавок:
1)хлорид натрия 2) нитрат серебра 3) хлорид кальция.
Слайд 30
Конкурс № 7 «Запиши уравнения».
Запишите уравнения химических
реакций по схеме:
1 команда : Оксид ртути(+2) =
ртуть + кислород Алюминий + соляная кислота = хлорид алюминия + водород
2 команда: Цинк + кислород = оксид цинка Карбонат кальция = оксид кальция + оксид углерода ( +4)
3 команда: Оксид железа + алюминий = железо + оксид алюминия
Сульфат цинка + гидроксид натрия = сульфат натрия + гидроксид цинка
За правильное выполнение задания 4 балла.
Слайд 31
Проверь себя.
1 команда
1) 2HgO =2 Hg + O2
2)
2Al + 6HCl =2 AlCl3 +3H2
2 команда
2Zn + O2 = 2ZnO CaCO3 = CaO + CO2
3 команда
1) Fe2O3 + 2Al = Al2O3 +2 Fe 2)FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4