Слайд 2
Цель: опытным путем установить уровень рН осадков (или
воды, образовавшейся при таянии снега) и объяснить результаты своего
исследования.
Предмет исследования: водородный показатель растворов
Объект исследования: талая вода, полученная путем сбора осадков в зимнее время 2008-2009 года.
Слайд 3
Методы исследования: теоретический :изучения соответствующей литературы, анализ полученных
результатов; практический метод.
Место исследования: район Западное Дегунино, ГОУ ЦО
№ 1481, ул. Ангарская д.22-а
Оборудование и реактивы. Штатив с пробирками, полоски универсальной индикаторной бумаги; дождевая (талая) вода, вода из-под крана, дистиллированная вода.
Слайд 4
Введение
Введение
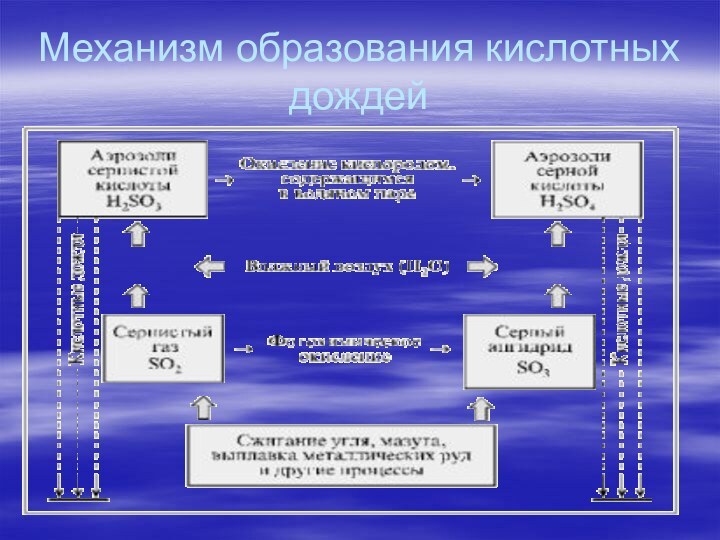
КИСЛОТНЫЕ ОСАДКИ, дождь, снег или дождь со снегом,

имеющие повышенную кислотность. Кислотные осадки возникают главным образом из-за
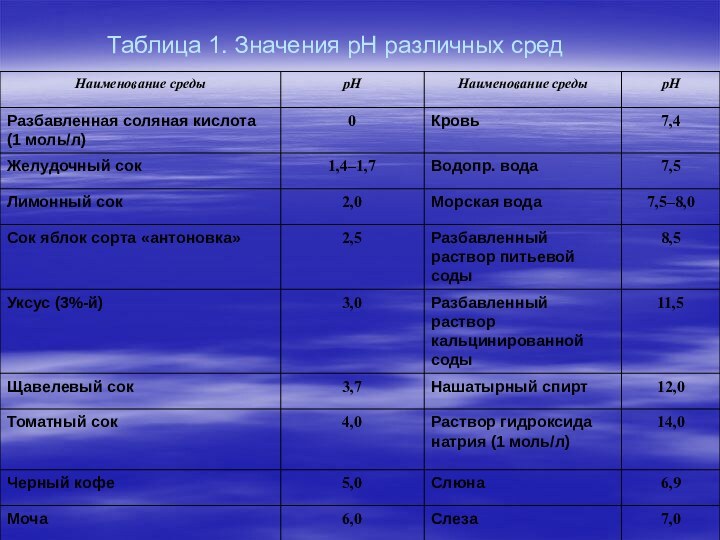
выбросов оксидов серы и азота в атмосферу при сжигании ископаемого топлива (угля, нефти и природного газа). Растворяясь в атмосферной влаге, эти оксиды образуют слабые растворы серной и азотной кислот и выпадают в виде кислотных дождей. Относительная кислотность раствора выражается индексом рН (кислотность определяется наличием свободных ионов водорода Н+; рН – это показатель концентрации ионов водорода). При рН = 1 раствор представляет собой сильную кислоту (как электролит в аккумуляторной батарее); рН = 7 означает нейтральную реакцию (чистая вода), а рН = 14 – это сильная щелочь (щелок). Поскольку рН измеряется в логарифмической шкале, водная среда с рН = 4 в десять раз более кислая, чем среда с рН = 5, и в сто раз более кислая, чем среда с рН = 6. Обычная незагрязненная дождевая вода имеет рН = 5,65. Кислотными называются дожди с рН менее 5,65. Из данных, приведенных в табл. 1, следует, что рН дождевой воды в норме должен составлять около 6,0.
Слайд 5
Таблица 1. Значения рН различных сред
Слайд 6
Водородный показатель
Водородный показатель, или рН, среды – это
десятичный логарифм концентрации катионов водорода, взятый с обратным знаком:
рН
= –lgc(H+),
где c(H+) – концентрация катионов водорода, моль/л.
Данное понятие введено в 1909 г. датским химиком С.Серенсеном.
В зависимости от значения рН различают следующие реакции среды:
рН < 7 – кислая (рН = 0–3 – сильнокислая, рН = 4–6 – слабокислая);
рН = 7 – нейтральная;
рН > 7 – щелочная (рН = 8–10 – слабощелочная, рН = 11–14 – сильнощелочная). Роль рН исключительно велика как в природе, так и в технике, поскольку многие процессы в живых организмах и промышленном производстве протекают только при строго определенных значениях рН.
Слайд 7
Механизм образования кислотных дождей
Слайд 8
Методы определения значения рН
Для определения значения pH растворов
широко используют несколько методик. Водородный показатель можно приблизительно оценивать
с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Слайд 9
1 метод
Для грубой оценки концентрации водородных ионов широко
используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от
pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы
Слайд 10
Для расширения рабочего интервала измерения pH используют так
называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов.
Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
Слайд 11
2 метод
Использование специального прибора — pH-метра — позволяет измерять pH
в более широком диапазоне и более точно (до 0,01
единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется
Слайд 12
3 метод
Аналитический объёмный метод — кислотно-основное титрование — также даёт
точные результаты определения кислотности растворов. Раствор известной концентрации (титрант)
по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
Слайд 13
Практическая часть
В своей работе мы решили рассмотреть кислотность
осадков, выпадающих в нашем районе. В литературе много материала
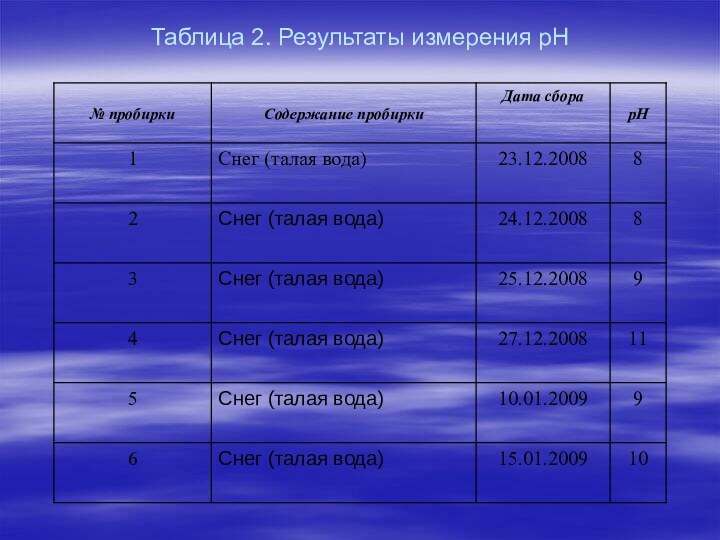
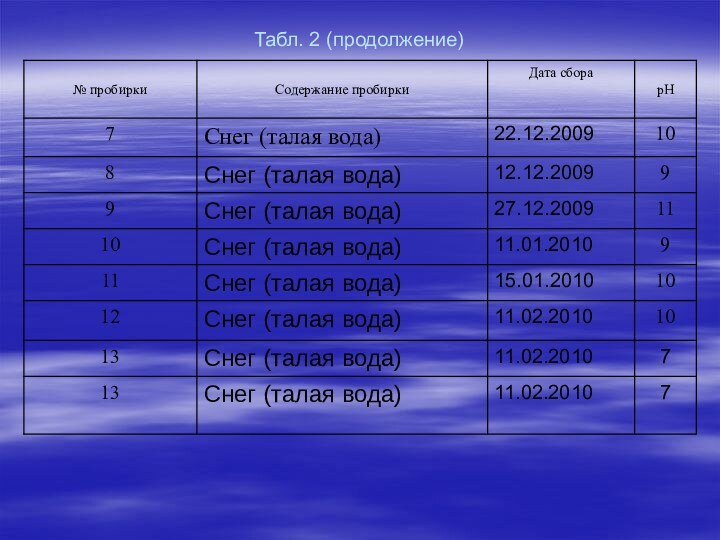
о вредности кислотных осадков, поэтому цель работы для нас стала очень актуальной. А поскольку материал о водородном показателе изучается в курсе химии 11 класса, то он обладает и определенной новизной. В течение декабря-февраля 2008-2009-2010 года мы собирали осадки и исследовали их с помощью универсальной индикаторной бумаги.
Слайд 15
Алгоритм выполнения работы
1. Собрать снег, дождаться когда он
растает.
2. Вылить талую воду в пробирку.
3. Смочить раствором из
пробирки полоску универсальной индикаторной 6умаги, поместить влажную полоску на лист белой бумаги и быстро сравнить окраску индикаторной бумаги с эталоном шкалы рН. Значение рН, соответствующее окраске эталона и индикаторной бумаги, записать в
табл. 2.
Слайд 17
Таблица 2. Результаты измерения рН
Слайд 19
Выводы
Наше исследование показало, что кислотные дожди нашему району
не угрожают, наши осадки дают щелочную, либо слабо щелочную
среду. Тогда возникает вопрос, откуда берутся щелочные дожди. Исследовав литературу, мы увидели, что подобное явление-не такая и редкость. Концентрированный щелочной дождь выпал в Ставрополе и окрестностях в 2003 году. Было зафиксировано большое количество жалоб граждан на то, что капли от прошедшего дождя оставили несмываемые пятна на одежде, особенно сшитой из кожи. Коричневатые пятна остались и на автомобилях. Как сообщили агентству "Интерфакс" в территориальном управлении Роспотребнадзора по краю, в выпавших осадках содержались азотистые соединения. "Проведен анализ осадков на качественном уровне, который показал, что в осадках содержалась щелочь, а именно - азотистые соединения", - сказал представитель ставропольского ТУ Роспотребнадзора
Слайд 20
Внимательно изучив свой район, почитав литературу, мы узнали,
что здесь много промышленных предприятий - среди них Ховринский
железнодорожный узел, заводы "Ритм", "Знамя", трубозаготовительный и авторемонтный, холодильник № 15 и др. Из всех перечисленных предприятий, возможно, холодильник № 15 и является причиной хоть и незначительной, но щелочной реакции осадков.