- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Углерод и его соединения
Содержание
- 2. Элемент - неметалл № 6 в периодической
- 3. Аллотропные модификации углерода имеют атомную кристаллическую решетку. Их строениеАлмазГрафитФуллерен
- 4. АлмазПрименяется в: Обрабатывающей промышленности Электротехнике Горной промышленности
- 5. Графит…это мягкое серо-черное вещество,тугоплавкое , являющееся полупроводником
- 6. ФуллеренФуллерены планируют использовать:1. Для создания фотоприемников2. Для
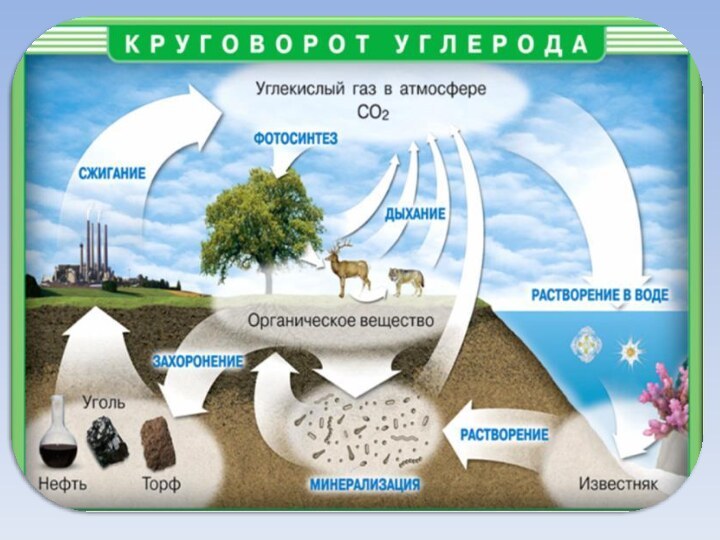
- 7. Нахождение в природеМел,известняк, мраморCaCO3Магнезит MgCO3СидеритFeCO3В самородном
- 9. В составе растений и животных (~18 %).В
- 10. Химические свойства углеродаСо сложными веществами:1. Восстанавливает металлы
- 11. Применение углеродаПроизводство чугуна и сталиВ медицине (уголь активированный)Карандашная промышленностьДля изготовления электродовВ ювелирной промышленности
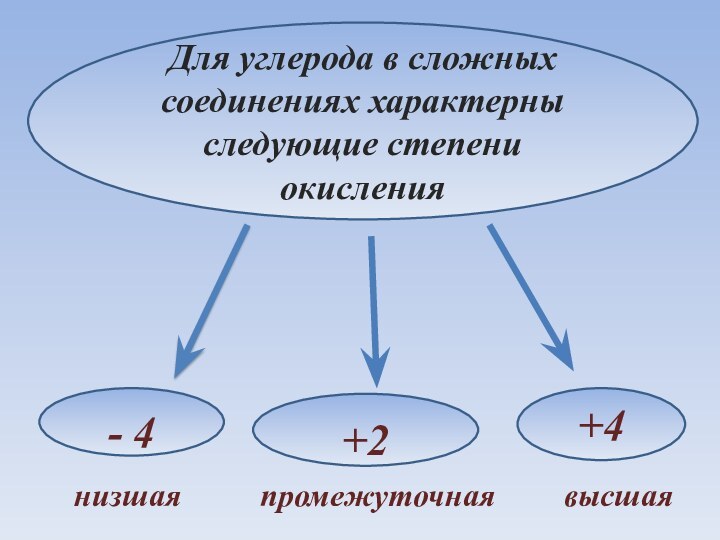
- 12. Для углерода в сложных соединениях характерны следующие степени окисления- 4+4+2низшаяпромежуточнаявысшая
- 13. Степень окисления -4CH4 – газ метанAl4C3 -
- 14. Степень окисления +2CO - угарный газсильный яд, опасный для жизни и здоровья человека(несолеобразующий оксид)
- 15. Степень окисления +4H2CO3-угольная кислотаСоли угольной кислоты (например K2CO3-карбонат калия)CO2-углекислый газ
- 16. 1.Реагирует с кислородом2CO + O2 =CO22. Является
- 17. Химические свойства CO2- (кислотный оксид)1.Реагирует с
- 18. Химические свойства карбонатов (солей угольной кислоты)1.Качественной реакцией
- 19. Углекислотный огнетушительСухой лед (хладагент)СодаМоющие средстваЛимонадыСоединения углерода вокруг нас
- 20. http://urbanjewelers.biz/wp-content/uploads/2010/10/diamonds-e1288016603994.jpg http://www.jabinesban.com/wp-content/uploads/2010/09/fullereno_fullereno.jpg http://s58.radikal.ru/i160/1012/ff/2e7639eb01bc.jpg http://www.rmnt.ru/pub/uploads/glass_cutter_0511_3.jpg http://www.students.by/articles/19/1001931/PH04503.jpg http://art-market.com.ua/media/catalog/product/cache/17/image/9df78eab33525d08d6e5fb8d27136e95/1/1/111111111111111_2.jpg http://im5-tub-ru.yandex.net/i?id=42457246-63-72&n=21
- 21. Скачать презентацию
- 22. Похожие презентации
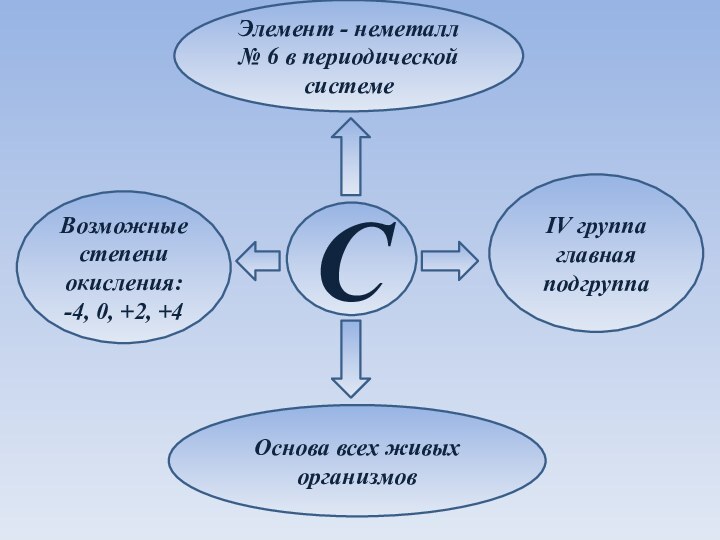
Элемент - неметалл № 6 в периодической системеCIV группа главная подгруппа Возможные степени окисления:-4, 0, +2, +4Основа всех живых организмов














Слайд 2
Элемент - неметалл № 6 в периодической системе
C
IV
группа главная подгруппа
всех живых организмов
Слайд 3
Аллотропные модификации углерода имеют атомную кристаллическую решетку.
Их
строение
Алмаз
Графит
Фуллерен
Слайд 4
Алмаз
Применяется в:
Обрабатывающей промышленности
Электротехнике
Горной промышленности
Ювелирном
производстве
…это самое твердое вещество на Земле, тугоплавкое с высоким
показателем преломления
Слайд 5
Графит
…это мягкое серо-черное вещество,
тугоплавкое , являющееся
полупроводником со
слоистой структурой.
Применяется в:
Графитовых стержнях-электродах
Производстве теплозащитного
материала для головных
частей ракет (термостойкость)Получении тиглей
Изготовлении минеральных красок
Карандашной промышленности
Слайд 6
Фуллерен
Фуллерены планируют
использовать:
1. Для создания фотоприемников
2. Для создания
сверхпроводящих материалов
3. В качестве красителей для копировальных машин
4. В
качестве основы для аккумуляторных батарей5. Для создания оптоэлектронных устройств
6. В медицине и фармакологии
… это новая аллотропная
форма углерода , молекула которого
состоит из 60-70 атомов , образующих
сферу.
Слайд 7
Нахождение в природе
Мел,
известняк,
мрамор
CaCO3
Магнезит
MgCO3
Сидерит
FeCO3
В самородном
виде:
алмаз и графит
В виде солей:
Содержание углерода в
земной коре 0,1 % по массе
Слайд 9
В составе растений и животных (~18 %).
В организме
человека достигает около 21 % (15 кг на 70 кг
массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани
Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
Углерод в живых организмах
Слайд 10
Химические свойства углерода
Со сложными веществами:
1. Восстанавливает металлы из
их оксидов
CaO+ 3C0=CaC2+C+2O
2. Реагирует с концентрированными кислотами С0+2H2SO4=2SO2+C+4O2+2H2O
С простыми
веществами:1. С неметаллами:
Si + C0 =SiC-4
C0+O2=C+4O2
2. С металлами:
4AL + 3C0 = AL4C3-4
В реакциях углерод проявляет, и окислительные, и восстановительные свойства
Слайд 11
Применение углерода
Производство чугуна и стали
В медицине (уголь активированный)
Карандашная
промышленность
Для изготовления электродов
В ювелирной промышленности
Слайд 12 Для углерода в сложных соединениях характерны следующие степени
окисления
- 4
+4
+2
низшая
промежуточная
высшая
Слайд 13
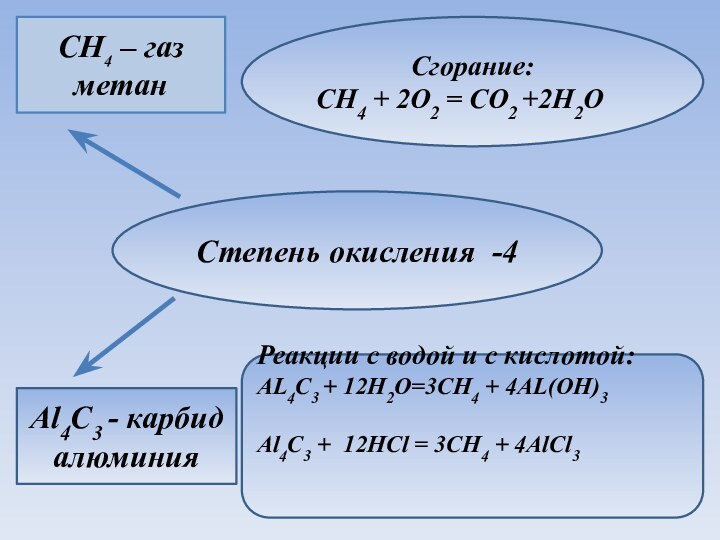
Степень окисления -4
CH4 – газ метан
Al4C3 - карбид
алюминия
Сгорание:
CH4 + 2O2 = CO2 +2H2O
Реакции с водой и
с кислотой:AL4C3 + 12H2O=3CH4 + 4AL(OH)3
Al4C3 + 12HCl = 3CH4 + 4AlCl3
Слайд 14
Степень окисления +2
CO - угарный газ
сильный яд, опасный
для жизни и здоровья человека
(несолеобразующий оксид)
Слайд 15
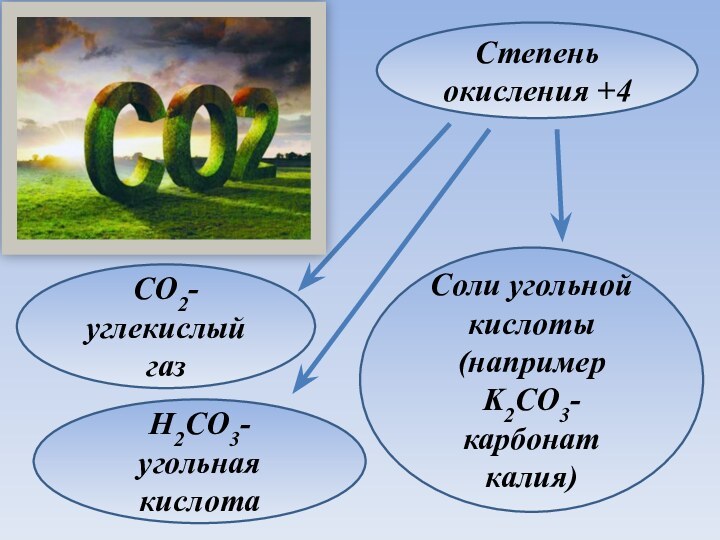
Степень окисления +4
H2CO3-угольная кислота
Соли угольной кислоты (например K2CO3-карбонат
калия)
CO2-углекислый газ
Слайд 16
1.Реагирует с кислородом
2CO + O2 =CO2
2. Является восстановителем
металлов из их оксидов
ZnO + CO = Zn +
CO2Химические свойства CO
Слайд 17
Химические свойства CO2- (кислотный оксид)
1.Реагирует с водой
CO2
+ H2O = H2CO3
2.Реагирует с основными оксидами
CO2 + CaO
= CaCO33.Реагирует с щелочами
CO2 + 2KOH = K2CO3 + H2O
4.Реагирует с углеродом
CO2 + C = 2CO
Слайд 18
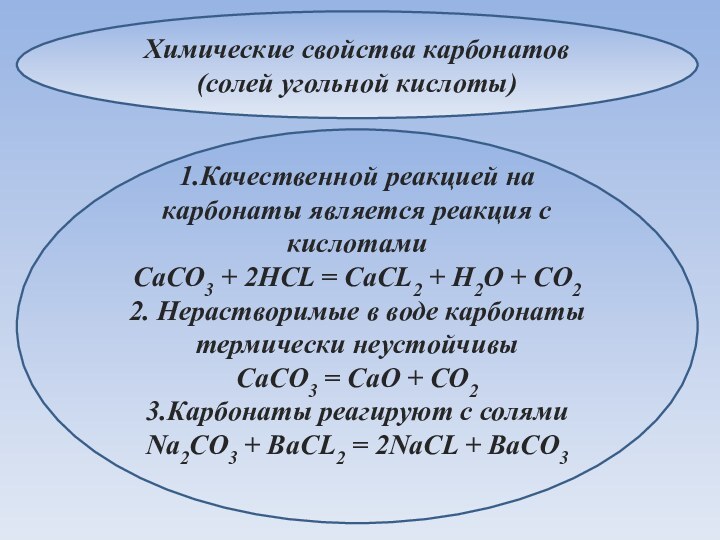
Химические свойства карбонатов (солей угольной кислоты)
1.Качественной реакцией на
карбонаты является реакция с кислотами
CaCO3 + 2HCL = CaCL2
+ H2O + CO22. Нерастворимые в воде карбонаты термически неустойчивы
CaCO3 = CaO + CO2
3.Карбонаты реагируют с солями
Na2CO3 + BaCL2 = 2NaCL + BaCO3





























