Слайд 2
Строение
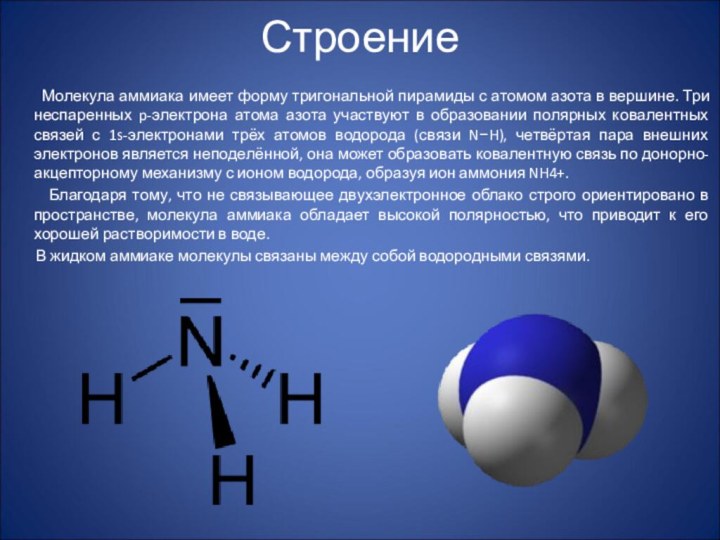
Молекула аммиака имеет форму
тригональной пирамиды с атомом азота в вершине. Три неспаренных
p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+.
Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями.
Слайд 3
Физические свойства
При нормальных условиях –
бесцветный газ с характерным резким запахом.
Плотность
аммиака почти вдвое меньше, чем у воздуха.
Растворимость NH3 в воде чрезвычайно велика.
Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость.
Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Твёрдый аммиак — бесцветные кубические кристаллы.
Слайд 4
Получение в лаборатории.
Для получения аммиака в лаборатории используют действие сильных
щелочей на соли аммония:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашеной известью:
2NH4Cl + Ca(OH)2 → CaCl3 + 2NH3↑ + 2H2O
Слайд 5
Получение в промышленности
Промышленный способ
получения аммиака основан на прямом взаимодействии водорода и азота.
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции.
Слайд 6
Химические свойства
Водный
раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания
процесса:
NH3 + H2O → NH4+ + OH-
Взаимодействуя с кислотами, даёт соответствующие соли аммония:
NH3 + HNO3 → NH4NO3
Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
2NH3 + 2K → 2KNH2 + H2
Слайд 7
Химические свойства
При нагревании
аммиак разлагается, проявляет восстановительные свойства. (аммиак проявляет ТОЛЬКО восстановительные
свойства, так как азот в нем находится в степени окисления -3 и не может принимать электроны, может их только отдавать). Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
2NH3 1200-1300˚C N2 + 3H2
4NH3 + 3O2 → 2N2 + 6H2O (без катализатора, при повышенной температуре)
4NH3 + 5O2 → 4NO + 6H2O(в присутствии катализатора, при повышенной температуре)
Образование химической связи по донорно-акцепторному механизму:
NH3 + H = NH4+