их атомных орбиталей с образованием молекулярных орбиталей (МО).
Различают
два механизма образования ковалентной связи:обменный;
донорно-акцепторный
04.03.2016
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


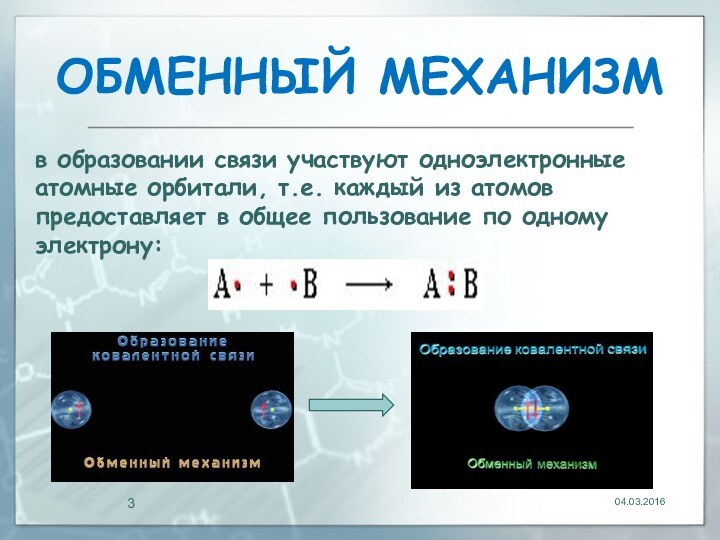
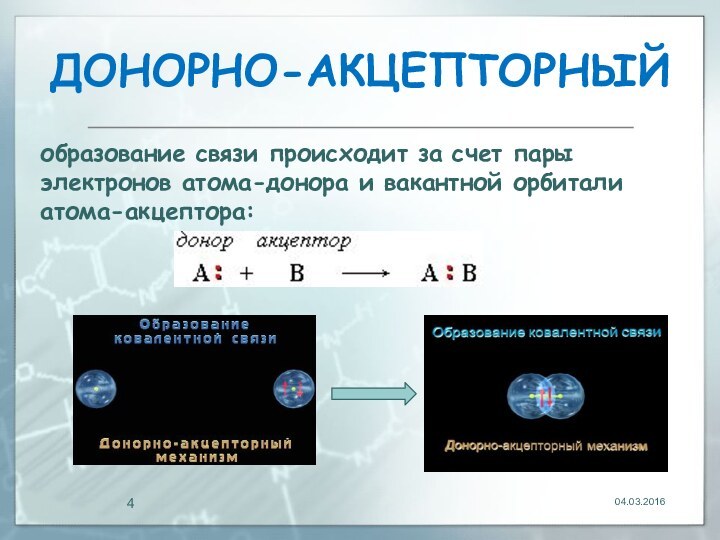

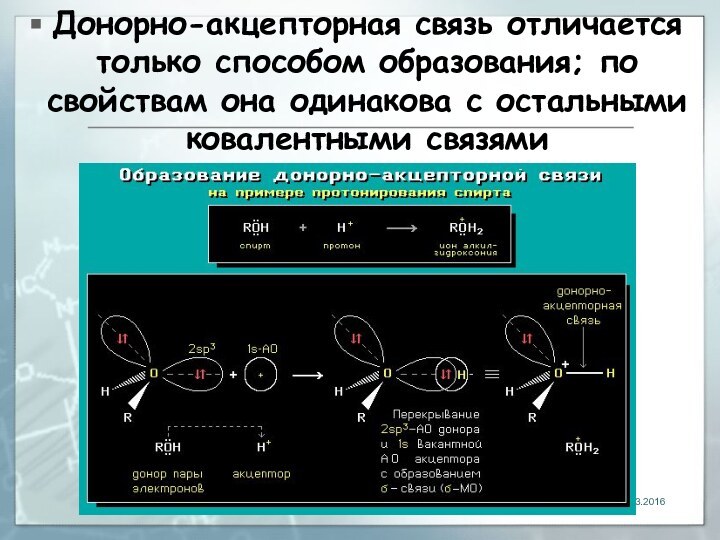


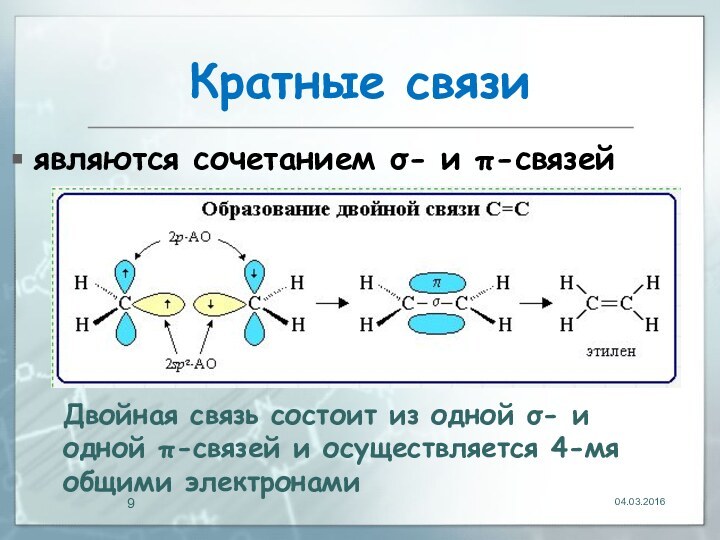
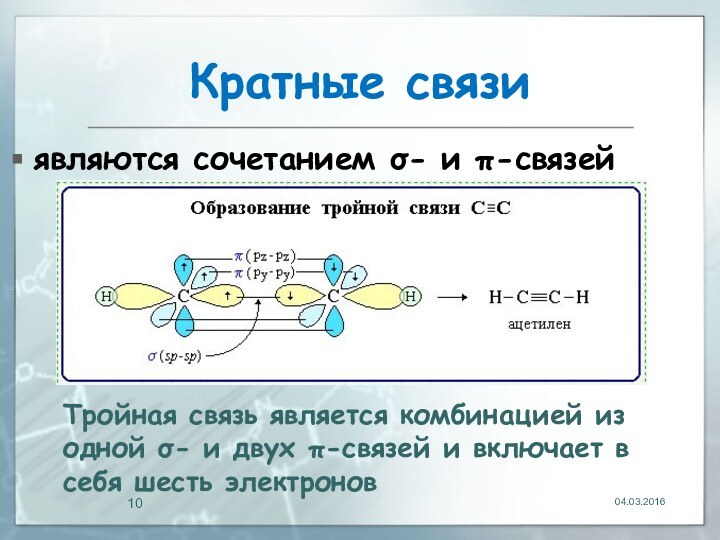

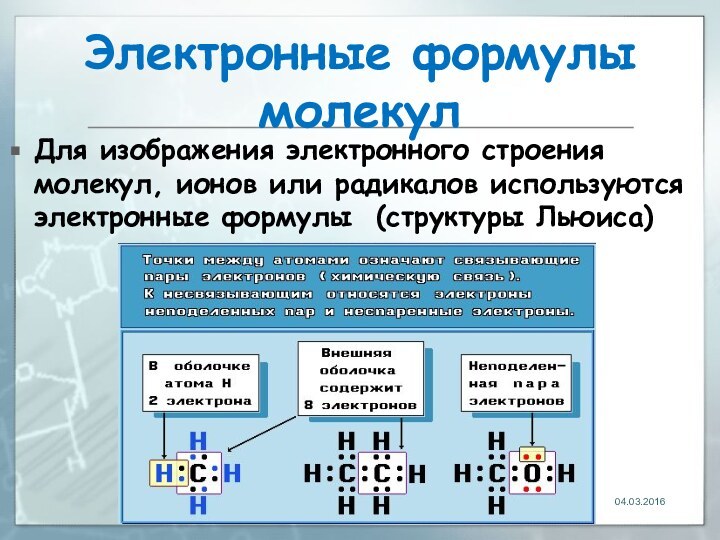
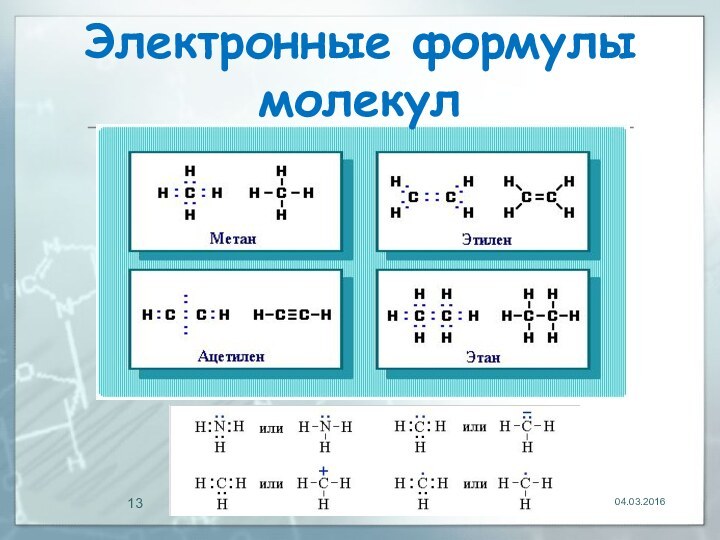

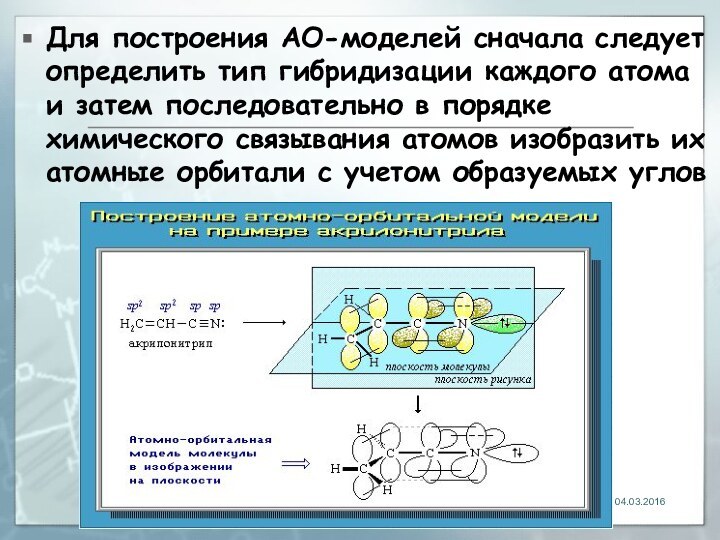
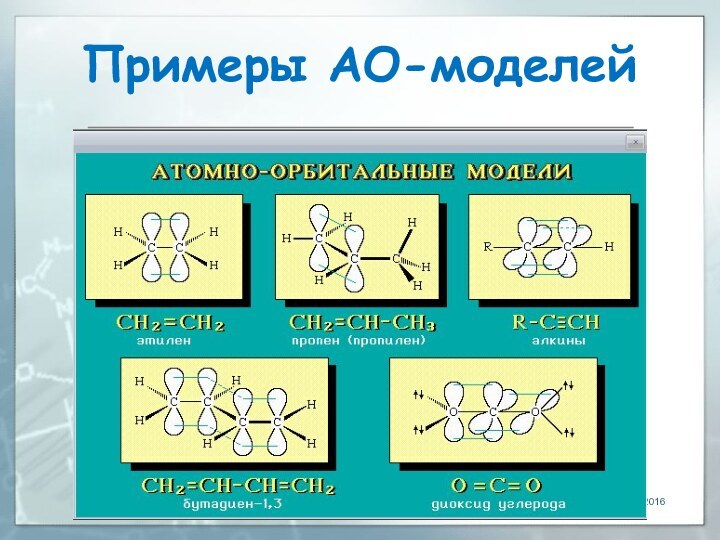


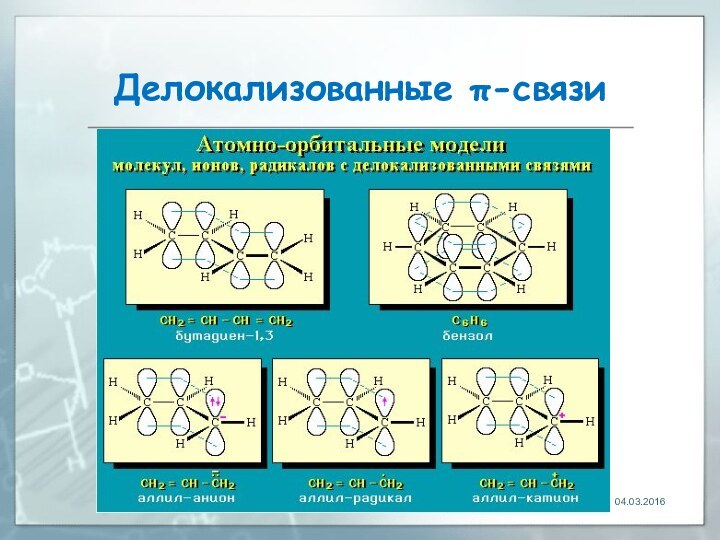
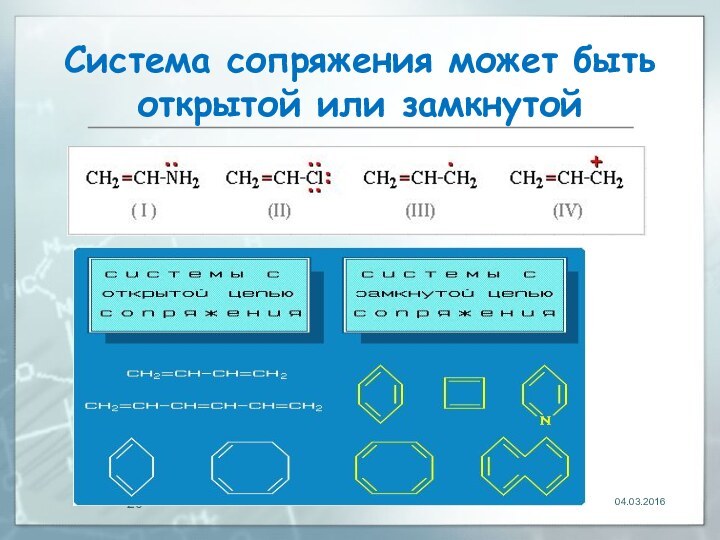










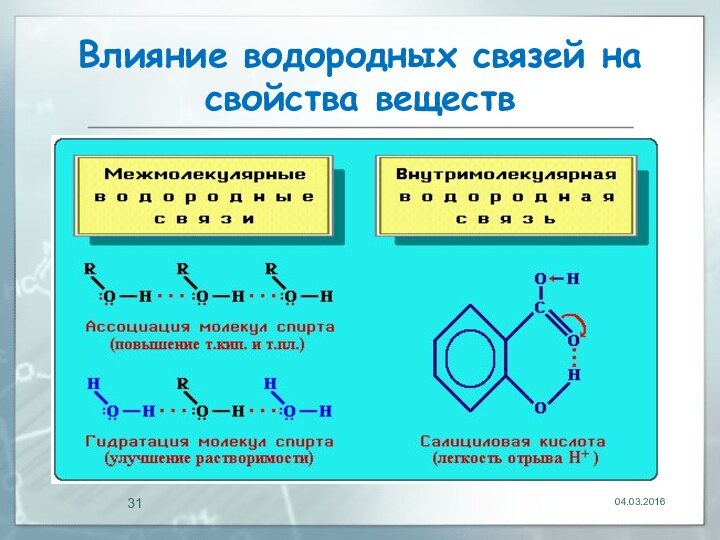

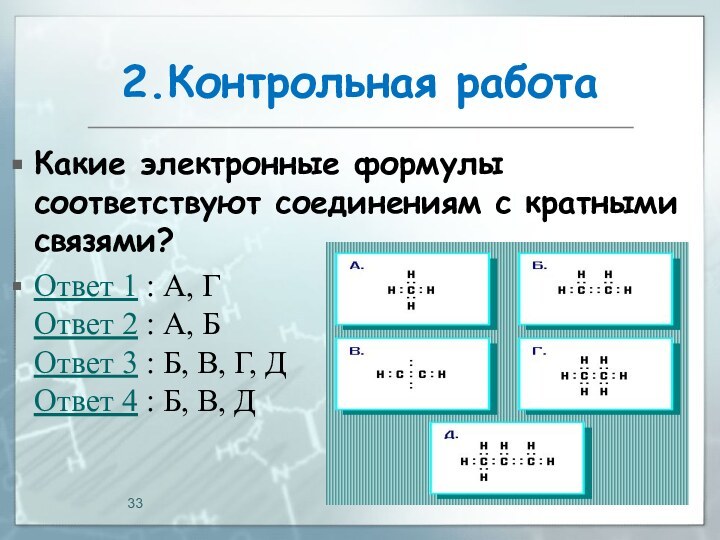






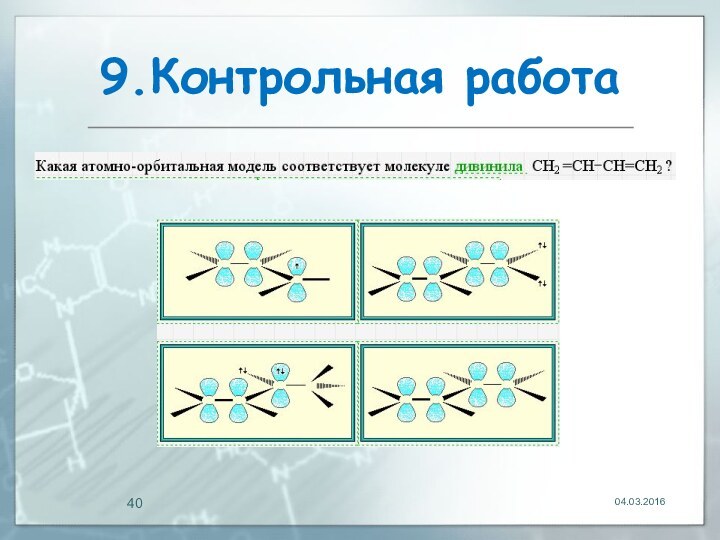
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016
04.03.2016