- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Железо и его свойства
Содержание
- 2. Химический элементХимический элемент VIII гр. Периодической системы
- 3. ФактыВ земной коре железо распространено достаточно широко.
- 4. Нахождение железа в соединенияхFeМагнитный железняк - магнетит (Fe3O4)Красный железняк - гематит (Fe2O3)Бурый железняк - лимонит (FeOOH)
- 5. Железо в организме человекаЖелезо содержится в крови
- 6. В растенияхТакже, железо влияет на процесс фотосинтеза.
- 7. В бытуИз железа изготавливают различные изделия, виды транспорта, а также бытовую технику.
- 8. В военной промышленностиИз железа делают всевозможную амуницию, обмундирование и технику военнослужащих.
- 9. Железо в истории В истории железо
- 10. Физические свойстваЖелезо - сравнительно мягкий ковкий серебристо-серый
- 11. Химические свойстваЖелезо, отдавая два внешних электрона, проявляет
- 12. Окисление железаПри хранении водных растворов солей железа(II)
- 13. Скачать презентацию
- 14. Похожие презентации
Химический элементХимический элемент VIII гр. Периодической системы Д.И. Менделеева. Атомный номер 26Атомная масса 55.847











Слайд 3
Факты
В земной коре железо распространено достаточно широко.
На его долю приходится около 4,1%
массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. По запасам железных руд Россия занимает первое место в мире.
Слайд 4
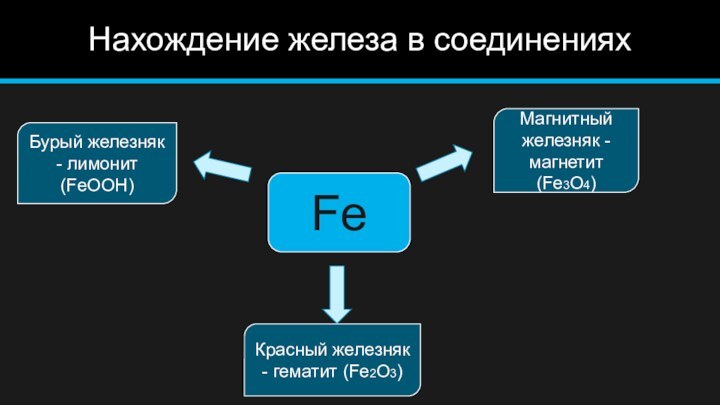
Нахождение железа в соединениях
Fe
Магнитный железняк - магнетит (Fe3O4)
Красный
железняк - гематит (Fe2O3)
Бурый железняк - лимонит (FeOOH)
Слайд 5
Железо в организме человека
Железо содержится в крови –
гемоглобине, а именно в красных кровяных тельцах – эритроцитах.
Слайд 8
В военной промышленности
Из железа делают всевозможную амуницию, обмундирование
и технику военнослужащих.
Слайд 9
Железо в истории
В истории железо известно
очень давно. из него изготовляли многое. Например доспехи, латы,
оружие и т. д.
Слайд 10
Физические свойства
Железо - сравнительно мягкий ковкий серебристо-серый металл.
Температура плавления – 1535 °С.
Температура кипения около 2800 °С.
При
температуре ниже 770 °С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит).Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается».
Слайд 11
Химические свойства
Железо, отдавая два внешних электрона, проявляет степень
окисления +2
(Fe-2e=Fe+2);
Отдавая три электрона, проявляет степень окисления
+3 (Fe-3e=Fe+3).
Слайд 12
Окисление железа
При хранении водных растворов солей железа(II) наблюдается
окисление железа(II) до железа(III):
4FeCl2 +
O2 + 2H2O = 4Fe(OH)Cl2 8.Соединения железа (III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 = 3FeCl2