Слайд 2
Факторы патогенности
Факторы патогенности – это молекулы или структуры
микроорганизмов, наличие которых обеспечивает протекание инфекционного процесса.
Вирулентность конкретного штамма
микроорганизмов обеспечивается набором присутствующих у него факторов патогенности.
Синтез факторов патогенности может кодироваться как собственно геномом бактерий, так и присутствующими в клетках плазмидами или интегрированными бактериофагами.
Слайд 3
Классификация
Общепринятой классификации факторов патогенности бактерий не существует.
Можно
условно выделить следующие группы:
Факторы адгезии
Факторы инвазии, агрессии и добычи
питательных веществ
Антифагоцитарные факторы
Токсины
Инъецируемые эффекторные белки
Слайд 5
Бактериальная адгезия
В большинстве случаев первым этапом взаимодействия бактериальных
возбудителей с организмом человека является адгезия к эпителию слизистых
оболочек.
Адгезия позволяет противостоять смыванию бактерий со слизистых за счёт перистальтики кишечника, мукоцилиарного транспорта респираторного тракта и. т. д.
Прочной специфической адгезии способствует наличие специализированных белков – адгезинов, которые связываются с белками или углеводными остатками на поверхностях слизистых оболочек.
Слайд 6
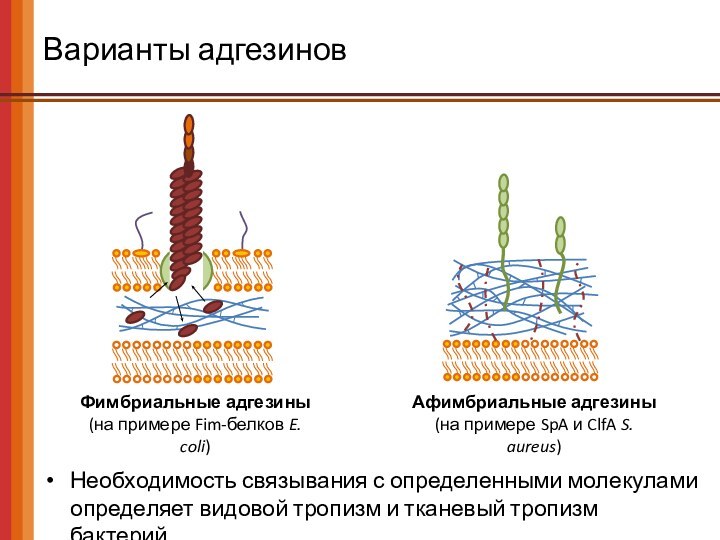
Варианты адгезинов
Необходимость связывания с определенными молекулами определяет видовой
тропизм и тканевый тропизм бактерий.
Фимбриальные адгезины
(на примере Fim-белков E.
coli)
Афимбриальные адгезины
(на примере SpA и ClfA S. aureus)
Слайд 7
Пертактин, филаментозный гемагглютинин (ФГА), и фимбрии на поверхности
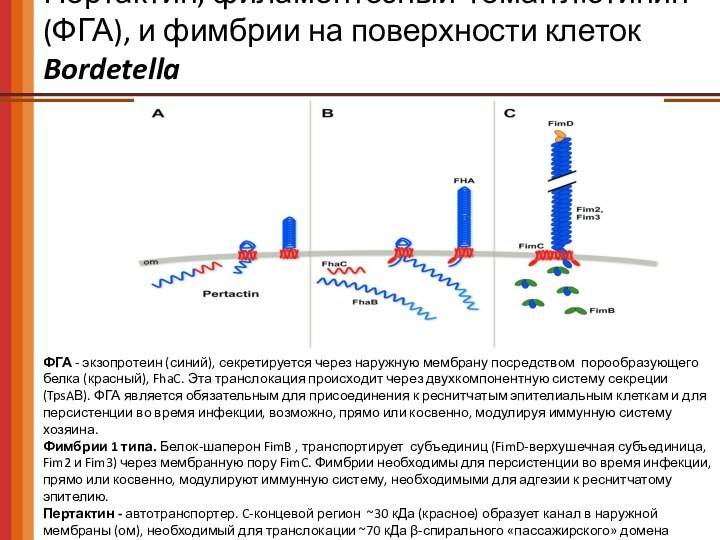
клеток Bordetella
ФГА - экзопротеин (синий), секретируется через наружную мембрану
посредством порообразующего белка (красный), FhaC. Эта транслокация происходит через двухкомпонентную систему секреции (TpsAВ). ФГА является обязательным для присоединения к реснитчатым эпителиальным клеткам и для персистенции во время инфекции, возможно, прямо или косвенно, модулируя иммунную систему хозяина.
Фимбрии 1 типа. Белок-шаперон FimB , транспортирует субъединиц (FimD-верхушечная субъединица, Fim2 и Fim3) через мембранную пору FimC. Фимбрии необходимы для персистенции во время инфекции, прямо или косвенно, модулируют иммунную систему, необходимыми для адгезии к реснитчатому эпителию.
Пертактин - автотранспортер. C-концевой регион ~30 кДа (красное) образует канал в наружной мембраны (ом), необходимый для транслокации ~70 кДа β-спирального «пассажирского» домена (синий) на поверхности клетки. Способствует вирулентности, сопротивляясь нейтрофил-опосредованному клиренсу бактерий.
Слайд 8
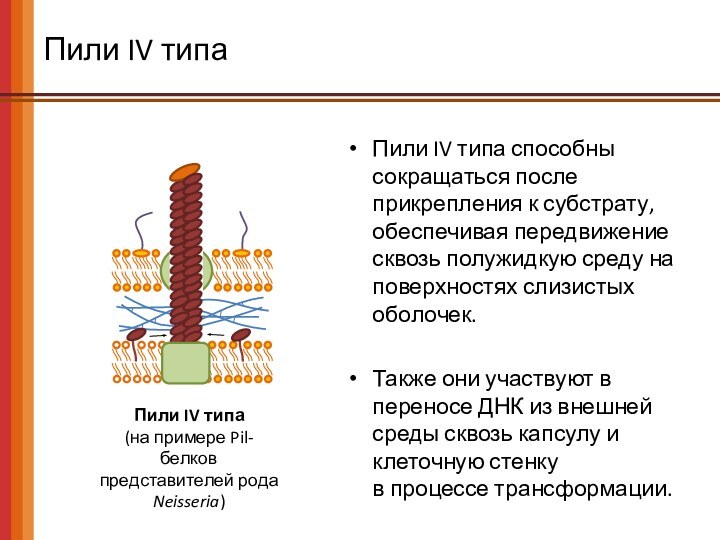
Пили IV типа
Пили IV типа
(на примере Pil-белков
представителей рода
Neisseria)
Пили IV типа способны сокращаться после прикрепления к
субстрату, обеспечивая передвижение сквозь полужидкую среду на поверхностях слизистых оболочек.
Также они участвуют в переносе ДНК из внешней среды сквозь капсулу и клеточную стенку
в процессе трансформации.
Слайд 9
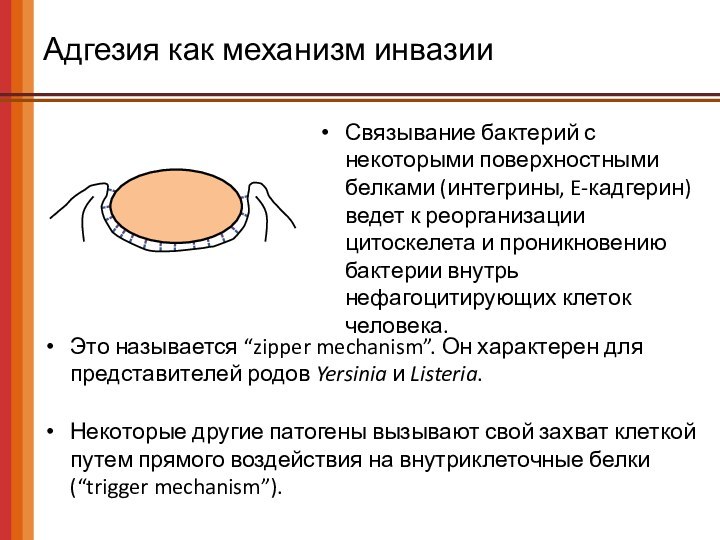
Адгезия как механизм инвазии
Связывание бактерий с некоторыми поверхностными
белками (интегрины, E-кадгерин) ведет к реорганизации цитоскелета и проникновению
бактерии внутрь нефагоцитирующих клеток человека.
Это называется “zipper mechanism”. Он характерен для представителей родов Yersinia и Listeria.
Некоторые другие патогены вызывают свой захват клеткой путем прямого воздействия на внутриклеточные белки
(“trigger mechanism”).
Слайд 10
Часть II:
Факторы инвазии, агрессии и добычи питательных веществ
Слайд 11
Факторы инвазии, агрессии и добычи питательных веществ
Данная группа
факторов преимущественно представлена набором ферментов, которые расщепляют компоненты тканей
человеческого организма. Они выполняют следующие функции:
Распространение бактерий по тканям организма и прорыв в лимфатическую и кровеносную системы;
Подавление естественной резистентности и адаптивного иммунитета;
Обеспечение бактерий питательными веществами для роста и размножения.
Наиболее широко данная группа факторов представлена у возбудителей раневых инфекций.
Слайд 12
Ферменты инвазии
Коллагеназа – расщепление коллагена – основного белкового
компонента соединительной ткани.
Гиалуронидаза – расщепление гиалуроновой кислоты –
основного углеводного компонента соединительной ткани.
Нейраминидаза – отщепление остатков сиаловых кислот от гликопротеидов и ганглиозидов.
ДНКаза – расщепление ДНК, высвобождающейся из разрушенных клеток и служащей механическим барьером для распространения инфекции.
Слайд 13
Ферменты инвазии
Фосфолипазы – расщепление фосфолипидов мембран, приводящее к
гибели клеток. Данные ферменты рассматриваются не только как факторы
инвазии, но и как токсины.
Активаторы плазминогена
(стрептокиназа, стафилокиназа) –
стимулируют расщепление фибрина,
нейтрализуя участие системы
свертывания крови
в сдерживании инфекции.
Активаторы плазминогена применяются в клинической практике для лечения инфаркта миокарда, тромбозов и тромбоэмболий.
Слайд 14
Ферменты инвазии
Уреаза – гидролизует мочевину до аммиака и
углекислого газа.
Это приводит к:
возможности использования аммиака как источника азота;
локальному
защелачиванию среды. В частности, бактерии Helicobacter pylori используют уреазу для выживания в кислой среде желудка.
+ H2O → 2 NH3 + CO2↑
Слайд 15
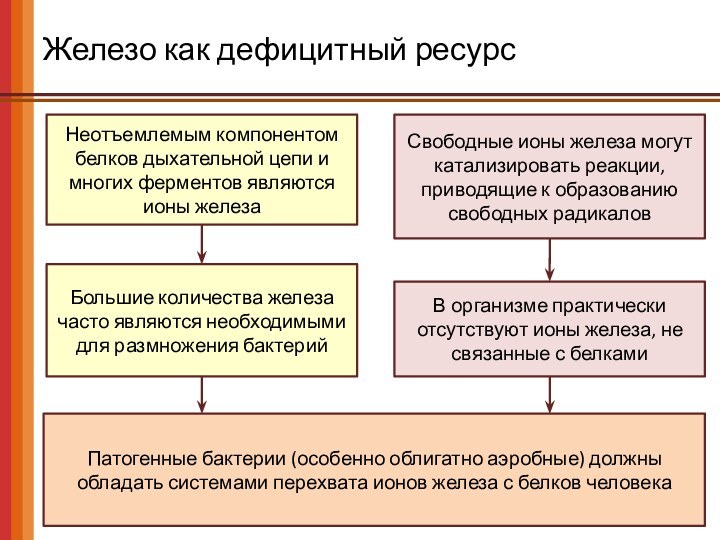
Железо как дефицитный ресурс
Неотъемлемым компонентом белков дыхательной цепи
и многих ферментов являются
ионы железа
Свободные ионы железа могут
катализировать реакции, приводящие к образованию свободных радикалов
Большие количества железа часто являются необходимыми для размножения бактерий
В организме практически отсутствуют ионы железа, не связанные с белками
Патогенные бактерии (особенно облигатно аэробные) должны обладать системами перехвата ионов железа с белков человека
Слайд 16
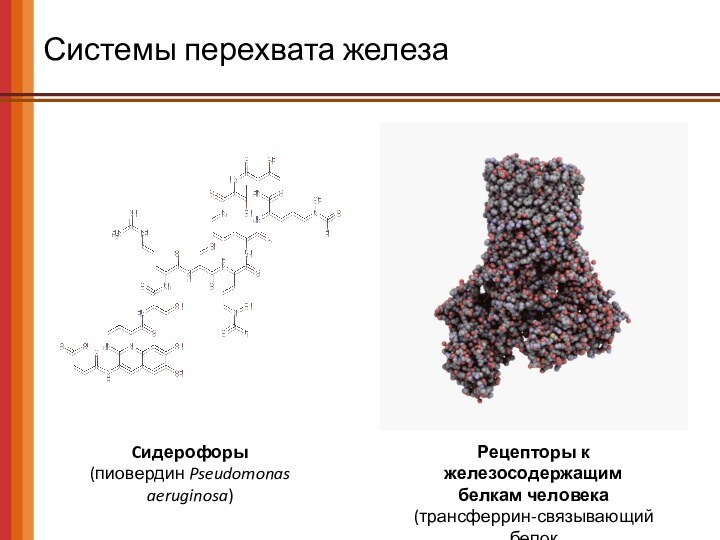
Системы перехвата железа
Cидерофоры
(пиовердин Pseudomonas aeruginosa)
Рецепторы к железосодержащим
белкам
человека
(трансферрин-связывающий белок
Neisseria meningitidis)
Слайд 17
Часть III:
Антифагоцитарные факторы
Слайд 18
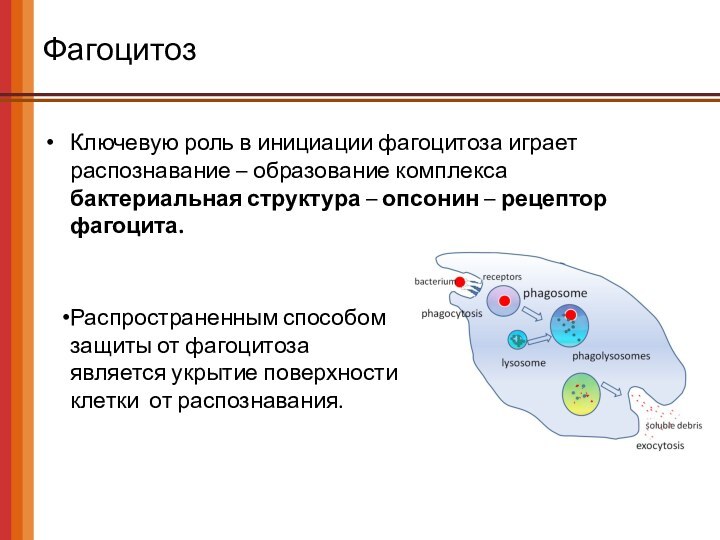
Фагоцитоз
Ключевую роль в инициации фагоцитоза играет распознавание –
образование комплекса
бактериальная структура – опсонин – рецептор фагоцита.
Распространенным способом
защиты от фагоцитоза
является укрытие поверхности
клетки от распознавания.
Слайд 19
Капсулы
Капсулы – наиболее распространенный защитный фактор бактерий. Для
ряда патогенов (например, пневмококков) потеря способности синтезировать капсулу приводит
к полной потере вирулентности.
Основные функции капсулы:
Маскировка поверхностных молекул;
Защита от высыхания;
Депонирование питательных веществ
Часто капсулы являются иммуногенными - против них вырабатываются антитела. Однако существют и неиммуногенные капсулы, которые состоят из веществ, не чужеродных для человеческого организма.
Слайд 20
Химическое строение капсул
Как правило, капсулы состоят из полисахаридов
или, реже, полипептидов.
У многих бактерий капсулы имеют сложный состав,
отличающийся у различных штаммов внутри вида (Например, полисахаридные капсулы Streptococcus pneumoniae).
Слайд 21
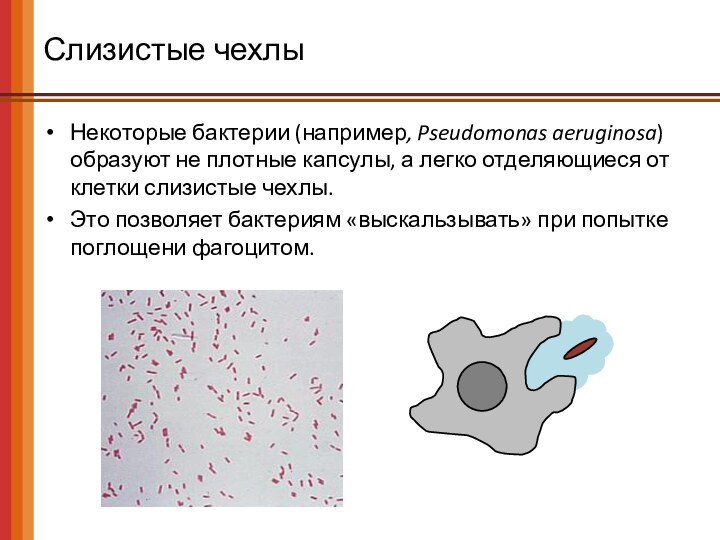
Слизистые чехлы
Некоторые бактерии (например, Pseudomonas aeruginosa) образуют не
плотные капсулы, а легко отделяющиеся от клетки слизистые чехлы.
Это
позволяет бактериям «выскальзывать» при попытке поглощени фагоцитом.
Слайд 22
Укрытие белками организма
Плазмокоагулаза Staphylococcus aureus – переводит фибриноген
плазмы крови в нерастворимый фибрин, образуя подобие микротромба вокруг
поверхности клетки.
Белок M Streptococcus pyogenes –
связывает фибриноген, фактор H,
альбумин и другие белки человека,
образуя из них защитный слой
вокруг бактериальной клетки.
Слайд 23
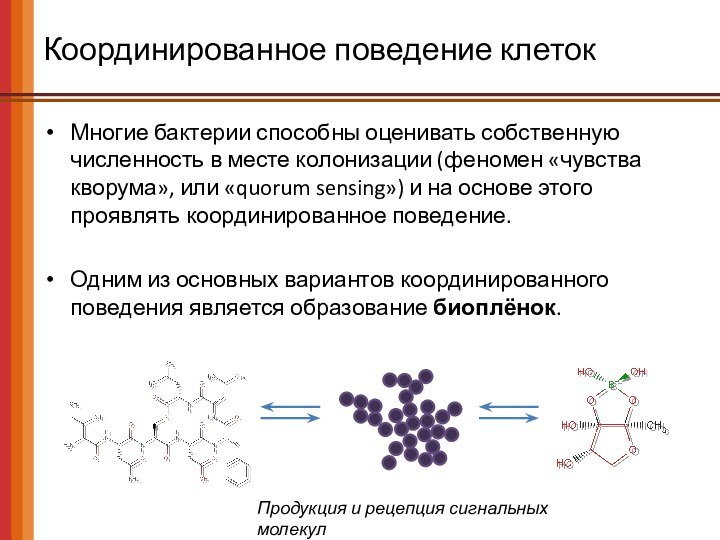
Многие бактерии способны оценивать собственную численность в месте
колонизации (феномен «чувства кворума», или «quorum sensing») и на
основе этого проявлять координированное поведение.
Одним из основных вариантов координированного поведения является образование биоплёнок.
Координированное поведение клеток
Продукция и рецепция сигнальных молекул
Слайд 24
Биоплёнки
Биопленки представляют собой сплошные слои из бактериальных клеток
и скрепляющего из каркаса из полисахаридов, белков и ДНК.
В
норме биопленки в организме человека существуют на поверхности зубов и слизистой толстого кишечника.
В ходе патологических процессов они могут образовываться на сердечных клапанах, инородных телах, в респираторном тракте.
Слайд 25
Биоплёнки как фактор патогенности
Защита от фагоцитоза
Устойчивость к антисептикам
и дезинфектантам
Устойчивость к антибиотикам
Высокая частота горизонтального переноса генов.
Слайд 26
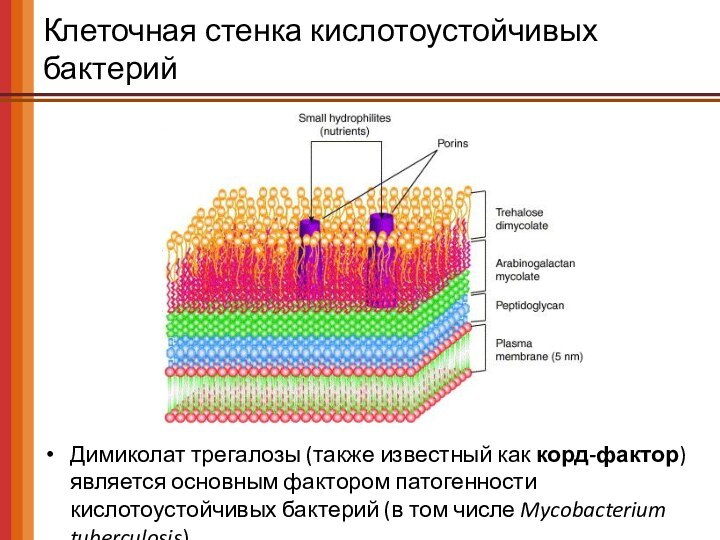
Клеточная стенка кислотоустойчивых бактерий
Димиколат трегалозы (также известный как
корд-фактор) является основным фактором патогенности кислотоустойчивых бактерий (в том
числе Mycobacterium tuberculosis)
Слайд 27
Корд-фактор
Толстый гидрофобный слой, создаваемый корд-фактором, обеспечивает защиту от
многих антибактериальных веществ.
Корд-фактор способен встраиваться в мембраны фагосом, блокируя
их слияние с лизосомами – происходит незавершенный фагоцитоз, в результате которого бактерии могут выживать и размножаться внутри макрофагов.
Также корд-фактор связывается со специфическим рецептором Mincle, что приводит к активации системы врожденного иммунитета и запуску специфического пролиферативного воспаления.
Слайд 29
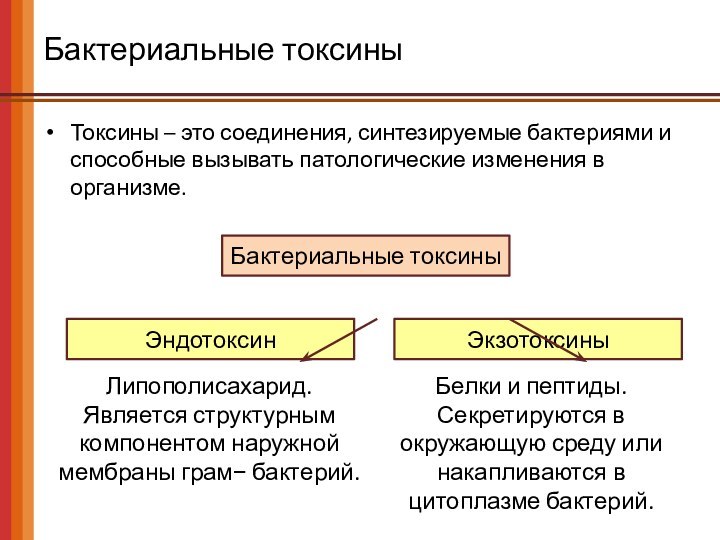
Бактериальные токсины
Токсины – это соединения, синтезируемые бактериями и
способные вызывать патологические изменения в организме.
Бактериальные токсины
Эндотоксин
Экзотоксины
Липополисахарид.
Является структурным компонентом
наружной мембраны грам− бактерий.
Белки и пептиды.
Секретируются в окружающую среду или накапливаются в цитоплазме бактерий.
Слайд 30
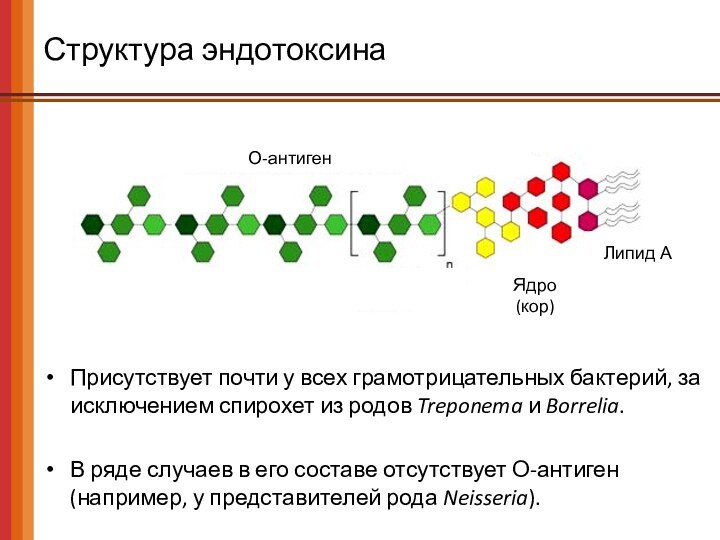
Структура эндотоксина
О-антиген
Ядро
(кор)
Липид А
Присутствует почти у всех грамотрицательных бактерий,
за исключением спирохет из родов Treponema и Borrelia.
В
ряде случаев в его составе отсутствует О-антиген
(например, у представителей рода Neisseria).
Слайд 31
Механизм действия эндотоксина
Эндотоксин не является токсином в эволюционном
смысле.
Его действие обусловлено связыванием липида А
с Toll-like рецепторами,
что приводит к активации системы врожденного иммунитета и запуску воспалительной реакции.
При системном действии эндотоксин приводит к повышению температуры, синтезу белков острой фазы и снижению артериального давления. Попадание большого количества экзотоксина в кровоток может привести к смерти от дисрегуляции гемодинамики.
Слайд 32
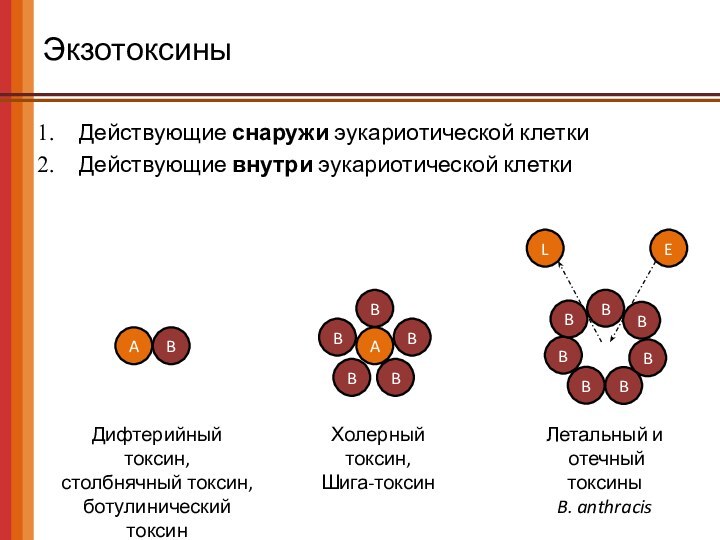
Экзотоксины
Действующие снаружи эукариотической клетки
Действующие внутри эукариотической клетки
Токсины, проникающие
внутрь клетки, как правило, имеют бинарную (AB) структуру:
A-субъединицы (active)
обладает токсической ферментативной активностью;
B-субъединицы (bindnig) обеспечивают связывание с клеткой и проникновение А-субъединиц внутрь.
Слайд 33
Экзотоксины
Действующие снаружи эукариотической клетки
Действующие внутри эукариотической клетки
A
B
A
B
B
B
B
B
Дифтерийный токсин,
столбнячный
токсин,
ботулинический токсин
Холерный токсин,
Шига-токсин
Летальный и
отечный токсины
B. anthracis
L
E
B
B
B
B
B
B
B
Слайд 34
Виды экзотоксинов
Большинство бактериальных токсинов можно отнести к одной
из нескольких групп:
Мембранотоксины
Цитотоксины
Нейротоксины
Токсины, нарушающие
внутриклеточную
передачу сигнала
Суперантигены
Слайд 35
Мембранотоксины
Мембранотоксины – это белки, нарушающие целостность мембран эукариотических
клеток, что приводит к их гибели.
Это самая широко
распространенная
группа токсинов.
Мембранотоксины, способные
разрушать эритроциты,
образуют вокруг колонии
бактерий на кровяном агаре
зону β-гемолиза. Такие токсины
называются гемолизины.
Слайд 36
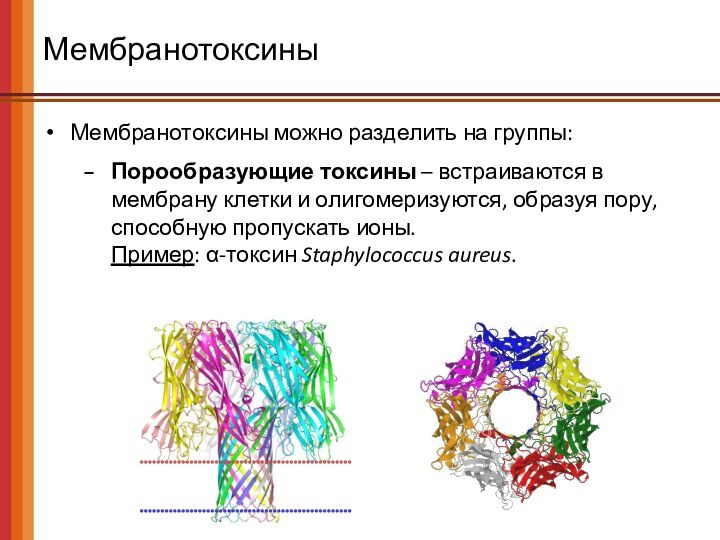
Мембранотоксины
Мембранотоксины можно разделить на группы:
Порообразующие токсины – встраиваются
в мембрану клетки и олигомеризуются, образуя пору, способную пропускать
ионы.
Пример: α-токсин Staphylococcus aureus.
Слайд 37
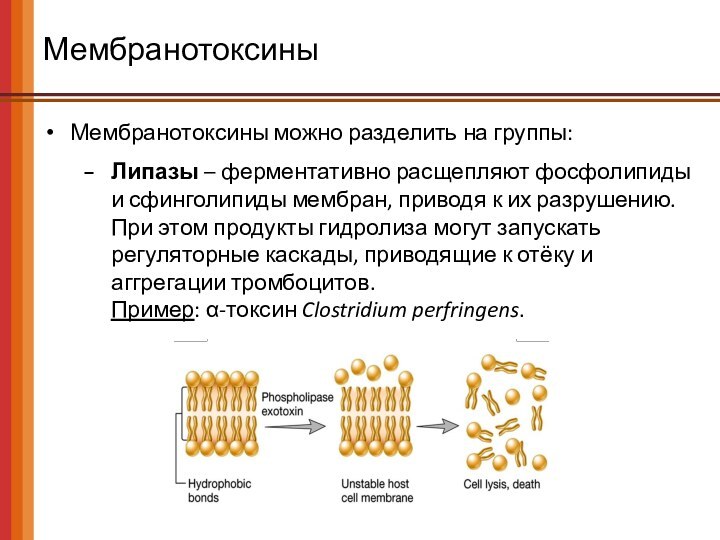
Мембранотоксины
Мембранотоксины можно разделить на группы:
Липазы – ферментативно расщепляют
фосфолипиды и сфинголипиды мембран, приводя к их разрушению. При
этом продукты гидролиза могут запускать регуляторные каскады, приводящие к отёку и аггрегации тромбоцитов.
Пример: α-токсин Clostridium perfringens.
Слайд 38
Цитотоксины
Цитотоксины – это токсины, подавляющие жизненно важные процессы
в клетках эукариот. Они приводят к нарушению выполнения клетками
их функции, к некробиотическим процессам и в конечном счёте к их гибели.
Примеры:
Цитолетальный токсин может продуцироваться
Escherichia coli, Salmonella enterica, Shigella dysenteriae, Campylobacter jejuni и некоторыми другими бактериями.
Данный токсин является ДНКазой: проникая в ядра эукариотических клеток, он ферментативно расщепляет молекулы ДНК (что ведет к остановке клеточного цикла и апоптозу).
Слайд 39
EFII
EFII
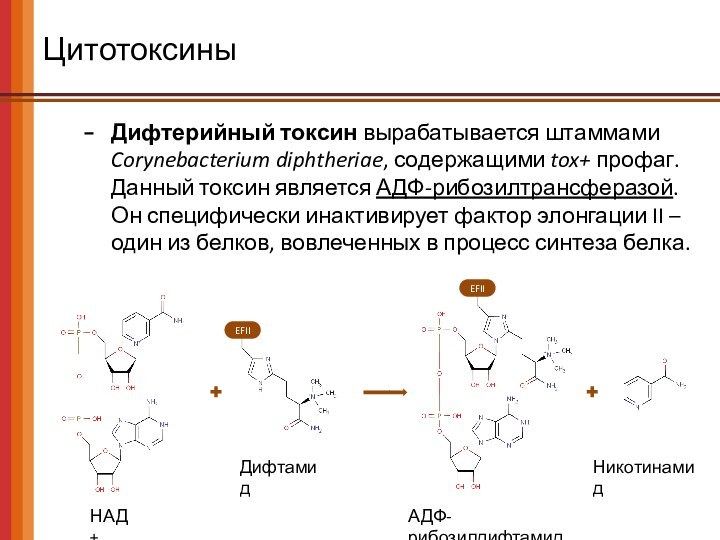
Цитотоксины
Дифтерийный токсин вырабатывается штаммами Corynebacterium diphtheriae, содержащими tox+
профаг.
Данный токсин является АДФ-рибозилтрансферазой.
Он специфически инактивирует фактор
элонгации II – один из белков, вовлеченных в процесс синтеза белка.
НАД+
Дифтамид
АДФ-рибозилдифтамид
Никотинамид
Слайд 40
Цитотоксины
Шига-токсин вырабатывается
Shigella dysenteriae,
Шига-подобные токсины
вырабатываются
энтерогеморрагическими
Escherichia
coli.
Данная группа токсинов является N-гликозидазами: они отщепляют остаток аденина
в специфической позиции 28s рРНК (что приводит к остановке синтеза белка), а также могут отщеплять остатки аденина в молекулах ДНК (что ведет к остановке клеточного цикла и апоптозу).
Слайд 41
Нейротоксины
Группа бактериальных белковых нейротоксинов включает в себя всего
два представителя:
Столбнячный токсин Clostridium tetani;
Ботулинический токсин Clostridium botulinum.
Это сильнейшие
из известных токсинов:
летальная доза (LD50) ≈ 1 нг/кг веса.
Механизм действия данных токсинов –
блокирование выброса нейромедиаторов
в синаптическую щель.
Слайд 42
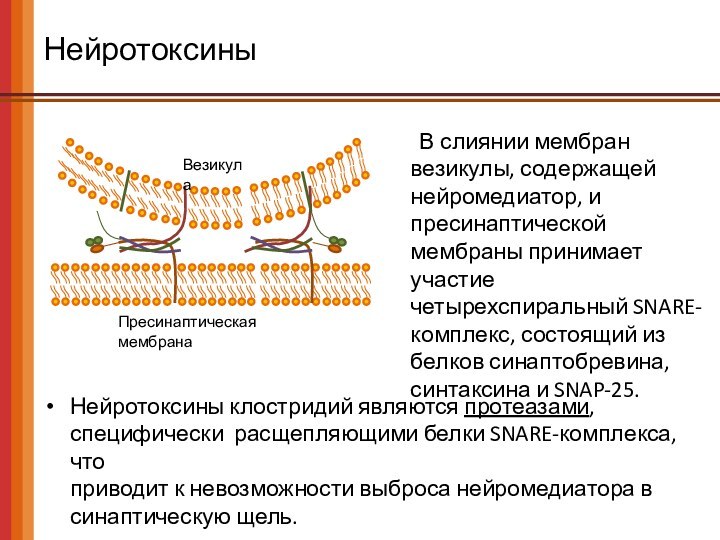
Нейротоксины
Пресинаптическая мембрана
Везикула
Нейротоксины клостридий являются протеазами, специфически расщепляющими белки
SNARE-комплекса, что
приводит к невозможности выброса нейромедиатора в синаптическую
щель.
В слиянии мембран везикулы, содержащей нейромедиатор, и пресинаптической мембраны принимает участие четырехспиральный SNARE-комплекс, состоящий из белков синаптобревина, синтаксина и SNAP-25.
Слайд 43
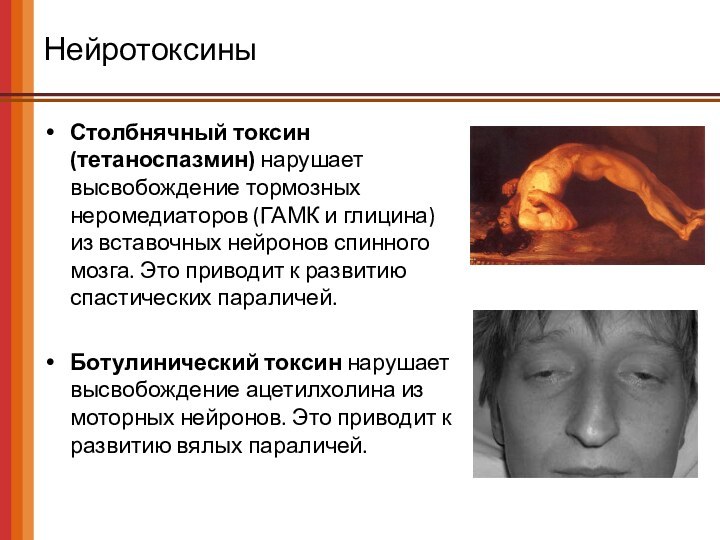
Нейротоксины
Столбнячный токсин (тетаноспазмин) нарушает высвобождение тормозных неромедиаторов (ГАМК
и глицина) из вставочных нейронов спинного мозга. Это приводит
к развитию спастических параличей.
Ботулинический токсин нарушает высвобождение ацетилхолина из моторных нейронов. Это приводит к развитию вялых параличей.
Слайд 44
Нейротоксины
Столбнячный токсин (тетаноспазмин) нарушает высвобождение тормозных неромедиаторов (ГАМК
и глицина) из вставочных нейронов спинного мозга. Это приводит
к развитию спастических параличей.
Ботулинический токсин нарушает высвобождение ацетилхолина из моторных нейронов. Это приводит к развитию вялых параличей.
Использование
в косметологических
и лечебных целях
Слайд 45
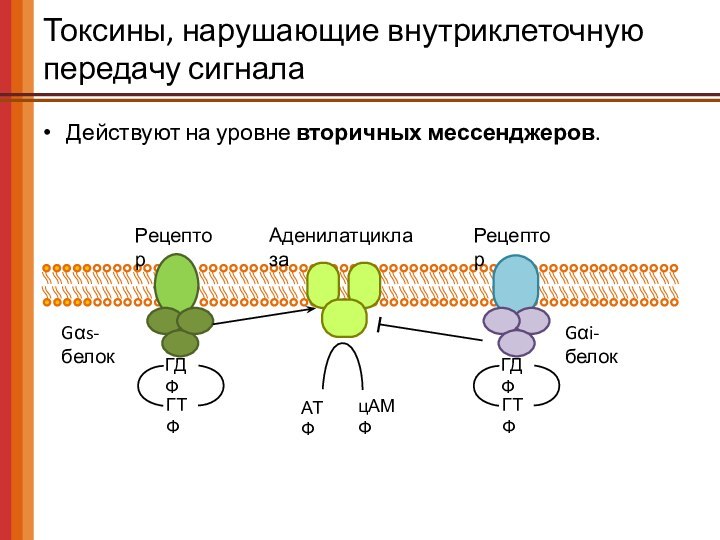
Токсины, нарушающие внутриклеточную передачу сигнала
Действуют на уровне вторичных
мессенджеров.
Рецептор
Gαs-белок
АТФ
цАМФ
Аденилатциклаза
Рецептор
Gαi-белок
ГДФ
ГТФ
ГДФ
ГТФ
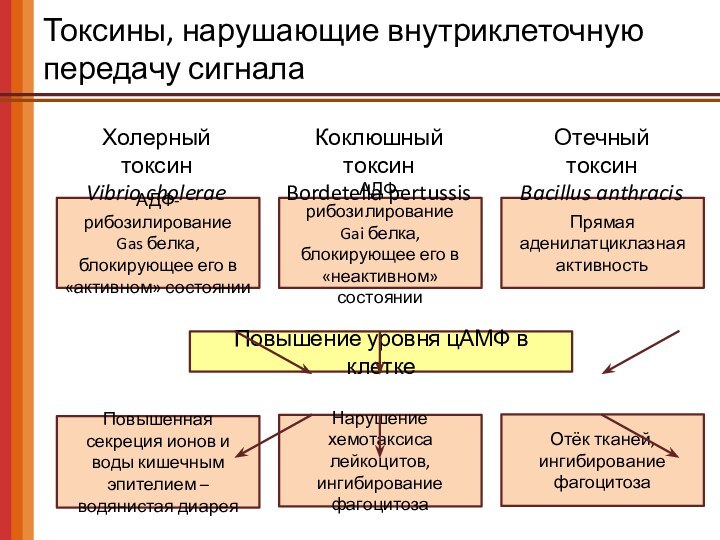
Слайд 46
Токсины, нарушающие внутриклеточную передачу сигнала
АДФ-рибозилирование
Gas белка, блокирующее его
в «активном» состоянии
Повышение уровня цАМФ в клетке
АДФ-рибозилирование
Gai белка, блокирующее
его в «неактивном» состоянии
Прямая аденилатциклазная активность
Нарушение хемотаксиса лейкоцитов, ингибирование фагоцитоза
Отёк тканей,
ингибирование фагоцитоза
Повышенная секреция ионов и воды кишечным эпителием – водянистая диарея
Холерный токсин
Vibrio cholerae
Коклюшный токсин
Bordetella pertussis
Отечный токсин
Bacillus anthracis
Слайд 47
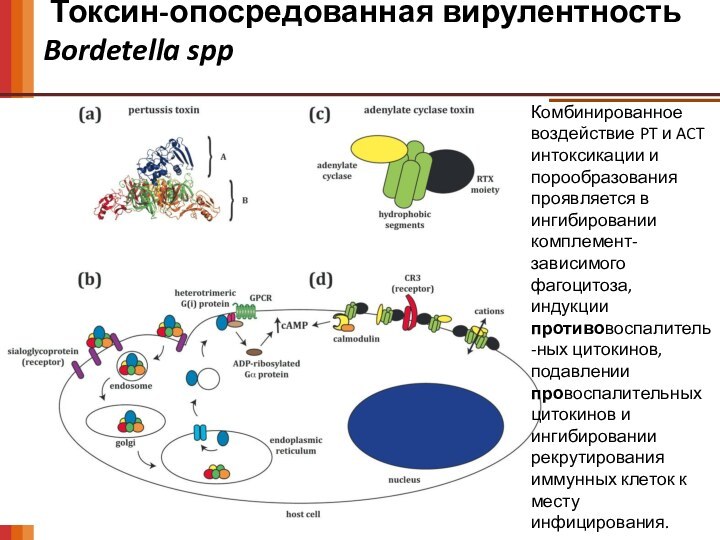
Токсин-опосредованная вирулентность
Bordetella spp
Комбинированное воздействие PT и
ACT интоксикации и порообразования проявляется в ингибировании комплемент-зависимого фагоцитоза,
индукции противовоспалитель-ных цитокинов, подавлении провоспалительных цитокинов и ингибировании рекрутирования иммунных клеток к месту инфицирования.
Слайд 48
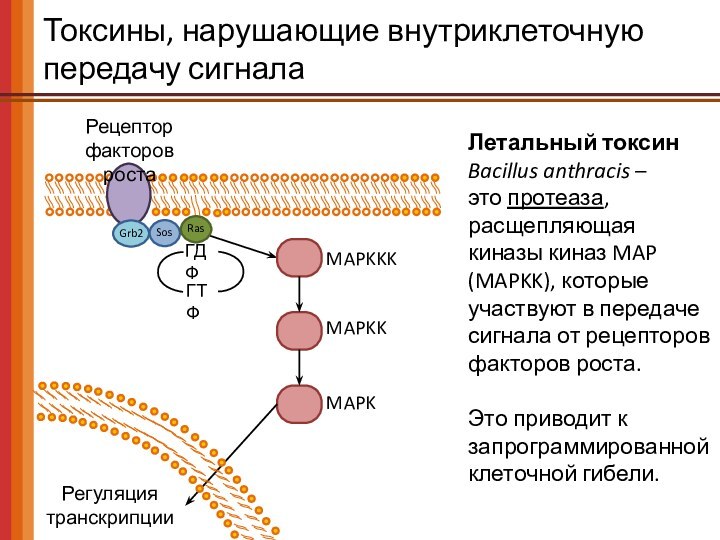
Токсины, нарушающие внутриклеточную передачу сигнала
Рецептор
факторов роста
ГДФ
ГТФ
Ras
Grb2
Sos
MAPKKK
MAPKK
MAPK
Регуляция
транскрипции
Летальный
токсин
Bacillus anthracis –
это протеаза,
расщепляющая
киназы киназ MAP (MAPKK), которые
участвуют в передаче сигнала от рецепторов факторов роста.
Это приводит к
запрограммированной клеточной гибели.
Слайд 49
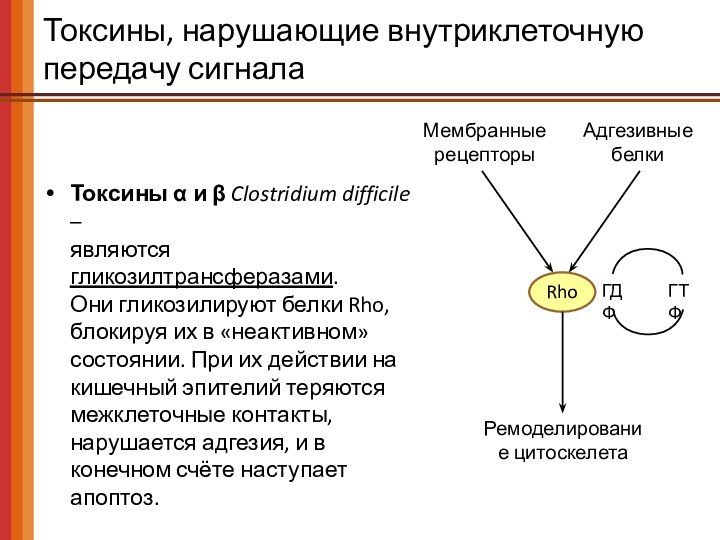
Токсины, нарушающие внутриклеточную передачу сигнала
Токсины α и β
Clostridium difficile –
являются гликозилтрансферазами.
Они гликозилируют белки Rho, блокируя
их в «неактивном» состоянии. При их действии на кишечный эпителий теряются межклеточные контакты, нарушается адгезия, и в конечном счёте наступает апоптоз.
Мембранные рецепторы
Адгезивные белки
ГДФ
ГТФ
Rho
Ремоделирование цитоскелета
Слайд 50
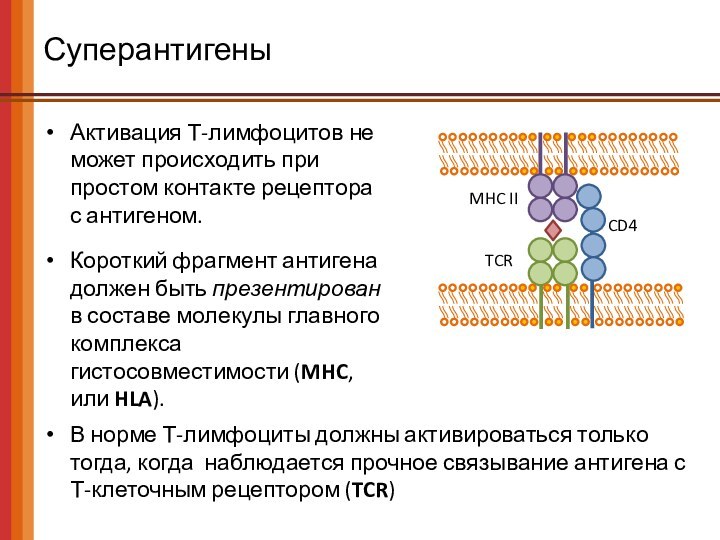
Суперантигены
Активация Т-лимфоцитов не может происходить при простом контакте
рецептора с антигеном.
Короткий фрагмент антигена должен быть презентирован
в составе молекулы главного комплекса гистосовместимости (MHC, или HLA).
TCR
MHC II
CD4
В норме Т-лимфоциты должны активироваться только тогда, когда наблюдается прочное связывание антигена с Т-клеточным рецептором (TCR)
Слайд 51
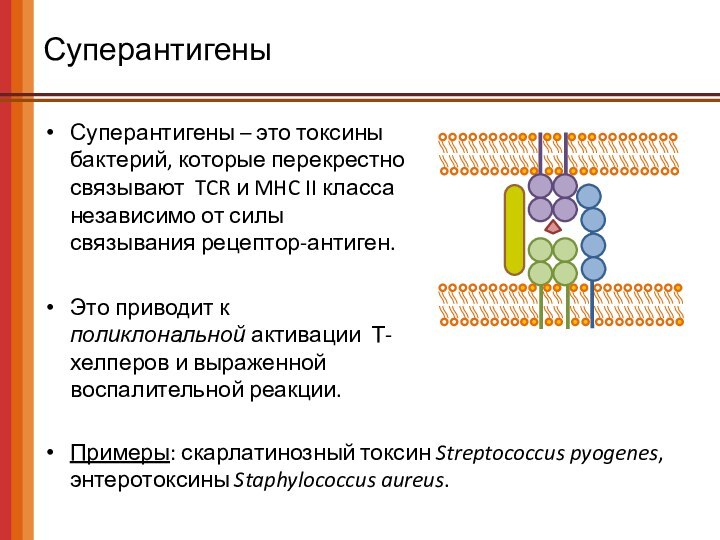
Суперантигены
Суперантигены – это токсины бактерий, которые перекрестно связывают
TCR и MHC II класса независимо от силы связывания
рецептор-антиген.
Это приводит к поликлональной активации Т-хелперов и выраженной воспалительной реакции.
Примеры: скарлатинозный токсин Streptococcus pyogenes,
энтеротоксины Staphylococcus aureus.
Слайд 52
Часть V:
Инъецируемые эффекторные белки
Слайд 53
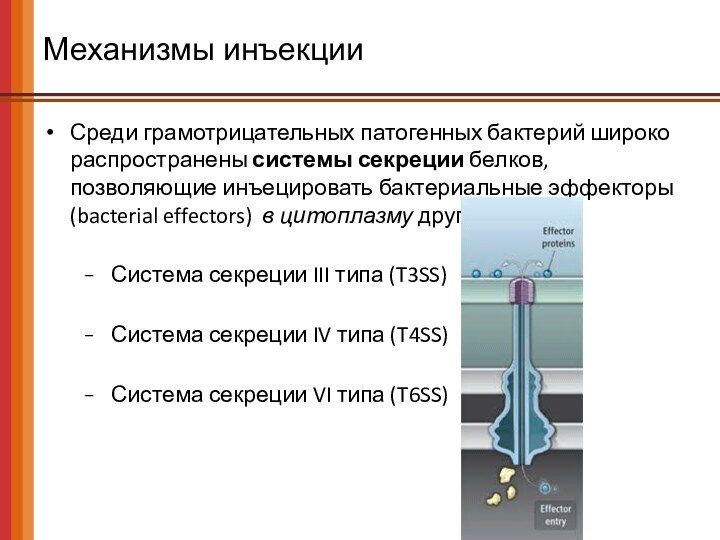
Механизмы инъекции
Среди грамотрицательных патогенных бактерий широко распространены системы
секреции белков, позволяющие инъецировать бактериальные эффекторы (bacterial effectors) в
цитоплазму других клеток:
Система секреции III типа (T3SS)
Система секреции IV типа (T4SS)
Система секреции VI типа (T6SS)
Слайд 54
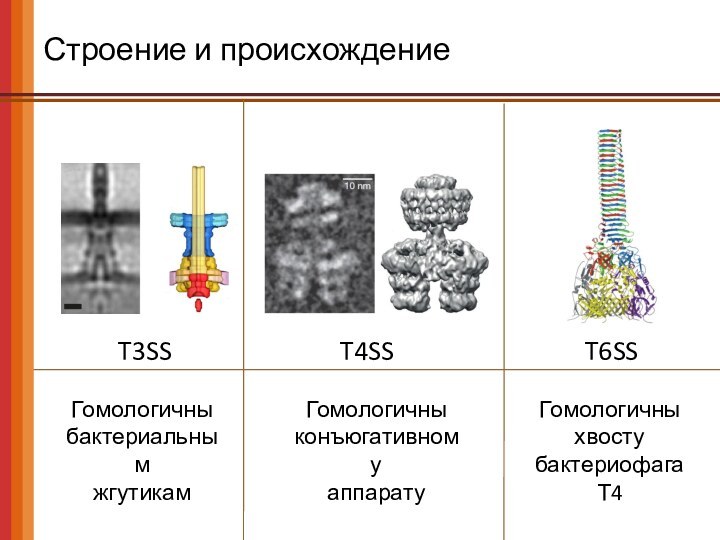
Строение и происхождение
T3SS
T4SS
T6SS
Гомологичны
бактериальным
жгутикам
Гомологичны
конъюгативному
аппарату
Гомологичны
хвосту бактериофага Т4
Слайд 55
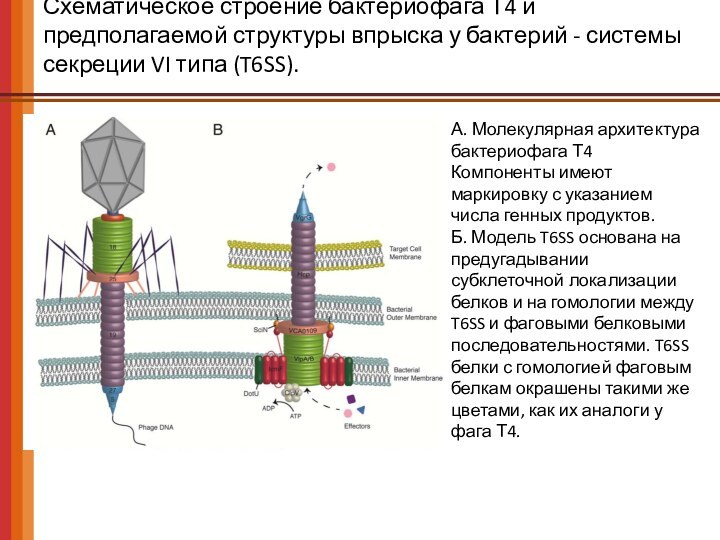
Схематическое строение бактериофага Т4 и предполагаемой структуры впрыска
у бактерий - системы секреции VI типа (T6SS).
А.
Молекулярная архитектура бактериофага Т4
Компоненты имеют маркировку с указанием числа генных продуктов.
Б. Модель T6SS основана на предугадывании субклеточной локализации белков и на гомологии между T6SS и фаговыми белковыми последовательностями. T6SS белки с гомологией фаговым белкам окрашены такими же цветами, как их аналоги у фага Т4.
Слайд 56
Бактериальные эффекторы
Бактерии чаще всего невыгодно уничтожать клетку, на
которой она адгезирована.
Бактериальные эффекторы обычно действуют на уровне внутриклеточной
передачи сигнала, изменяя поведение клетки. При этом они могут выступать как протеазы, киназы, фосфатазы, убиквитин-лигазы, АДФ-рибозилтрансферазы и. т. д.
Как правило, одна бактериальная клетка инъецирует сразу десятки эффекторов, обеспечивая сложные эффекты.
Слайд 57
Распространенные эффекты
Самые распространенные действия
бактериальных эффекторов:
Захват бактерий
нефагоцитирующими
клетками
с использованием
“trigger mechanism”.
Ингибирование фагоцитоза на стадиях
захвата бактерий или
внутриклеточного переваривания.
Ингибирование или стимулирование апоптоза в зависимости от необходимости остаться в клетке
или покинуть её.
Ингибирование синтеза провоспалительных цитокинов.
Слайд 58
Участие в адгезии:
энтеропатогенные Escherichia coli
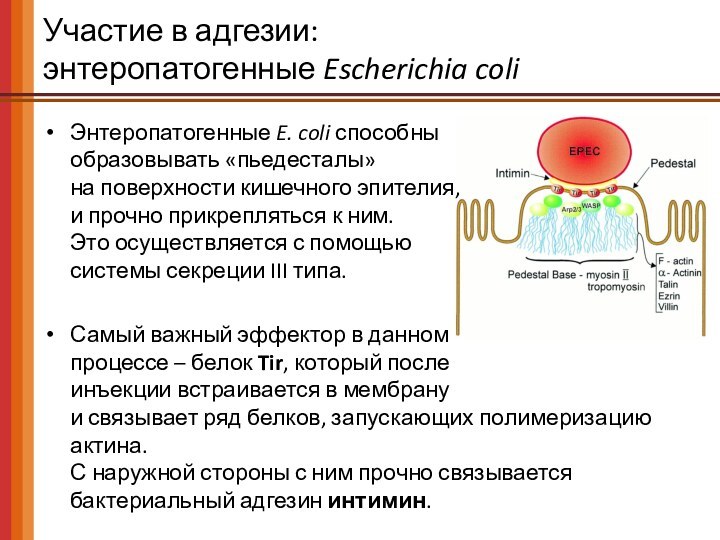
Энтеропатогенные E. coli
способны
образовывать «пьедесталы»
на поверхности кишечного эпителия,
и прочно прикрепляться к
ним.
Это осуществляется с помощью
системы секреции III типа.
Самый важный эффектор в данном
процессе – белок Tir, который после
инъекции встраивается в мембрану
и связывает ряд белков, запускающих полимеризацию актина.
С наружной стороны с ним прочно связывается бактериальный адгезин интимин.
Слайд 59
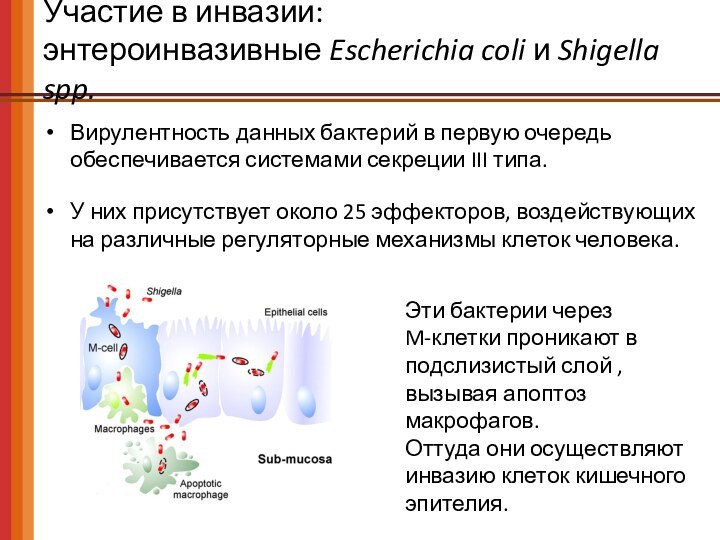
Участие в инвазии:
энтероинвазивные Escherichia coli и Shigella spp.
Вирулентность данных бактерий в первую очередь обеспечивается системами секреции
III типа.
У них присутствует около 25 эффекторов, воздействующих на различные регуляторные механизмы клеток человека.
Эти бактерии через
M-клетки проникают в подслизистый слой , вызывая апоптоз макрофагов.
Оттуда они осуществляют инвазию клеток кишечного эпителия.
Слайд 60
Участие в процессе выживания в макрофагах:
Legionella pneumophila
Данные бактерии
способны
синтезировать около 300 эффекторов,
доставляемых в клетки с
помощью
системы секреции IV типа.
После фагоцитоза легионелл не
происходит слияния лизосомы с
фагосомой. Вместо этого с фагосомой сливаются везикулы эндоплазматического ретикулума (образуется легионелла-содержащая вакуоль, LCV). Усиление протеолиза в клетке приводит к увеличению содержания свободных аминокислот, служащих питанием для легионелл. Ингибирование апоптоза позволяет бактериям длительное время размножаться в макрофагах.