Слайд 2
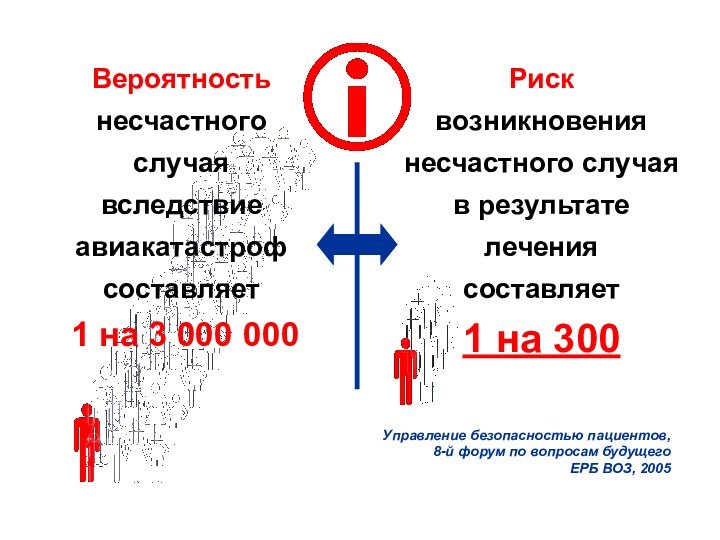
Риск
возникновения несчастного случая в результате лечения
составляет
1 на 300
Управление безопасностью пациентов,
8-й форум по вопросам
будущего
ЕРБ ВОЗ, 2005
Вероятность несчастного случая вследствие авиакатастроф составляет
1 на 3 000 000
Слайд 3
В 2000 году
каждый десятый пациент европейских больниц
пострадал от нежелательных эффектов лечения
Рабочая группа по качеству медицинской
помощи «Больницы Европы»
Слайд 5
Национальная служба здравоохранения Великобритании провела более 30 расследований
в связи с катастрофическими последствиями оказания медицинской помощи.
Во всех
случаях были выявлены системные недостатки в организации медицинской помощи
Brit. Med. J., 2002, 325: 895
Слайд 6
Публикация Института медицины США «Ошибаться - в природе
человека: построение более безопасной системы здравоохранения»
сделала проблему безопасности больных
предметом политического обсуждения и публичных дискуссий во всём мире.
Kohn L.T. et al., To err is human: Building a safer health system. 1999, Institute of Medicine, National Academy Press
Слайд 7
55-я сессия Всемирной ассамблеи здравоохранения (2002 г.) приняла
резолюцию, обязывающую страны уделять пристальное внимание вопросам безопасности пациентов
и укреплять системы безопасности
и мониторинга
Слайд 8
Неблагоприятные побочные явления (НПЯ)
на лекарства и их
сочетания
Медицинские ошибки
Некачественная, фальсифицированная
и бракованная продукция
Риск, связанный с использованием
медицинской техники
Скрытые недостатки системы здравоохранения, включая ее организацию
Факторы, влияющие на безопасность больных
Слайд 9
Если принять во внимание все типы медицинских ошибок
(МО), то в условиях стационара на каждого больного может
приходиться более одной МО
каждый день
Institute of Medicine of the National Academies USA, 2006
Слайд 10
Медицина является историей человеческих ошибок …
Немецкий микробиолог
Мух
Слайд 11
Людям свойственно ошибаться.
Однако утаивать ошибки или не учиться
на них –
непростительно!
Слайд 12
Министерство здравоохранения Великобритании
в докладе 2000 года, озаглавленном
«Организация, обладающая памятью», приводит данные,
в соответствие с которыми:
нежелательные реакции в результате лекарственной терапии возникают примерно у 10% стационарных больных,
общее число НПР достигает 850 000 случаев в год.
Dept. of Health. Report of an expert group
on learning from adverse events in the NHS, 2000
Слайд 13
Статистика НПР
Ежегодно четверть миллиона жителей Великобритании поступает в
стационары с неблагоприятными побочными реакциями (НПР) на лекарства
Финансовые издержки,
связанные с НПР, составляют приблизительно 0,5 млрд. фунтов стерлингов
Около 2% больных, поступивших в стационар с НПР, умирают
Reuters Health Information, May 11, 2006
Слайд 14
Финансовые затраты, связанные
с НПР на лекарства
Дополнительные
дни пребывания в стационаре
в Великобритании обходятся
приблизительно в
2000 млн. фунтов стерлингов ежегодно
Выплата компенсаций по судебным искам – еще
в 400 млн. фунтов стерлингов в год
В США общенациональные издержки, связанные
с НПР, включая выплаты по инвалидности и
медицинские расходы, по разным оценкам,
составляют 70 000-140 000 млн. долларов в год
Слайд 15
Гарвардское исследование показало, что
у 4% стационарных
больных возникают различного рода лекарственные осложнения;
в 14% случаев
эти осложнения заканчиваются летальным исходом.
Harvard Medical Practice Study, 1991
Слайд 16
Типичное заблуждение как медицинских работников, так и населения
«Разрешенные к применению в широкой медицинской практике лекарственные средства
хорошо изучены, что гарантирует их эффективность и безопасность»
Слайд 17
Факторы, лимитирующие возможности клинических испытаний
Ограниченное число больных
Селективная
группа больных (жёсткие критерии включения в клинические испытания). Как
правило, исключаются дети, пожилые больные, беременные, больные с сопутствующими заболеваниями и т.д.
Ограничение применения других лекарственных средств
Селективные дозы препаратов
Ограниченный срок применения препаратов
Слайд 18
В США с 1975 по 1999 г.
было изъято с рынка 10,2 % из 548 новых
химических соединений.
В Испании с 1990 года по 1999 были изъяты с рынка 22 лекарственных средства.
Во Франции с 1998 по 2004 годы запретили применение 21 препарата.
Lasser K.E. et al. JAMA 2002, 287,2215
Arnaiz J.A., Carne X, Riba N. et al. Eur. J. clin. Pharmacol. 2001,57.89-91
Olivier P. and Montastruc J.L. Pharmacoepidemiology and drug safety 2006,15,808-812
XIV Конгресс «Человек и лекарство», 2007
Слайд 19
В США в 50% случаев препараты были изъяты
из употребления из-за неблагоприятных побочных реакций (НПР) в среднем
через
2 года после начала их применения.
Во Франции препараты изымались после их внедрения в медицинскую практику в среднем через 4-5 лет.
Lasser K.E. et al. JAMA 2002, 287,2215
Olivier P. and Montastruc J.L. Pharmacoepidemiology and drug safety 2006,15,808-812
XIV Конгресс «Человек и лекарство», 2007
Слайд 20
Согласно определению ВОЗ
Фармаконадзор – это наука и деятельность,
направленная на выявление, оценку, понимание
и предупреждение неблагоприятных побочных
эффектов и/или любых других возможных проблем, связанных с лекарственными средствами»
В настоящее время фармаконадзор включает мониторинг безопасности лекарственных трав, биологически активных добавок и вакцин.
Слайд 21
В Российской Федерации государственную
функцию по организации проведения
экспертизы
качества, эффективности
и безопасности ЛС выполняет
Федеральная служба
по
надзору в сфере здравоохранения и социального развития
(Росздравнадзор)
Слайд 22
26 октября 2007 г.
Росздравнадзор
создал
Федеральный Центр
мониторинга безопасности ЛС
(ФЦМБЛС)
на базе ФГУ «Научный центр экспертизы средств
медицинского применения»
Слайд 23
29 января 2008 года Росздравнадзор направил письмо руководителям
здравоохранения всех субъектов РФ со следующими рекомендациями :
Организовать в
субъектах РФ региональные центры мониторинга безопасности лекарств, определив ответственные учреждения и\или подразделения по проблемам изучения НПР на ЛС
Привлечь к организации работы по выявлению и регистрации НПР главных специалистов, центры и кафедры клинической фармакологии ВУЗов, а также клинических фармакологов ЛПУ
Обеспечить контроль за своевременным представлением информации о НПР в региональные и федеральный центры МБЛС
Слайд 24
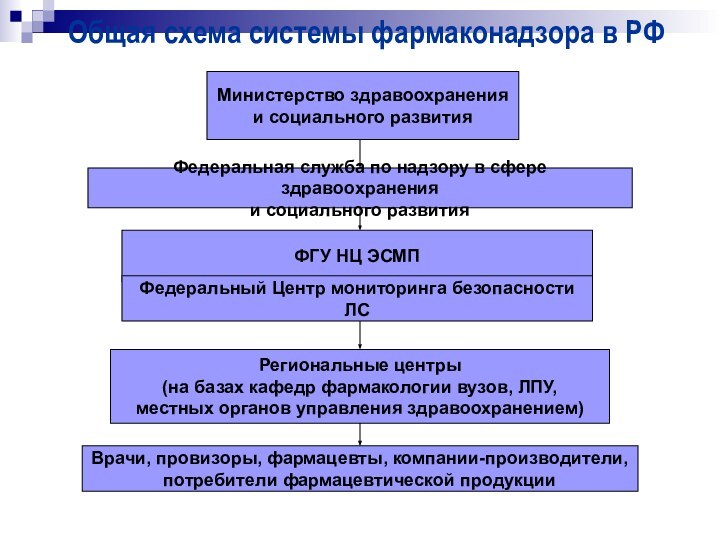
Общая схема системы фармаконадзора в РФ
Министерство здравоохранения
и
социального развития
ФГУ НЦ ЭСМП
Федеральный Центр мониторинга безопасности ЛС
Региональные центры
(на
базах кафедр фармакологии вузов, ЛПУ,
местных органов управления здравоохранением)
Врачи, провизоры, фармацевты, компании-производители,
потребители фармацевтической продукции
Федеральная служба по надзору в сфере здравоохранения
и социального развития
Слайд 25
Федеральный закон
«О лекарственных средствах» в РФ
В пункте
1 статьи 41 Закона о лекарственных средствах указано, что
«субъекты обращения лекарственных средств обязаны сообщать федеральному органу исполнительной власти в сфере здравоохранения, органам исполнительной власти субъектов Российской Федерации в сфере здравоохранения, федеральному органу контроля качества лекарственных средств и территориальным органам контроля качества лекарственных средств обо всех случаях побочных действий и об особенностях взаимодействия лекарственных средств с другими препаратами, которые не соответствуют сведениям о лекарственных средствах, содержащимся в инструкциях по их применению».
Слайд 26
Федеральный закон
«О лекарственных средствах» в РФ
В пункте
2 статьи 41 Закона о лекарственных средствах
отмечается, что «за
несообщение или сокрытие сведений, предусмотренных пунктом 1 настоящей статьи, лица, которым они стали известны по роду их профессиональной деятельности, несут дисциплинарную, административную или уголовную ответственность в соответствии с законодательством Российской Федерации».
Слайд 27
«Золотой стандарт» системы спонтанных сообщений
250 –300 сообщений/ 1
млн. жителей
не менее 10 % врачей присылают сообщения о
НПР
Слайд 28
Согласно « Золотому стандарту» фармаконадзора,
в Российской Федерации
с населением 142 млн. человек, ежегодно должно поступать
около
40 000 сообщений
о НПР
В 2007 году поступило
192 сообщения
Россия должно поступать
40 000 сообщений
Слайд 29
В 1997 году Россия была официально принята в
Программу ВОЗ
В настоящее время в этой программе участвуют
более 100 стран.
В базе данных ВОЗ имеется около 4 млн. сообщений о НПР
В 1968 году стартовала программа ВОЗ
по международному мониторингу лекарств,
в которой приняли участие 10 стран
Слайд 30
Присоединение России к Международной программе ВОЗ по мониторингу
лекарств имеет большое практическое значение, так как появляется возможность
своевременного получения информации из Центра ВОЗ:
о побочных реакциях на лекарственные средства,
о мерах профилактики и лечения лекарственных осложнений,
об административных мерах по ограничению и/или запрещению применения лекарственных средств
в разных странах.
Слайд 31
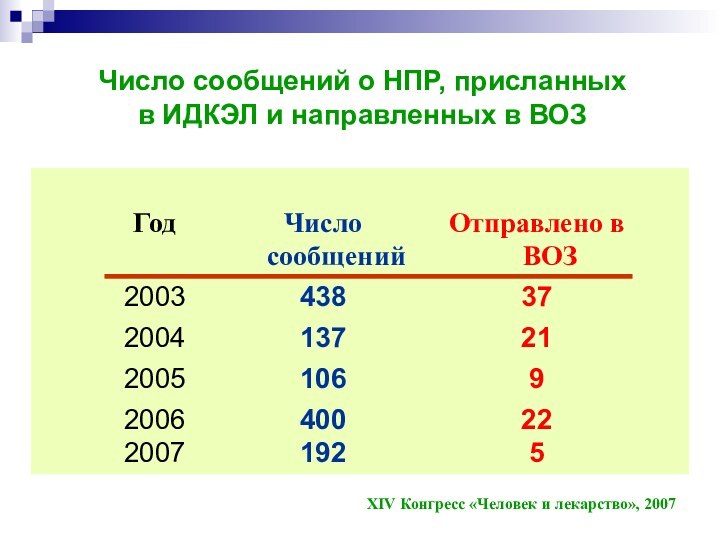
Число сообщений о НПР, присланных
в ИДКЭЛ и
направленных в ВОЗ
XIV Конгресс «Человек и лекарство», 2007
Слайд 32
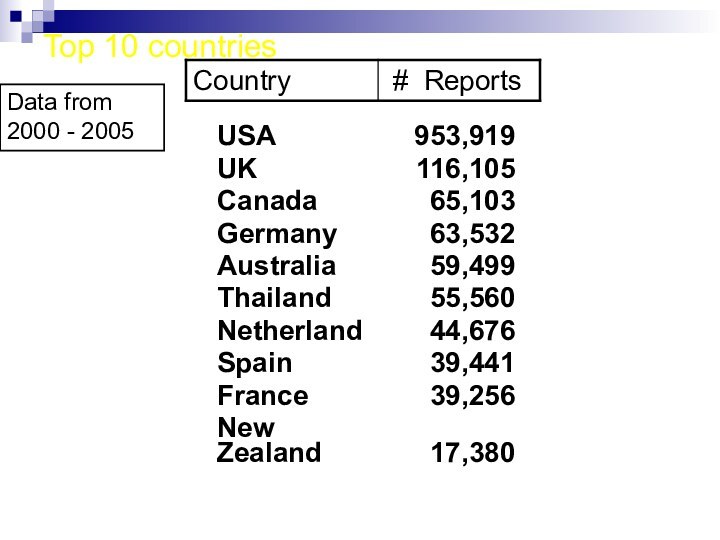
Top 10 countries
Data from 2000 - 2005
Слайд 33
Деятельность ФЦМБЛС Росздравнадзора
Осуществляется практическая и научно-методическая работа с
целью совершенствования выявления, оценки и профилактики нежелательных последствий применения
лекарственных средств
Слайд 34
Первые результаты работы ФЦМБЛС
Слайд 35
ЧТО следует делать регуляторным органам здравоохранения и фармацевтическим
компаниям для улучшения работы фармаконадзора с целью обеспечения безопасности
больных:
Проводить активные пост маркетинговые наблюдения и исследования препаратов
Проводить образовательные и тренинговые семинары для персонала системы фармаконадзора
Обеспечить активный тренинг и контроль побочных явлений в соответствие со специальными процедурами
Обеспечить непрерывное предоставление информации о препаратах ( научные публикации, конгрессы, письма-предостережения и т.д.
Играть более активную роль в повышении осознания значимости проблемы
Слайд 36
Обеспечить непрерывное образование в области неблагоприятных побочных реакций
на лекарственные средства
Формировать понимание значимости спонтанной системы сбора информации
Обеспечить обратную связь (информировать медицинский и фармацевтический персонал о результатах анализа поступающих от них сообщений, предоставлять им дополнительную информацию о НПР)
ЧТО следует делать для вовлечения медицинских и фармацевтических работников в работу по фармаконадзору:
Слайд 37
Для развития фармаконадзора в России срочно необходимо:
активизация российских медицинских работников по сбору информации о неблагоприятных
побочных реакциях на лекарственные средства,
повышение ответственности производителей (особенно отечественных) за мониторинг безопасности лекарственных средств;
Слайд 38
Вы можете облегчить страдания и спасти жизнь тысячам
пациентов,
сделав одну простую вещь -
своевременно сообщите о подозреваемой
неблагоприятной побочной реакции (НПР), в региональный или федеральный центр мониторинга безопасности лекарственных средств.
Слайд 39
XIV Конгресс «Человек и лекарство», 2007
Слайд 40
Безопасность больных – это не только вопрос денег
и не только вопрос технологий
Ни деньги, ни технологии, ни
приказы не решат наших проблем.
Центральное значение имеют политическая воля руководства и профессиональная и гражданская ответственность работников здравоохранения.
Слайд 41
Безопасность больных – это не только глобальная проблема,
это важная составная часть национальной безопасности страны