Слайд 2
Врожденный (неспецифический) иммунитет слизистых.
Гуморальное звено.
Барьерные белки (мукус)-муцины
Дефензины α
Дефензины β
Кателицидины
Лектины
-коллектины А и Д
-фиколины (L, M, H, P)
Лизоцим
Лактоферин
Липокалины
Ингибиторы
протеаз
-α2-макроглобулин, серпин, цистатин С
-SLPI, SKALP/elafin
Цитокины
Слайд 3
Врожденный (неспецифический) иммунитет слизистых.
Клеточное звено.
Дендритные клетки
Моноциты/макрофаги
Интраэпителиальные Т-лимфоциты
Нейтрофилы
Тучные клетки
Эозинофилы
Естественные
киллеры
Слайд 4
Приобретенный (специфический) иммунитет слизистых характеризуется:
1. Наличием специфических эпителиальных
клеток для специфического захвата антигена, т.н. М-клетки.
2. Скоплением В-лимфоцитов,
напоминающих по своей структуре фолликул.
3. Наличием интрафолликулярных участков, где преимущественно расположены Т-лимфоциты вокруг посткапиллярных венул с высоким эндотелием.
Слайд 5
Продолжение:
4. Наличием В-лимфоцитов – предшественников IgA-секретирующих плазматических клеток,
которые примируются на территории фолликулов.
5. Способностью предшественников IgA-продуцирующих клеток
мигрировать через лимфу в региональные лимфатические узлы и далее через грудной лимфатический проток и периферическую кровь распространяться по lamina propria всех органов, имеющих слизистую оболочку.
Слайд 6
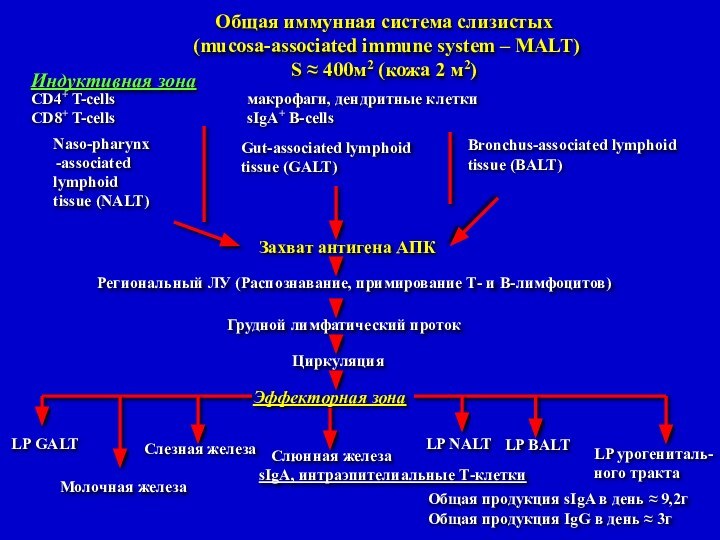
Индуктивная зона
CD4+ T-cells макрофаги, дендритные клетки
CD8+ T-cells sIgA+ B-cells
Общая иммунная
система слизистых
(mucosa-associated immune system – MALT)
S ≈ 400м2
(кожа 2 м2)
Naso-pharynx
associated lymphoid
tissue (NALT)
Gut-associated lymphoid
tissue (GALT)
Bronchus-associated lymphoid
tissue (BALT)
Захват антигена АПК
Региональный ЛУ (Распознавание, примирование Т- и В-лимфоцитов)
Грудной лимфатический проток
Циркуляция
Эффекторная зона
LP GALT
Молочная железа
Слезная железа
Слюнная железа
LP NALT
LP BALT
LP урогениталь-
ного тракта
sIgA, интраэпителиальные Т-клетки
Общая продукция sIgA в день ≈ 9,2г
Общая продукция IgG в день ≈ 3г
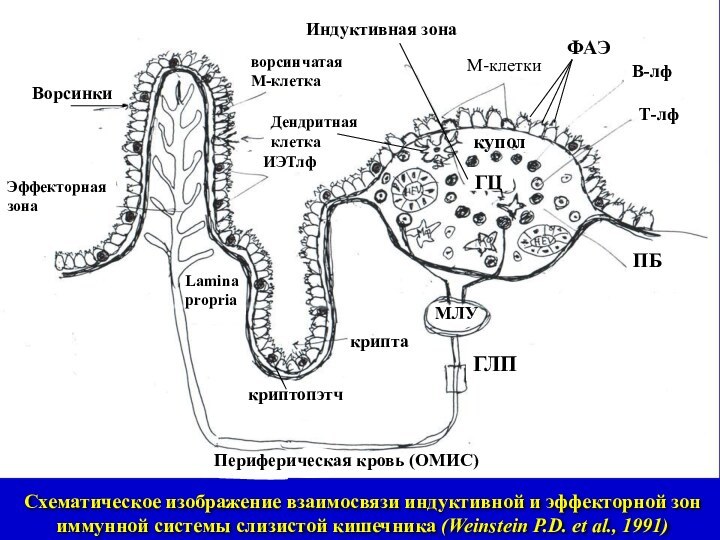
Слайд 7
Схематическое изображение взаимосвязи индуктивной и эффекторной зон иммунной
системы слизистой кишечника (Weinstein P.D. et al., 1991)
Индуктивная
зона
Эффекторная зона
ГЦ
ФАЭ
купол
ПБ
ГЛП
Дендритная
клетка
ИЭТлф
М-клетки
МЛУ
ворсинчатая
М-клетка
крипта
криптопэтч
Lamina
propria
Ворсинки
В-лф
Т-лф
Периферическая кровь (ОМИС)
Слайд 9
Наивный
Тлф
Тх
В2лф
АИД
Тх1/Тх2
или
ЦТЛ
α
μ
ИЛ-4
TGFβ
АГ
МНС
CD40L
CD40
ССR9
α4β7
интегрин
ИЛ-12
или
ИЛ-10
Ретиноиковая
кислота
АГ
ТРР
МНС
CD28
В7
ДКл
Эффекторная
зона
Схема механизмов развития иммунного ответа
в индуктивной зоне Пейеровой бляшки (Jun Kunisawa et al.,
2005).
Слайд 10
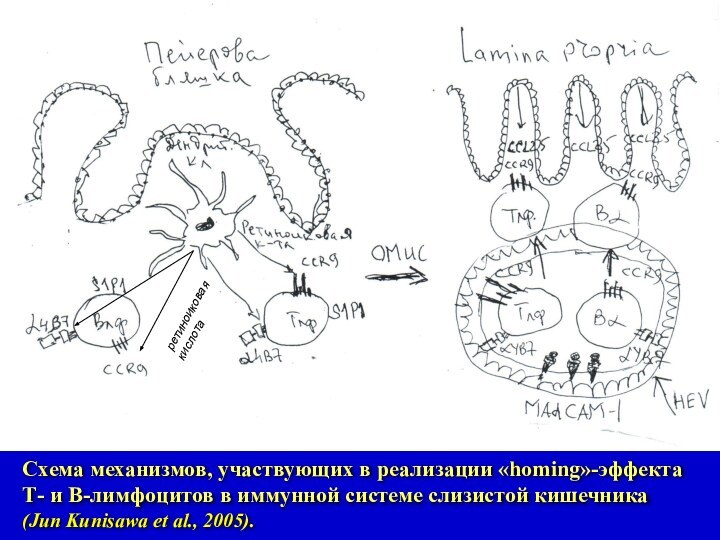
Схема механизмов, участвующих в реализации «homing»-эффекта Т- и
В-лимфоцитов в иммунной системе слизистой кишечника (Jun Kunisawa et
al., 2005).
Слайд 11
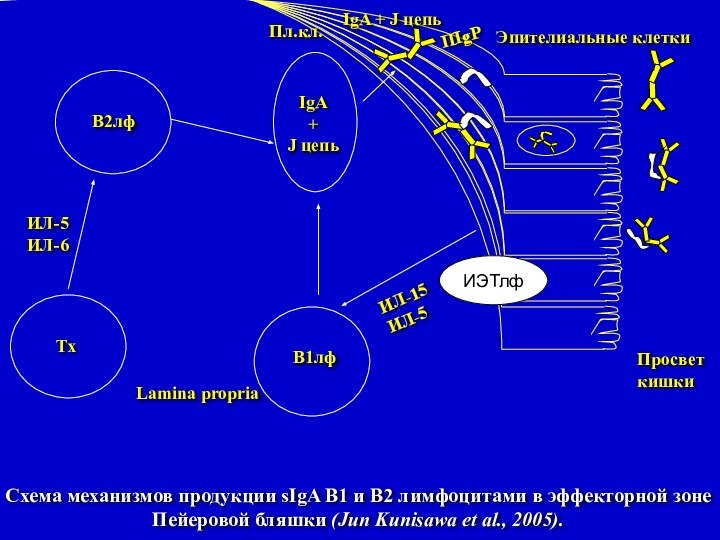
Схема механизмов продукции sIgA В1 и В2 лимфоцитами
в эффекторной зоне Пейеровой бляшки (Jun Kunisawa et al.,
2005).
ИЭТлф
В2лф
В1лф
Тх
IgA
+
J цепь
Просвет
кишки
ИЛ-15
ИЛ-5
ИЛ-5
ИЛ-6
Эпителиальные клетки
ПIgP
IgA + J цепь
Пл.кл.
Lamina propria
Слайд 12
секреторный IgA;
мукозальные цитотоксические СД8+ αβ Т-лимфоциты (распознавание мишени
за счет молекул ГКГ класса I);
интраэпителиальные гамма-, дельта Т-лимфоциты
(разпознавание мишени за счет белков теплового шока).
Слайд 14
Благодаря работам И.И. Мечникова и Л. Пастера стало
понятным, что нормальная микрофлора (микробиота) пищеварительного канала играет важную
роль в поддержании здоровья организма хозяина, принимая участие в различных метаболических процессах, а также в формировании и поддержании функционирования иммунной системы и, тем самым, в обеспечении противоинфекционной защиты.
Слайд 15
Основные эффекты физиологической микрофлоры
1) Колонизационная резистентность
колонизация эпителиальной зоны;
межмикробный
антагонизм (снижение жизнеподдерживающего субстрата и/или конкуренция за него;
конкуренция за
рецепторные места прикрепления – (конкурентное исключение – блокада рецепторов адгезинами микрофлоры);
генерация условий, ограничивающих выживание (поддержание кислой рН; бактериостатический эффект летучих жирных кислот; Re-dox потенциал);
иммунная функция (синтез иммуноглобулинов, интерферона);
продукция анти-микробных субстанций (бактериоцины).
Слайд 16
2) детоксикация (инактивация энтерокиназы, щелочной фосфатазы);
3)ферментативная функция (гидролиз
продуктов метаболизма белков, липидов, углеводов);
4) пищеварительная функция (повышение физиологической
активности желез пищевого канала);
5) антианемическая функция (улучшает всасывание железа);
6) антирахитическая функция (улучшает всасывание кальция, кальциферолов — вит. D)
Основные эффекты физиологической микрофлоры (продолжение)
Слайд 17
Важная роль взаимодействия физиологической микрофлоры и иммунной системы
1. Формирование и последующее поддержание иммунной системы слизистых (MALT
и GALT, в частности).
2. Участие в переключении иммунной системы с Th2 на Th1.
3. Создание и поддержание толерантности к пищевым и микробным антигенам.
4. Управление провоспалительными механизмами.
Слайд 18
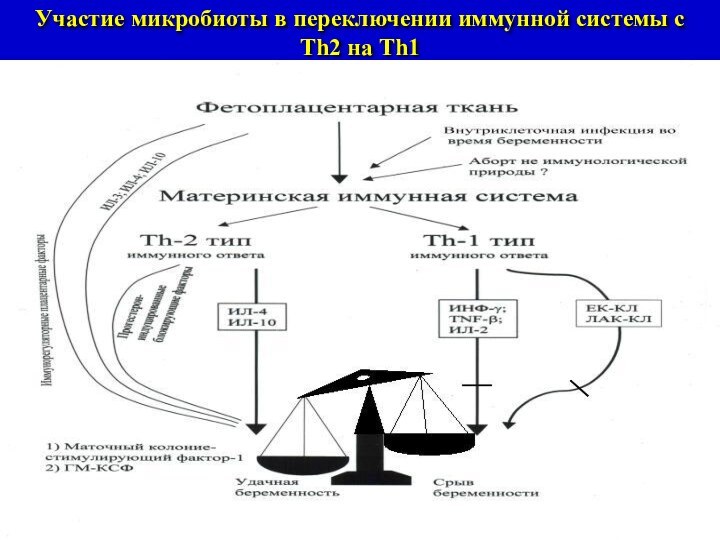
Участие микробиоты в переключении иммунной системы с
Th2 на
Тh1
Слайд 19
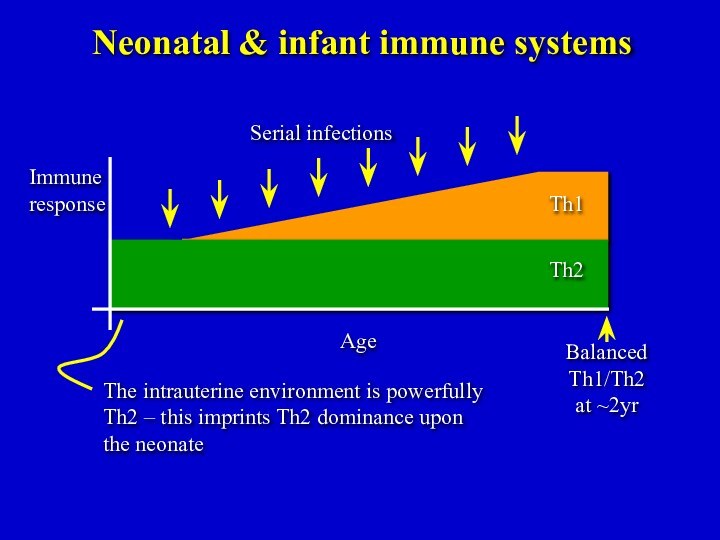
Balanced
Th1/Th2
at ~2yr
Neonatal & infant immune systems
The intrauterine
environment is powerfully Th2 – this imprints Th2 dominance
upon the neonate
Serial infections
Age
Immune
response
Слайд 20
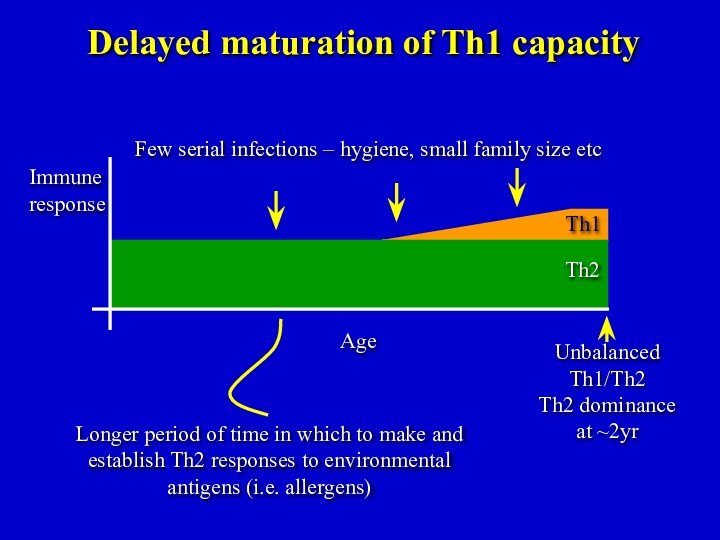
Th1
Th2
Unbalanced
Th1/Th2
Th2 dominance
at ~2yr
Delayed maturation of Th1 capacity
Few
serial infections – hygiene, small family size etc
Age
Immune
response
Longer period
of time in which to make and establish Th2 responses to environmental antigens (i.e. allergens)
Слайд 21
Создание и поддержание толерантности к пищевым и микробным
антигенам
Слайд 22
Макромолекулы преодолевают кишечный барьер через:
Межэпителиальные промежутки, особенно при
«открытии» зон смыкания.
Межэпителиальный транспорт приводит к воспалительным реакциям.
2.
Через эпителиальные клетки путем:
рецептор-независимого трансцитоза; при этом белки разрушаются ферментами;
рецептор-зависимого трансцитоза (при этом белки не разрушаются).
Трансцитоз способствует формированию толерантности (оральной).
Слайд 23
Оральная толерантность – такая форма толерантности, при которой
зрелые лимфоциты локальной и периферической лимфоидной ткани теряют способность
отвечать иммунным ответом на специфический антиген при условии его предварительного введения через рот (S.Strobel, 2002).
Для индукции оральной толерантности необходима определенная зрелость мукозальной иммунной системы.
Слайд 24
Механизмы оральной толерантности.
Клональная делеция – гибель Т-лимфоцитов под
влиянием высоких доз антигена.
2. Клональная анергия – отсутствие ко-стимуляционного
сигнала, толерогенные дендритные клетки и эпителиальные клетки. Эпителиальные клетки продуцируют тимический стромальный лимфопоэтин, который толеризирует дедритные клетки.
3. Антиген-индуцирующая супрессия – созревание Тreg, ИЛ-10, TGFβ.
Слайд 25
Иммунологический парадокс (Война и мир на поверхности слизистых)
(Sansonetti, 2007)
В организме человека сосуществуют ТОЛЕРАНТНОСТЬ к комменсалам с
одновременным быстрым и эффективным распознаванием / элиминацией бактериальных патогенов за счет развития ВОСПАЛЕНИЯ
Слайд 26
Механизмы поддержания «физиологического воспаления» и толерантности.
Микробы
комменсалы образуют биопленки
в слизи, что обеспечивает дистанцию от эпителия
комменсалы плохо распознаются
--LPS грамм-комменсалов (Bacteroides) являются пентацилатами, а не
гексацилатами; они скорее антагонисты TLR4
--флагеллины комменсалов плохие агонисты для TLR5, не секретируют
мономерную форму
Эпителий
-активация PRRs индуцирует продукцию анти-микробных пептидов, которые усиливают защитный барьер
-различная компартменлизация и экспрессия PRRs (например, TLR2, 4, 5) и/или коактивационных молекул (например, CD14, MD2)
Субэпителиальная ткань (lamina propria)
-иммунные связи направлены на создание и поддержание толерантности (например, Мф, ДКл, Treg)
-комменсалы подавляют провоспалительный механизм
Слайд 27
пищевые аллергены
sIgA
мукус, микробная пленка
Просвет
кишечника
Влф
IL-10
IL-6
IFN
IDO
T-reg
РДКл
IL-10
TGFβ
МЛУ
T
T
В
В
В
IgA
MC
MC
MC
MC
TGFβ
СD14—
COX2
PGE2
стромальная
клетка
Lamina propria
индукция
не-воспалител.
ДКл
TSLP
IDO
Treg/FoxP3
Th3
Treg1
TGFβ
IL-10
(—)
(—)
(—)
Th1
IFN-γ
↓
Мф
ДКл
IL-12 ↓
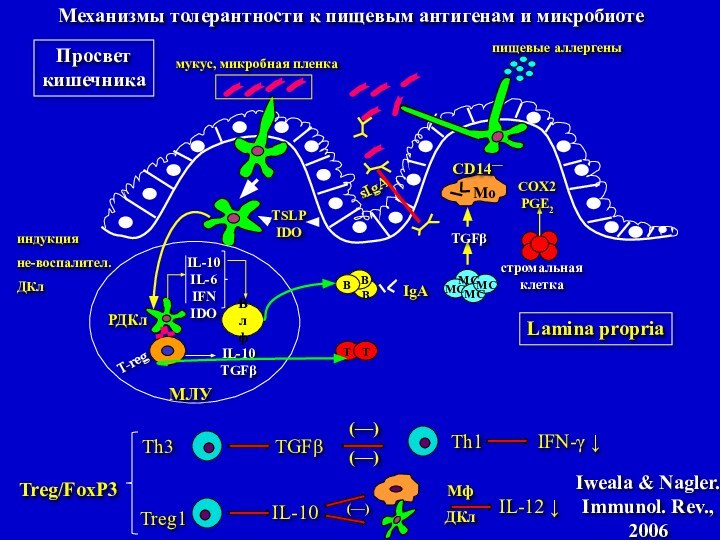
Механизмы толерантности к пищевым антигенам и микробиоте
Iweala
& Nagler. Immunol. Rev.,
2006
Слайд 28
Относительная толерантность эпителиоцитов к комменсалам связана с двумя
механизмами:
пассивный – комменсалы и их продукты не активируют NFκВ
трансдукционный путь.
активный – некоторые комменсалы способны активно подавлять NFκВ-путь за счет предотвращения инактивации ингибиторных белков (IκВ ).
Слайд 29
Относительная толерантность иммунной системы слизистых к микробиоте обеспечивает
«физиологический» характер перманентного воспаления.
Слайд 30
Управление провоспалительными механизмами
Слайд 31
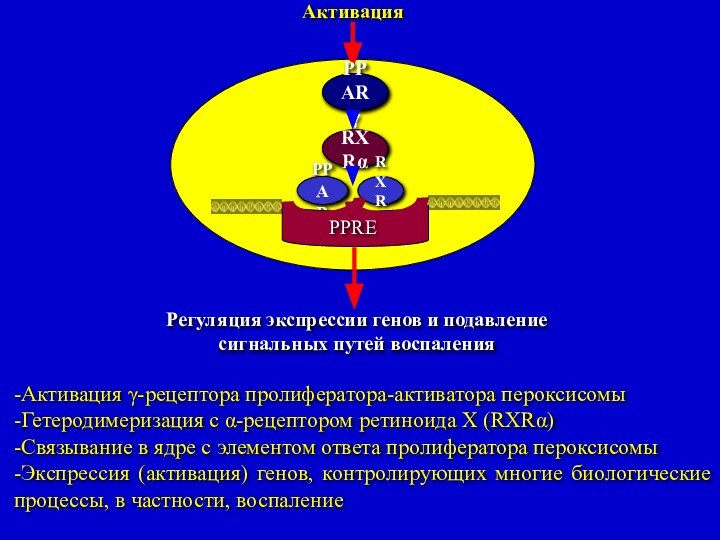
Пероксисомального пролифератора-активатора рецептор γ (PPARγ) принадлежит к семейству
ядерных транскрипционных факторов, был открыт в 1993 году (Zhu
Y. et al.).
Контролирует экспрессию большого количества регуляторных генов, участвующих в метаболизме липидов, чувствительности тканей к инсулину, воспалении и пролиферации (Debrie M.B. et al., 2001; Pajas I. et al., 2001).
Слайд 32
Активация
PPARγ
RXRα
PPAR
RXRα
PPRE
Регуляция экспрессии генов и подавление
сигнальных путей воспаления
-Активация
γ-рецептора пролифератора-активатора пероксисомы
-Гетеродимеризация с α-рецептором ретиноида Х (RXRα)
-Связывание в ядре с элементом ответа пролифератора пероксисомы
-Экспрессия (активация) генов, контролирующих многие биологические процессы, в частности, воспаление
Слайд 33
1
10
102
103
104
105
106
мононуклеары
панкреаз
тонкий
кишечник
кожа
печень
почка
толстый
кишечник
жировая
ткань
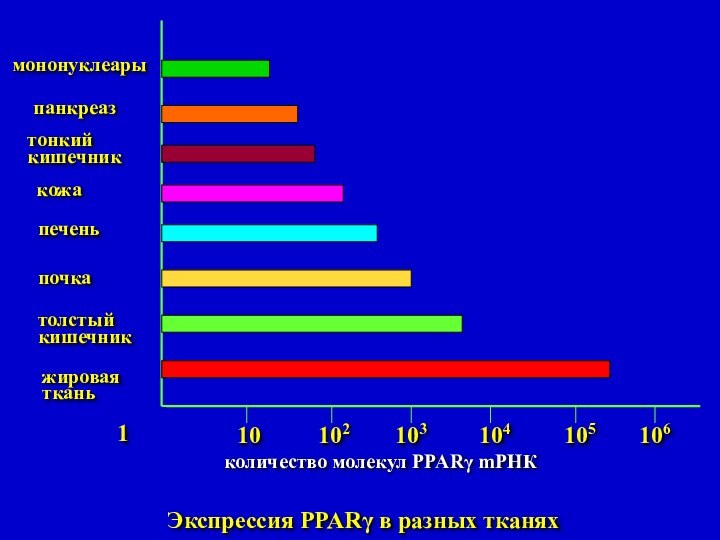
Экспрессия PPARγ в разных тканях
количество молекул
PPARγ mРНК
Слайд 34
PPARγ
ЛПС
Эпителиальная клетка
TLR-4
экспрессия
активация
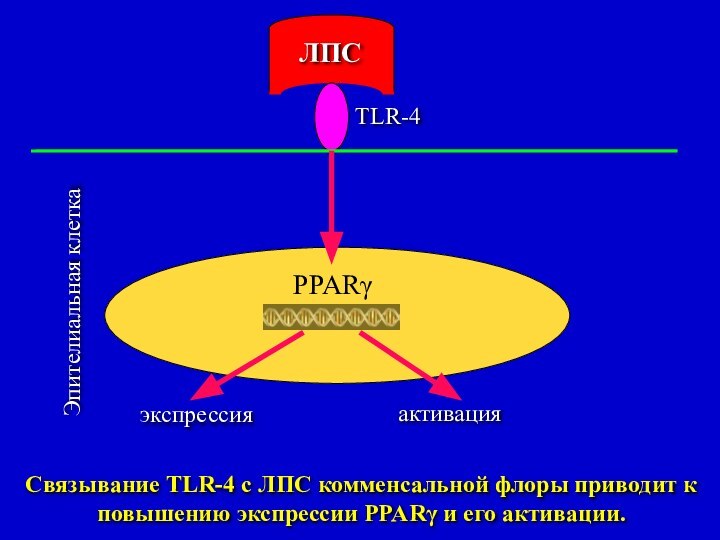
Связывание TLR-4 с ЛПС комменсальной флоры приводит
к повышению экспрессии PPARγ и его активации.
Слайд 35
Экспрессия PPARγ зависит от LPS, который принадлежит комменсальной
флоре.
Отсутствие PPARγ на поверхности эпителиальных клеток кишечника дает начало
воспалению, а затем его поддерживает.
Показано, что PPARγ активировался в присутствии комменсала Bacterioides thetaiotamicron, но не в присутствии патогенного микроорганизма Salmonella enteritides 9 (Kelly et al.).
Слайд 36
Активация
PPARγ
RXRα
PPAR
RXR
PPRE
p65
P50 Iκb
JNK
p38
кальцинейрин
NFκB
AP 1
AP 1
NFAT
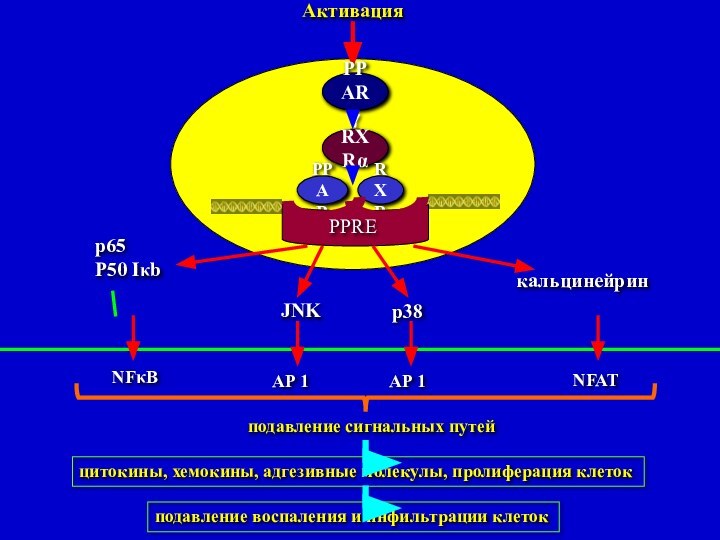
подавление сигнальных путей
цитокины, хемокины, адгезивные
молекулы, пролиферация клеток
подавление воспаления и инфильтрации клеток
Слайд 38
Идея употребления в пищу живых молочнокислых бактерий, оказывающих
благоприятный эффект на организм человека, принадлежит И.И.Мечникову (1908), который
впервые обосновал концепцию «пробиотиков». В настоящее время под термином «пробиотики» подразумевают «живые микроорганизмы, которые, будучи введены в организм в достаточном количестве, оказывают положительный эффект на здоровье хозяина» (FAO и WHO – Food a. Agricultural Organization of the United Nations and World Health organization) (F.M. Luquet, G.Corrieu, 2005).
Слайд 39
Основные эффекты пробиотиков.
1. Нормализация барьерной функции эпителия (tight
junction, zona occludens).
2. Улучшение микроэкологии кишечника (повышение колонизационной резистентности).
3.
Регуляция цитокинового баланса и ангиогенеза (подавление ОНФα и связанного с ним апоптоза колоноцитов; стимуляция ИЛ-10, TGFβ).
4. Повышение синтеза sIgA.
5. Стимуляция факторов врожденного иммунитета.
Слайд 40
В контексте пробиотических продуктов питания определение «пробиотик» звучит
следующим образом: «продукт, содержащий живые микроорганизмы в достаточном количестве,
который оказывает благоприятное влияние на здоровье хозяина в дополнение к его первичному пищевому эффекту».
Слайд 41
Компания Данон создала пробиотический продукт Actimel, который содержит
2 обычно используемых пробиотических йогуртовых штамма, а также 108
КОЕ/г Lactobacillus casei IMUNITASS (DEFENSIS).
Слайд 42
-ингибирует ротавирусную инфекцию;
-индуцирует секреторную активность клеток Панета;
-подавляет увеличение
индуцированной энтеропатогенными кишечными палочками парацеллюлярной проницаемости;
-ингибирует способность Escherichia coli,
выделенной у пациентов с болезнью Крона, к адгезии и инвазии в эпителиальные клетки кишечника.
L.casei IMUNITASS (DEFENSIS):
Слайд 43
L.casei IMUNITASS (DEFENSIS):
-модулирует врожденный клеточно-опосредованный иммунный ответ во
время интенсивных физических нагрузок (Pujol P. и соавт., 2000)
и психологического стресса (Marcos A. et al., 2004);
снижает число случаев заболевания диареей у маленьких детей (Pujot P. et al., 2000);
-сокращает продолжительность зимних инфекций у людей старше 60 лет (Turchet P. и соавт., 2003);
Слайд 44
-усиливает иммунный ответ против гриппозной вакцины у пожилый
людей (Aubin J.T. et al., 2007);
-способствует более эффективной эрадикации
на ликвидацию Н. pylori у детей (Sykora J. и соавт, 2005);
-подавляет активацию тучных клеток, активированную IgE (C.Schiffer-Mannioui et al., 2007)
L.casei IMUNITASS (DEFENSIS):
Слайд 45
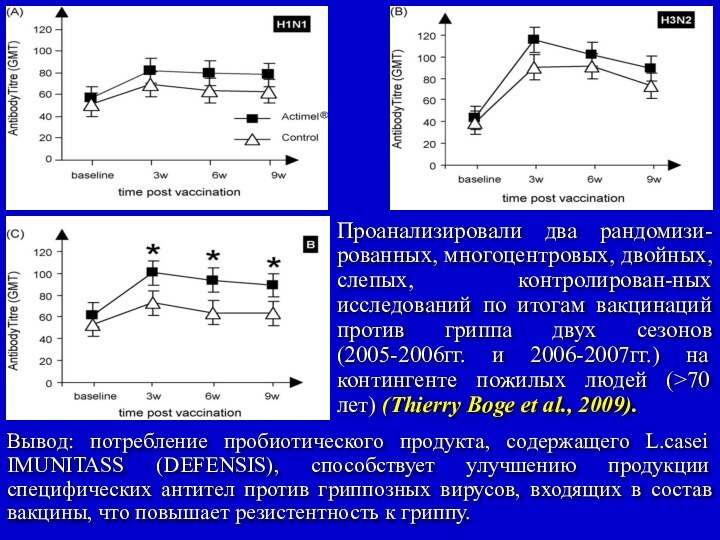
Проанализировали два рандомизи-рованных, многоцентровых, двойных, слепых, контролирован-ных исследований
по итогам вакцинаций против гриппа двух сезонов (2005-2006гг. и
2006-2007гг.) на контингенте пожилых людей (>70 лет) (Thierry Boge et al., 2009).
Вывод: потребление пробиотического продукта, содержащего L.casei IMUNITASS (DEFENSIS), способствует улучшению продукции специфических антител против гриппозных вирусов, входящих в состав вакцины, что повышает резистентность к гриппу.
Слайд 46
Положительный эффект пробиотиков доказан при следующих заболеваниях (состояниях).
Диарея,
ассоциированная с применением антибиотиков.
Непереносимость лактозы.
Атопический дерматит у детей.
Кишечный
дисбиоз.
Слайд 47
Есть данные по эффективности пробиотиков при:
Воспалительные заболевания желудочно-кишечного
тракта (болезнь Крона, неспецифический язвенный колит).
Рак толстой кишки.
Язва желудка
и 12-перстной кишки (Helicobacter pylori).
Урогенитальные инфекции.
Синдром раздраженного кишечника.
Вирусные инфекции.
Слайд 48
Факторы риска при приеме пробиотиков.
Большие:
1. Тяжелые иммунодефициты, включая
наличие опухолей.
2. Недоношенность.
Малые:
Диарея, кишечное воспаление
Введение пробиотиков через еюностому.
Наличие у
больного центрального венозного катетера
Введение антибиотиков широкого спектра действия, в том числе тех, к которым пробиотик является резистентным
Пробиотик с высокой степенью мукозальной адгезии.
Заболевания клапанов сердца
Слайд 49
«Дисбиоз – обязательный спутник любых стрессовых воздействий на
организм.
Одним из важнейших условий сохранения здоровья является сохранение физиологической
микрофлоры кишечника, оказавшейся наиболее уязвимым «компонентом» организма».
В.А.Тутельян
директор Института питания РФ, 2007)