Слайд 2
В лабораторной диагностике вирусных инфекций имеются три основных
подхода:
непосредственное исследование материала на наличие вирусного антигена или нуклеиновых
кислот;
изоляция вируса из клинического материала и идентификация вируса;
серологическая диагностика, основанная на установлении значительного прироста антител к вирусам в течение болезни.
Слайд 3
Прямые методы исследования клинического материала
Слайд 4
Это методы, которые позволяют обнаружить вирус, вирусный антиген
или вирусную нуклеиновую кислоту (НК) непосредственно в клиническом материале.
Являются наиболее быстрыми (2–24 ч).
Однако прямые методы имеют свои ограничения (возможность получения ложноположительных и ложноотрицатель-ных результатов). Поэтому они иногда требуют подтверждения непрямыми методами.
Слайд 5
Электронная микроскопия (ЭМ)
С помощью этого метода можно
обнаружить собственно вирус.
Для успешного определения вируса его концентрация
в пробе должна быть не менее 1·106 частиц в 1 мл.
Но поскольку концентрация возбудителя, как правило, в материале от больных незначительна, то поиск вируса затруднен и требует предварительного его осаждения с помощью центрифугирования.
Кроме того, ЭМ не позволяет типировать вирусы, так как у многих из них нет морфологических различий внутри семейства.
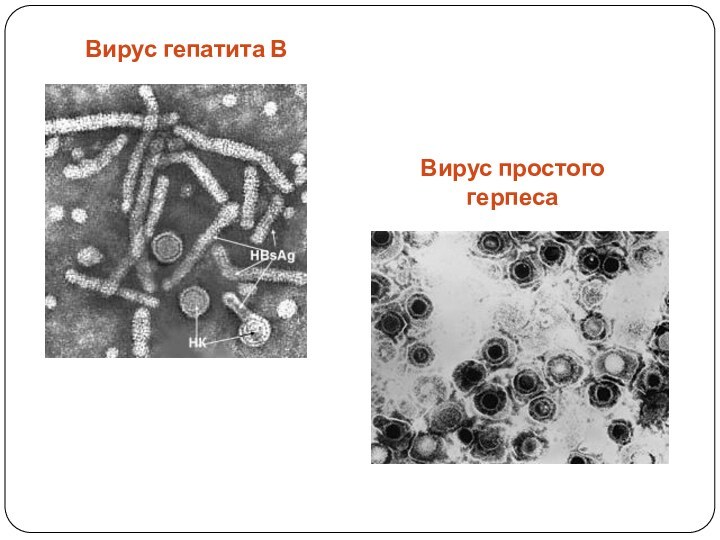
Слайд 6
Вирус гепатита В
Вирус простого герпеса
Слайд 7
Бактериофаги на бактериальной клетке
Слайд 8
Реакция иммунофлюоресценции (РИФ)
Метод основан на использовании антител, связанных
с красителем - флюорохромом.
РИФ широко применяется для выявления
вирусных антигенов в материале больных и для быстрой диагностики.
В практике применяются два варианта РИФ: прямой и непрямой.
Слайд 9
Прямая РИФ: применяются меченные красителем антитела к вирусам,
которые наносятся на инфицированные клетки (мазок, культура клеток).
Непрямая
РИФ:
на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале;
затем наслаивается антиглобулиновая (антивидовая) сыворотка, меченая флюорохромом.
Слайд 10
РИФ широко применяется для быстрой расшифровки этиологии острых
респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки
верхних дыхательных путей.
Успешное применение РИФ возможно, если в клиническом материале содержится достаточно большое число инфицирован-ных клеток.
Слайд 11
3. Иммуноферментный анализ (ИФА)
Антитела, меченые ферментами, связываются
с антигеном (вирусом), и такой комплекс обнаруживается при добавлении
субстрата для фермента.
ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте.
Слайд 12
Преимущества метода ИФА:
т.к. с помощью ИФА можно
измерять растворимые антигены, то не требуется наличия интактных клеток
в образце и таким образом могут использоваться различные виды клинического материала.
возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии.
Слайд 13
4. Радиоиммунный анализ (РИА)
Метод основан на метке
антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного
антигена.
Широкое распространение метод получил в 80-е годы, особенно для определения маркеров HBV и других некультивируемых вирусов.
К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков).
Слайд 14
5. Молекулярные методы
Молекулярная гибридизация нуклеиновых кислот.
Метод
основан на гибридизации комплементарных нитей ДНК или РНК
с образованием двунитевых структур и выявлении их с помощью метки.
Для этой цели используются специальные ДНК- или РНК-зонды, меченные изотопом (32Р) или биотином, обнаруживающие комплементарные нити ДНК или РНК.
Слайд 15
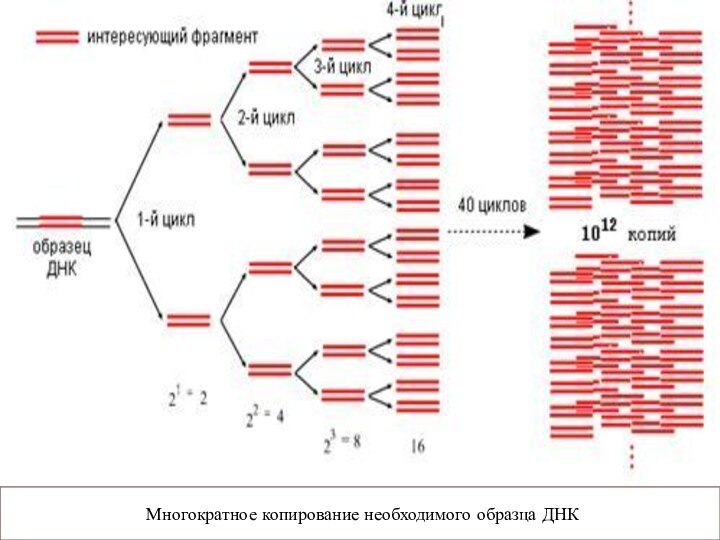
Полимеразная цепная реакция (ПЦР).
Основана на принципе естественной
репликации ДНК.
Суть метода заключается в многократном повторении циклов
синтеза (амплификации) вирус-специфической последовательности ДНК с помощью термостабильной Taq ДНК-полимеразы и двух специфических затравок – так называемых праймеров.
Вновь синтезированные фрагменты ДНК служат в качестве матрицы для синтеза новых нитей в следующем цикле амплификации, что позволяет за 25–35 циклов наработать достаточное число копий выбранного участка ДНК для ее определения различными методами.
Слайд 17
Многократное копирование необходимого образца ДНК
Слайд 18
Структуру отдельного цикла можно представить следующим образом:
Денатурация ДНК
Отжиг праймеров
Элонгация ДНК
Слайд 19
Оборудование
1. Ламинарные шкафы и боксы для стерильных работ;
2.
Системы автоматического выделения и очистки нуклеиновых кислот;
3. Автоматические пипетки;
4.
Электрофорез;
5. Амплификатор (термоциклер, ПЦР-машина) .
Ламинарный бокс
King Fisher Flex. Выделение и очистка нуклеиновых кислот, а также белков
Слайд 20
Амплификатор (термоциклер, ПЦР-машина) — прибор, обеспечивающий периодическое охлаждение и нагревание
пробирок, обычно с точностью не менее 0,1 °C. Прибор
производит определенное количество попеременных нагревов и охлаждений (термоциклов) в зависимости от используемого метода и повторяет их множество раз. Копирование участков ДНК происходит тысячи раз.
Слайд 21
Детекция продуктов амплификации
В большинстве методик на данном этапе
проводится разделение смеси продуктов амплификации, полученной на 2-ой стадии.
Метод
горизонтального электрофореза;
Метод вертикального электрофореза;
Метод гибридизационных зондов
Детекция ПЦР-продукта методом гель-электрофореза
Слайд 22
Варианты постановки ПЦР
Вложенная ПЦР (Nested PCR (англ.);
Инвертированная ПЦР (Inverse PCR (англ.);
ПЦР с
обратной транскрипцией (Reverse Transcription PCR, RT-PCR (англ.);
Асимметричная ПЦР (англ. Asymmetric
PCR);
Количественная ПЦР (Quantitative PCR, Q-PCR (англ.);
Ступенчатая ПЦР (Touchdown PCR (англ.);
Метод молекулярных колоний (ПЦР в геле, англ. Colony - PCR Colony);
ПЦР длинных фрагментов (англ. Long-range PCR);
RAPD (англ. Random Amplification of Polymorphic DNA);
Групп-специфическая ПЦР (англ. group-specific PCR);
ПЦР с использованием горячего старта (англ. Hot-start PCR) ;
Виртуальная ПЦР (англ. in silico PCR, цифровая ПЦР, электронная ПЦР, е-ПЦР).
Слайд 23
Принцип метода ПЦР с обратной транскриптазой
образование комплементарной ДНК
(кДНК) на матрице одноцепоченой мРНК с помощью фермента ревертазы,
с последующими циклами по стандартной методике ПЦР
Слайд 24
Метод ПЦР высокоспецифичен и очень чувствителен. Он позволяет
обнаружить несколько копий вирусной ДНК в исследуемом материале.
В
последние годы ПЦР находит все более широкое применение для диагностики и мониторинга вирусных инфекций (вирусы гепатитов, герпеса, папилломы и др.)
Слайд 25
Иммунохроматографический анализ
— это метод определения наличия определенных концентраций антигенов
вируса в биологических материалах (моча, цельная кровь, сыворотка или
плазма крови, слюна, кал и т. д.).
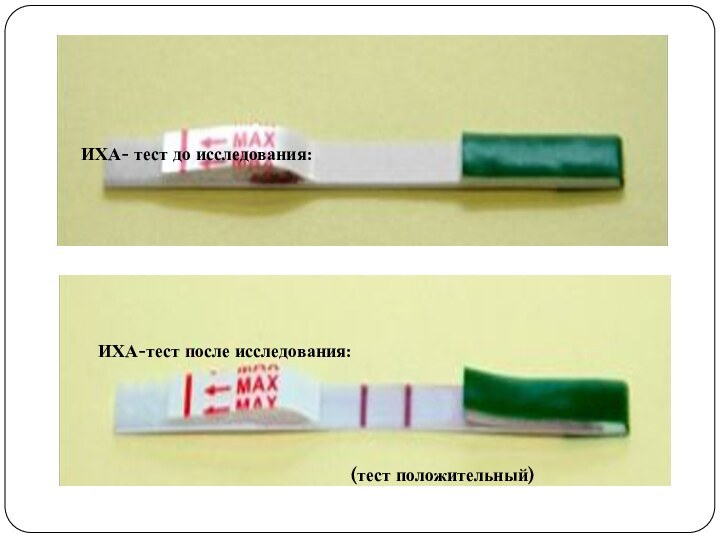
Слайд 26
ИХА- тест до исследования:
ИХА-тест после исследования:
(тест положительный)
Слайд 27
Принцип действия иммунохроматографического теста.
В ИХА-полосках (экспресс-тестах) используются три
типа антител:
1. Подвижные (растворимые)моноклональные антитела к исследуемому антигену или
антителу, конъюгированные ("сшитые") с коллоидным золотом - красителем, который можно легко идентифицировать даже в самых малых концентрациях. Эти антитела нанесены вблизи участка погружения тест-полоски в исследуемую жидкость (мочу, кровь). И после погружения в биологическую жидкость мигрируют вместе с жидкостью.
2. Поликлональные антитела к исследуемому антигену или антителу, жестко иммобилизованные в тест-зоне полоски.
3. Вторичные антитела к моноклональным антителам, жестко иммобилизованные в контрольной зоне тест-полоски (анти- антитела).
Слайд 28
ИХА тест 4-го поколения Determine™ HIV-1/2 Ag/Ab
Combo
Слайд 29
6. Цитологические методы
В настоящее время имеют ограниченное диагностическое
значение, но при ряде инфекций по-прежнему должны применяться.
Исследуются
материалы биопсии, мазки, которые после соответствующей обработки окрашиваются и анализируются под микроскопом.
При цитомегаловирусной инфекции, например, в срезах ткани или в моче обнаруживаются характерные гигантские клетки– "совиный глаз"; при бешенстве – включения в цитоплазме клеток (тельца Бабеша–Негри).
Слайд 30
Выявление телец Бабеша—Негри в цитоплазме нервных клеток при
различных методах окраски.
Слайд 32
Выделение вирусов – один из самых старых и
трудоемких методов диагностики.
Однако и сегодня выделение вируса с
последующей идентификацией с помощью одного из современных методов (ИФА или ПЦР) является наиболее достоверным методом диагностики – так называемый "золотой стандарт".
Слайд 33
Для успешного выделения вирусов клинический материал должен быть
взят в соответствии с патогенезом предполагаемого заболевания и в
наиболее ранние сроки.
Как правило, берутся:
при респираторных инфекциях – носоглоточный смыв;
при энтеровирусных инфекциях – фекалии (энтеровирусы);
при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа).
Слайд 34
Для культивирования вирусов используют ряд методов. Это культивирование
в:
организме экспериментальных животных,
развивающихся куриных эмбрионах,
культурах тканей
(чаще — эмбриональные ткани или опухолевые клетки).
Для выращивания клеток тканевых культур используют многокомпонентные питательные среды (среда 199, среда Игла и др.). Они содержат индикатор измерения рН среды и антибиотики для подавления возможного бактериального загрязнения.
Слайд 35
Культуры тканей могут быть:
переживающими, в которых жизнеспособность
клеток удается сохранить лишь временно;
растущими, в которых клетки
не только сохраняют жизнедеятельность, но и активно делятся.
Слайд 36
В роллерных культурах клетки ткани фиксированы на плотной
основе (стекло, пластик) — чаще в один слой (однослойные).
В суспензированных — взвешены в жидкой среде.
Слайд 37
О размножении вирусов в культуре ткани можно судить
по цитопатическому действию (ЦПД):
деструкции клеток;
изменению их морфологии;
формированию многоядерных симпластов или синтиция в результате слияния клеток.
Слайд 38
В клетках культуры ткани при размножении вирусов могут
образовываться включения — структуры, не свойственные нормальным клеткам.
По локализации
в клетке различают:
цитоплазматические;
ядерные;
смешанные включения.
Характерные ядерные включения формируются в клетках, зараженных вирусами герпеса (тельца Каудри), аденовирусами, а цитоплазматические включения — вирусами оспы (тельца Гварниери и Пашена), бешенства (тельца Бабеша-Негри) и др.
Слайд 40
Включения выявляются в окрашенных по Романовскому-Гимзе мазках из
зараженных клеток.
Краситель состоит из эозина, метиленового синего и
азура, растворенных в метаноле или в смеси метанола с глицерином.
Обладает полихромным действием, окрашивая ацидофильные структуры в разные тона красного цвета, базофильные - в тона от пурпурового до синего.
Непосредственно перед употреблением к 10 мл дистиллированной воды прибавляют 10 капель коммерческого красителя Романовского-Гимза. Предметное стекло с окрашиваемым препаратом погружают в стаканчик с краской. Через 1 ч. краску сливают, препарат промывают водой и высушивают на воздухе.
Слайд 41
О размножении вирусов в культуре ткани также можно
судить по методу «бляшек» (негативных колоний).
«Бляшки», или «негативные»
колонии — ограниченные участки разрушенных вирусами клеток, культивируемых на питательной среде под агаровым покрытием, видимые как светлые пятна на фоне окрашенных живых клеток.
Один вирион образует потомство в виде одной «бляшки».
«Негативные» колонии разных вирусов отличаются по размеру, форме, поэтому метод «бляшек» используют для дифференциации вирусов, а также для определения их концентрации.
Слайд 43
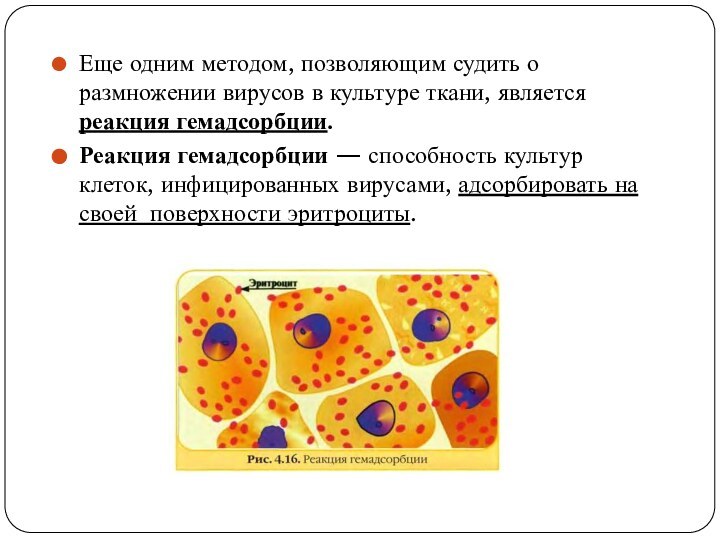
Еще одним методом, позволяющим судить о размножении вирусов
в культуре ткани, является реакция гемадсорбции.
Реакция гемадсорбции — способность
культур клеток, инфицированных вирусами, адсорбировать на своей поверхности эритроциты.
Слайд 44
Наиболее распространенным методом оценки размножения вирусов в культуре
ткани является метод «цветной пробы».
«Цветная» реакция оценивается по
изменению цвета индикатора, находящегося в питательной среде культивирования.
Если вирусы не размножаются в культуре клеток, то живые клетки в процессе метаболизма выделяют кислые продукты, что ведет к изменению рН среды и, соответственно, цвета индикатора.
При репродукции вирусов нормальный метаболизм клеток нарушается (клетки гибнут), и среда сохраняет свой первоначальный цвет.
Слайд 46
В большинстве случаев используют парные сыворотки крови, взятые
с интервалом в 2–3 нед.
Положительной реакция считается по
крайней мере при 4-кратном нарастании титра антител.
Известно, что большинство специфических антител относятся к классам IgG и IgM, которые синтезируются в различное время инфекционного процесса.
При этом IgM относятся к ранним, и тесты, используемые для их определения, применяются для ранней диагностики (достаточно исследовать одну сыворотку).
Антитела класса IgG синтезируются позже и длительно сохраняются.
Слайд 47
1. Реакция торможения гемагглютинации (РТГА)
Используется для диагностики заболеваний,
вызванных гемагглютинирующими вирусами.
Она основана на связывании стандартного вируса
(вирусный диагностикум) с антителами сыворотки больного.
При отсутствии специфических антител эритроциты агглютинируются вирусом (формирование характерного "зонтика").
Слайд 48
2. Реакция связывания комплемента
РСК является одной из
традиционных серологических реакций и используется для диагностики многих вирусных
инфекций.
В реакции принимают участие две системы: антитела сыворотки больного + стандартный вирус и эритроциты барана + антитела к ним, а также комплемент.
При соответствии антител и вируса этот комплекс связывает комплемент и лизиса бараньих эритроцитов не происходит (положительная реакция).
При отрицательной РСК комплемент способствует лизису эритроцитов.
Слайд 49
3. Реакция пассивной гемагглютинации
РПГА – агглютинация сенсибилизированных вирусными
антигенами эритроцитов в присутствии антител.
На эритроцитах могут быть
сорбированы любые вирусы, независимо от наличия или отсутствия у них гемагглютинирующей активности.
Слайд 50
4. Иммуноферментный анализ
ИФА применяется для определения антител в
сыворотке.
На твердую фазу (дно лунок полистироловых планшет) сорбируется
вирусный антиген.
При добавлении соответствующих антител, находящихся в сыворотке, происходит их связывание с сорбированными антигенами.
Наличие искомых антител обнаруживается с помощью анти-антител (например, человеческих), конъюгированных с ферментом (пероксидазой).
Добавление субстрата и реакция субстрат – фермент дают окраску.