- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основы клинической физиологии сердца
Содержание
- 3. В норме имеется равновесие между использованием О2
- 4. Атеросклероз коронарных артерийСклеротические изменения сосудистой стенки являются
- 5. Роль эндотелия.В норме эндотелий кровеносных сосудов обладает
- 6. Повреждающие факторы, способствующие развитию атеросклероза Можно выделить
- 7. Ишемия миокардаИшемия миокарда - дефицит поступления кислорода
- 8. ИшемияСледствием ишемии являются: - нарушение процесса электромеханического
- 9. Боль при инфаркте миокардаВ сердце свободные нервные
- 10. Тотальная ишемия.Полное прекращение коронарного кровотока (инфаркт миокарда)
- 11. Фазы развития процесса при ишемииЛатентный период Период
- 12. ОСТАНОВКА СЕРДЦАОстановка сердца происходит при еще сохранившемся
- 13. РеперфузияПосле остановки сердца восстановление кровотока так же
- 14. Кальций и реперфузияВследствие того, что кальций является
- 15. Гипоксия и кальцийВ тоже время наиболее часто
- 16. Гипоксия и кальций (продолжение)Происходящее одновременно снижение активности
- 17. Гипоксия и ионы калияПри гипоксии происходит утечка
- 18. Влияние К+Увеличение калиевой проницаемости приводит к уменьшению
- 19. Ишемия и ПДВ ишемизированных клетках обычно возрастает
- 20. Инфаркт миокарда и напряжение в стенке сердца.Согласно
- 21. Выпячивание стенки левого желудочкаЕстественно, что с ростом
- 22. Организм и недостаточность кровообращенияПри нарушении кровообращения можно
- 23. Венозный возврат крови к сердцуБольшое значение в
- 24. Но венозный возврат зависит также и от
- 26. Нарушение возбудимости и проводимостиСреди прочих механизмов патологии
- 27. Нарушение возбудимости и проводимостиНарушение анатомической или функциональной
- 28. АберрантностьПри нарушении возбудимости и проводимости проявляется еще
- 29. Механизмы нарушения ритма сердцаМожно выделить три основных
- 30. I. Нарушение образования импульсов.Основные причины этого:усиление или
- 31. II. Нарушение проведения импульсов.Физиологических механизмов, приводящих к
- 32. Механизма возвратного возбуждения (re-entry).В норме кругового распространения
- 33. Механизма возвратного возбуждения (re-entry). Причиной появления повторного
- 34. Условия возникновения возвратного возбуждения (re-entry). К
- 35. Гипоксия миокарда и эктопический ритмогенезИсточник эктопической активности
- 36. Атриовентрикулярная блокадаИмпульсы от предсердий к желудочкам обычно
- 38. Скачать презентацию
- 39. Похожие презентации
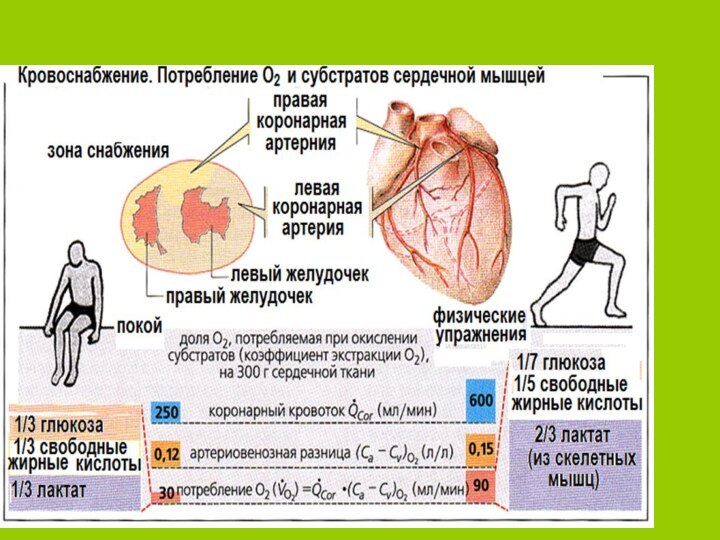
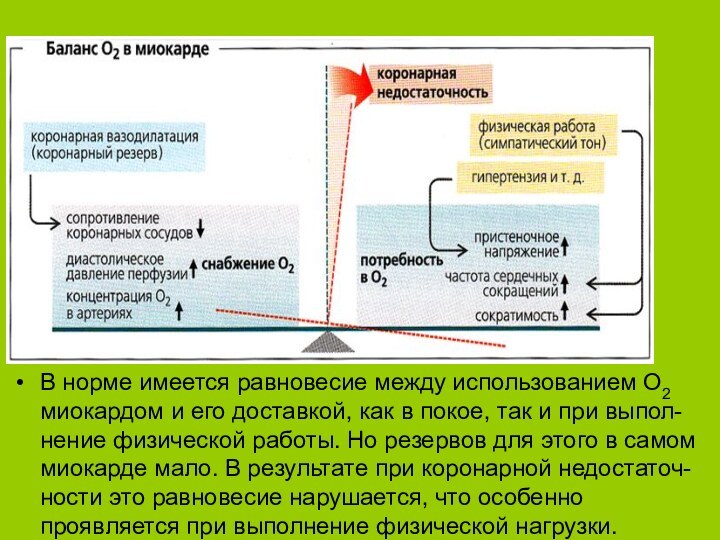
В норме имеется равновесие между использованием О2 миокардом и его доставкой, как в покое, так и при выпол-нение физической работы. Но резервов для этого в самом миокарде мало. В результате при коронарной недостаточ-ности это равновесие нарушается,


























Слайд 4
Атеросклероз коронарных артерий
Склеротические изменения сосудистой стенки являются наиболее
часто встречающимся и одним из наиболее грозных заболеваний сердечно-сосудистой
системы. Так, атеросклероз коронарных артерий является основной причиной (около 99%) ишемической болезни сердца (ИБС).В свою очередь около 65% всех заболеваний сердечно-сосудистой системы приходится на ИБС.
Слайд 5
Роль эндотелия.
В норме эндотелий кровеносных сосудов обладает свойством
атромбогенности. В основе его лежит синтез эндотелиальными клетками мощных
ингибиторов аггрегации тромбоцитов : простациклина (PGI1) и антифактора VIII.Кроме того, на их поверхности, обращенной к крови, имеется гликокаликс (углеводно-протеиновые соединения). К сожалению, слой гликокаликса тоньше около разветвлений сосудистого дерева, что вероятно обусловлено механическим "размыванием" его кровью. Весьма показательно, что эндотелиальные клетки в этих местах обновляются обычно более интенсивно: через 60-120 суток, в то время как в других участках - 100-180 суток. Но именно здесь наиболее часто и развивается атеросклеротическая бляшка.
Механическое растяжение и повреждение эндотелиальных клеток увеличивает активность их обновляемости , что может привести к отностительной недостаточности этого процесса.
При этом изменяются и нейротрофические влияния на сосудистую стенку.
Слайд 6
Повреждающие факторы, способствующие развитию атеросклероза
Можно выделить две
разновидности, возникающих здесь сил: сила сдвига и сила бокового
давления. Сила сдвига обусловлена трением крови о стенку сосуда. Она пропорциональна вязкости крови, скорости кровотока и обратно пропорциональна радиусу просвета сосуда. Сила бокового давления обусловлена величиной давления крови на стенку сосуда.К повреждающим сосуды факторам кроме механического воздействия относятся:
значительные изменения рН крови, температуры, осмомолярности;
ишемия;
гипоксия;
гипертензия;
влияние вазоактивных веществ (брадикинина, серотонина, адреналина и др.);
гиперлипидемия и т.п.
Слайд 7
Ишемия миокарда
Ишемия миокарда - дефицит поступления кислорода с
кровью по отношению к глобальным или локальным потребностям сердца
в кислороде.Ишемия возникает: а) при нарушении поступления крови по коронарным сосудам, б) при чрезмерной гипертрофии какого-либо отдела сердца.
Чаще всего гипертрофия развивается в левом желудочке. Это происходит:
а) при гипертензии,
б) при стенозе или недостаточности аортального клапана,
в) при некоторых врожденных пороках.
Если один из желудочков гипертрофирован, то в эту сторону отклоняется электрическая ось сердца.
Обусловлено это двумя причинами:
а) в таком желудочке возбуждается дополнительная масса кардиомиоцитов,
б) для возбуждения его требуется больше времени.
Слайд 8
Ишемия
Следствием ишемии являются:
- нарушение процесса электромеханического
сопряжения, приводящее к снижению или полной потере сократительной активности,
- развитие аномальной электрической активности, которая может привести к возникновению различного рода аритмий,
- постепенное повреждение структуры клеток вплоть до необратимой их гибели (инфаркт миокарда).
Кроме того, при ишемии происходят изменения в адренергической иннервации. С одной стороны на мембране кардиомиоцитов возрастает плотность α- и β-ад-ренорецепторов, а с другой - увеличивается выделение медиатора норадреналина.
Кроме того воздействие повышенного количества катехоламинов (при стрессе) на измененную популяцию рецепторов также играет определенную роль в спазме сосудов и углублении ишемического поражения.
Слайд 9
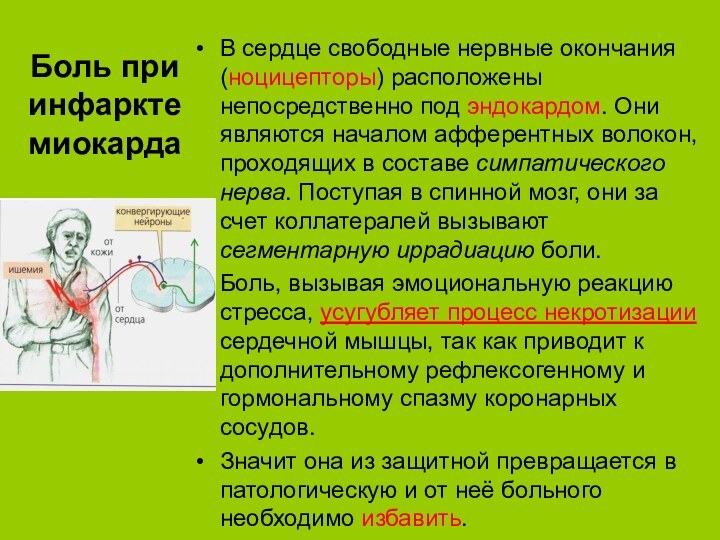
Боль при инфаркте миокарда
В сердце свободные нервные окончания
(ноцицепторы) расположены непосредственно под эндокардом. Они являются началом афферентных
волокон, проходящих в составе симпатического нерва. Поступая в спинной мозг, они за счет коллатералей вызывают сегментарную иррадиацию боли.Боль, вызывая эмоциональную реакцию стресса, усугубляет процесс некротизации сердечной мышцы, так как приводит к дополнительному рефлексогенному и гормональному спазму коронарных сосудов.
Значит она из защитной превращается в патологическую и от неё больного необходимо избавить.
Слайд 10
Тотальная ишемия.
Полное прекращение коронарного кровотока (инфаркт миокарда) сопровождается
относительно быстрым истощением в миокарде запасов макроэргов. Снижение поступления
кислорода приводит к переходу миокарда на анаэробный путь ресинтеза АТФ. Это сопровождается:развитием ацидоза в кардиомиоцитах,
перераспределением ионов и жидкости между внутриклеточным и внеклеточных пространствами,
нарушением сократимости с последующим изменением структур,
полным некрозом кардиомиоцитов.
Причем необратимые изменения в кардиомиоцитах левого желудочка развиваются быстрее, чем в правом и проводящей системе. Обусловлено это большей толщиной стенки, более гипертрофированными кардиомиоцитами.
Слайд 11
Фазы развития процесса при ишемии
Латентный период
Период выживания
Период, сохраняющий возможность восстановле-ния функций сердца
Некроз
В латентный период функции
еще не изменяются. При этом кислород поступает из "запасников": оксигемоглобина крови, оксимиоглобина. Но этого кислорода хватит не более чем на несколько секунд (1-20 с) работающего сердца.Миоглобин начинает отдавать кислород, когда напряжение О2 в мышечных клетках падает ниже 10-15 мм рт.ст.
Как только уровень РО2 снизится ниже 5 мм рт.ст. миокард переходит на анаэробный путь. Но при гликолизе вырабатывается недостаточное количество макроэргов в ед. времени, чтобы обеспечить все процессы функционирующего сердца.
В результате первым снижается уровень креатинфосфатов (КФ).
При содержании КФ ниже 3 мкмоль/г ткани левого желудочка наблюдается нарушение сократимости вплоть до полной его остановки.
Гипоксия, внутриклеточный ацидоз на мембране кардиомиоцитов блокирует медленные Са-каналы, угнетая тем самым сократительную активность.
Слайд 12
ОСТАНОВКА СЕРДЦА
Остановка сердца происходит при еще сохранившемся некотором
количестве АТФ. Эта энергия расходуется на поддержание целостности структур
кардиомиоцитов, сохранение ионных градиентов, так как выключается наиболее энергоемкая функция - сократимость. В этом проявляется эффект самозащиты сердца, так как "нерастраченная" на сокращение АТФ обеспечивает сохранение жизнеспособности кардиомиоцитов. И, если гипоксия будет ликвидирована, то сохранившиеся кардиомиоциты вновь включаются в выполнение своей нагнетательной функции.В связи с этим данный период еще называется периодом выживания. Этот период продолжается не более 5 мин.
Слайд 13
Реперфузия
После остановки сердца восстановление кровотока так же сопровождается
существенными сдвигами его физиологических характеристик. Можно указать на несколько
основных механизмов, приводящих к этому.Для того, чтобы реперфузия привела к восстановлению функции кардиомиоцитов необходимо сохранение в них определенного уровня макроэргов. Если уровень АТФ не снижался ниже 5 мМ/г сухой ткани, то восстановление подачи кислорода не приведет к развитию клеточных аномалий.
А вот при понижении АТФ ниже 2 мМ/г реоксигенация или реперфузия напротив даже ускорят начавшийся процесс разрушения мембран.
Причем снижение способности митохондрий при ишемии синтезировать АТФ при реперфузии усугубляется параллельно повышению концентрации внутриклеточного кальция.
Слайд 14
Кальций и реперфузия
Вследствие того, что кальций является одним
из внутриклеточных регуляторов, мессенжеров, то возрастание уровня свободных ионов
кальция в цитозоле приводит к активации кальций-чувствительных протеаз и фосфолипаз, что вызывает необратимые изменения структуры и целостности сарколеммы и других мембранных структур.А это, в свою очередь, приводит к дальнейшему поступлению кальция в саркоплазму, как из внеклеточного пространства, так и из внутриклеточных депо. Это может вести к росту свободного кальция в цитозоле даже при сохранении суммарного его содержания в кардиомиоцитах.
Увеличение концентрации кальция (и связанного с ним натрия) и падение рН в цитозоле кардиомиоцитов вызывает разобщение клеток в результате повышения сопротивления нексусов. Кроме того, рост концентрации свободного кальция в цитозоле приводит к нарушению процессов сопряжения возбуждения и сокращения клеток.
Вот почему опасность поступления кальция в цитозоль из внеклеточной среды диктует необходимость не применения ионов кальция в реперфузионной жидкости.
Слайд 15
Гипоксия и кальций
В тоже время наиболее часто при
ишемии происходят изменения именно кальциевого трансмембранного транспорта.
Снижение уровня
АТФ и КФ при гипоксии приводит к падению активности кальциевого насоса (эта помпа наиболее энергоемка) как на сарколемме кардиомиоцитов, так и в саркоплазматическом ретикулуме их. Поэтому резко уменьшается выведение этого иона из цитозоля. В результате клетки перегружаются свободным кальцием. Примечательно, что это происходит как при гипоксии, так и после ее снятия при реперфузии.
Слайд 16
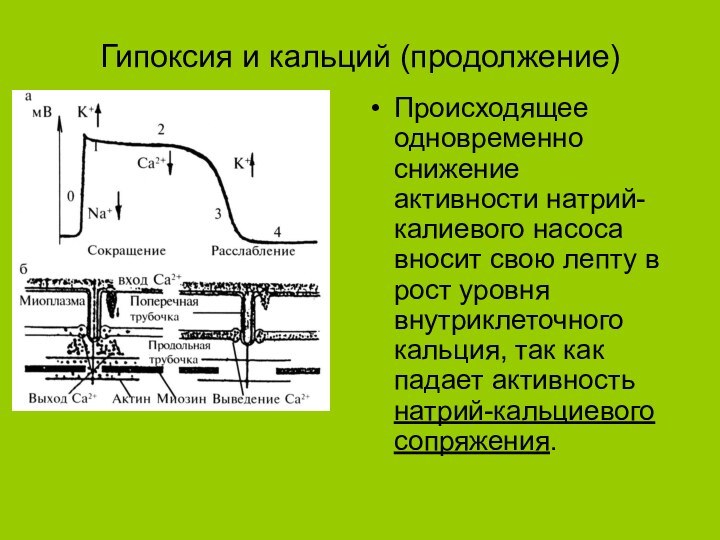
Гипоксия и кальций (продолжение)
Происходящее одновременно снижение активности натрий-калиевого
насоса вносит свою лепту в рост уровня внутриклеточного кальция,
так как падает активность натрий-кальциевого сопряжения.
Слайд 17
Гипоксия и ионы калия
При гипоксии происходит утечка ионов
калия из клетки, что приводит к понижению уровня мембранного
потенциала. Потеря калия при гипоксии обусловлена:снижением активности натрий-калиевой помпы (мало АТФ),
возрастанием в клетке концентрации свободного кальция (так как он также хуже откачивается),
влиянием самого возросшего внеклеточного калия, что само по себе дополнительно повышает проницаемость мембраны для этого иона.
Слайд 18
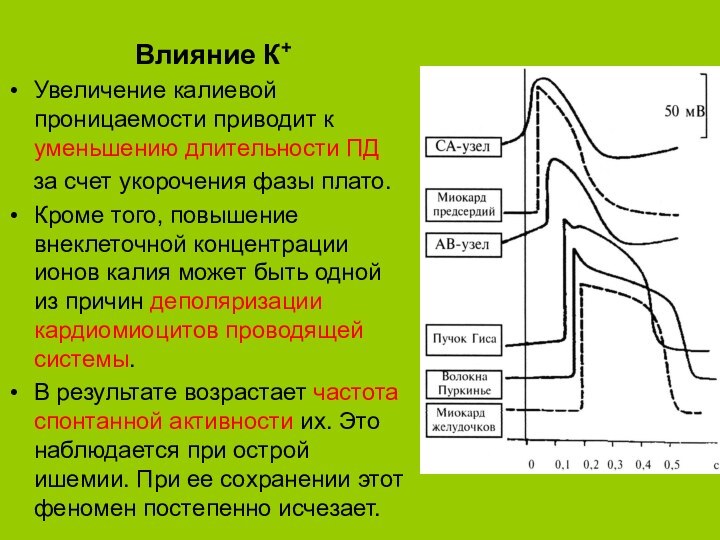
Влияние К+
Увеличение калиевой проницаемости приводит к уменьшению длительности
ПД
за счет укорочения фазы плато.
Кроме того,
повышение внеклеточной концентрации ионов калия может быть одной из причин деполяризации кардиомиоцитов проводящей системы. В результате возрастает частота спонтанной активности их. Это наблюдается при острой ишемии. При ее сохранении этот феномен постепенно исчезает.
Слайд 19
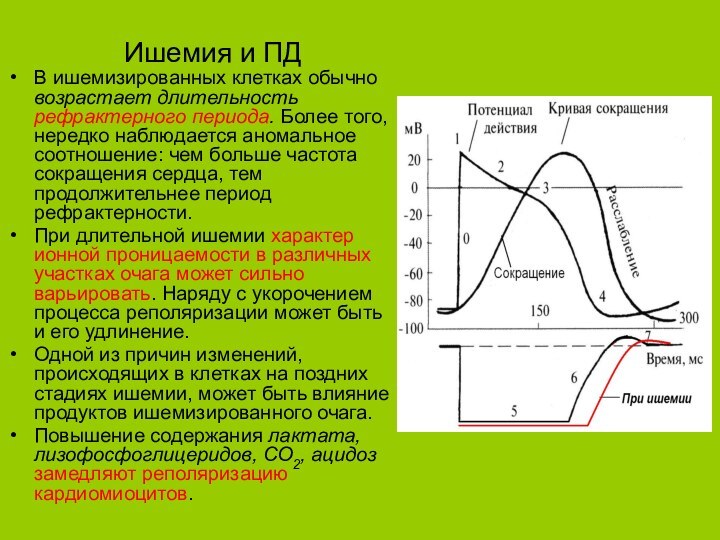
Ишемия и ПД
В ишемизированных клетках обычно возрастает длительность
рефрактерного периода. Более того, нередко наблюдается аномальное соотношение: чем
больше частота сокращения сердца, тем продолжительнее период рефрактерности.При длительной ишемии характер ионной проницаемости в различных участках очага может сильно варьировать. Наряду с укорочением процесса реполяризации может быть и его удлинение.
Одной из причин изменений, происходящих в клетках на поздних стадиях ишемии, может быть влияние продуктов ишемизированного очага.
Повышение содержания лактата, лизофосфоглицеридов, СО2, ацидоз замедляют реполяризацию кардиомиоцитов.
Слайд 20
Инфаркт миокарда и напряжение в стенке сердца.
Согласно закону
Лапласа, повышение давления внутри желудочков при сокращении связано с
уменьшением их размеров. При этом рост давления миокарда на кровь сопровождается развитием напряжения в самой стенке, величина которого может быть определена по формуле:Рt = F⋅2d/r,
где: Рt - давление, F - напряжение в стенке сердца, d - толщина стенки, r - радиус.
Поэтому с возрастанием давления напряжение стенки увеличивается.
Исходя из указанной формулы, напряжение растет пропорционально радиусу и обратно пропорционально толщине стенки (см. формулу):
F = Рt⋅r/2d
Слайд 21
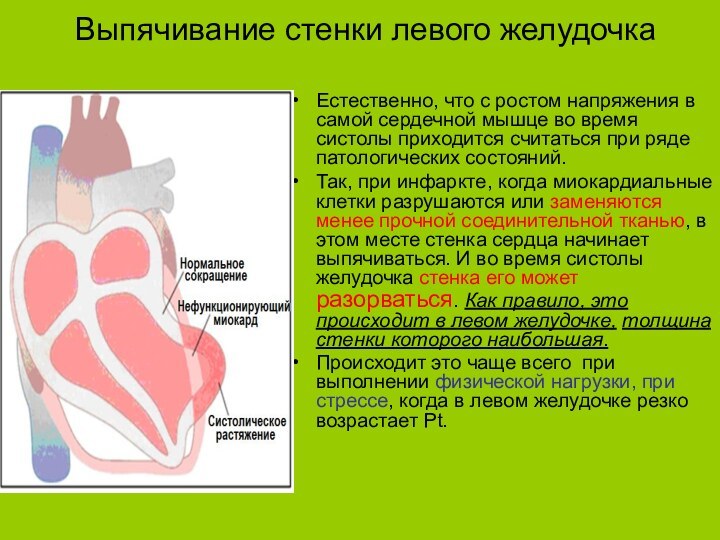
Выпячивание стенки левого желудочка
Естественно, что с ростом напряжения
в самой сердечной мышце во время систолы приходится считаться
при ряде патологических состояний.Так, при инфаркте, когда миокардиальные клетки разрушаются или заменяются менее прочной соединительной тканью, в этом месте стенка сердца начинает выпячиваться. И во время систолы желудочка стенка его может разорваться. Как правило, это происходит в левом желудочке, толщина стенки которого наибольшая.
Происходит это чаще всего при выполнении физической нагрузки, при стрессе, когда в левом желудочке резко возрастает Рt.
Слайд 22
Организм и недостаточность кровообращения
При нарушении кровообращения можно выделить
три основные группы механизмов в зависимости от времени включения
и скорости компенсации возникших изменений функции сердечно-сосудистой системы.Быстрая регуляция (секунды или минуты). Эти механизмы состоят из нейрорефлекторных звеньев:
- барорецепторов,
- хеморецепторов,
- центров регуляции, включающихся в результате ишемии мозга.
Промежуточная регуляция (от 30 минут до нескольких часов). В основе механизмов, осуществляющих этот тип приспособления, лежат:
- ренин-ангиотензин-вазоконстрикторный механизм,
- стресс-реакция состояния сосудов,
- обмен жидкости в микроциркуляторном русле.
Долговременная регуляция (дни). Главная роль в организации данного типа приспособительных реакций принадлежит почкам.
- Здесь проявляется ренин-ангиотензин-альдостероновый механизм, обеспечивающий регуляции уровня воды и солей в крови, их выделение.
- Кроме того, сюда подключаются различные рефлекторные и другие гуморальные механизмы.
Слайд 23
Венозный возврат крови к сердцу
Большое значение в кровообращении
играет венозный возврат крови к сердцу. Все воздействия, приводящие
к повышению артериального давления, одновременно повышают и венозный возврат. Это наблюдается при прессорном синокаротидном рефлексе, увеличении объема циркулирующей крови, внутривенном введении вазоактивных препаратов (адреналина, простагландина Р2, ангиотензина II).В противоположность прессорным депрессорные системные реакции могут сопровождаться как уменьшением, так и возрастанием венозного возврата. Так, при депрессорном синокаротидном рефлексе (при росте давления в каротидной зоне), при ишемии миокарда, уменьшении ОЦК происходят однонаправленные изменения системной гемодинамики и венозного возврата.
В отличие от этого при дыхательной (гипоксической) гипоксии, стимуляции β-адренорецепторов, поступлении простагландина Е1, брадикинина системные депрессорные реакции могут сопровождаться возрастанием притока крови к сердцу по полым венам.
Кстати, купирование коронарной недостаточности или приступов ишемической болезни с помощью нитратов обусловлено не столько расширением просвета коронарных сосудов, сколько значительным увеличением венозного возврата.
Слайд 24
Но венозный возврат зависит также и от состояния
самого сердца. Так, величина центрального венозного давления (то есть
давления в правом предсердии) оказывает существенное влияние на величину венозного возврата крови к сердцу. При снижении давления в правом предсердии от 0 до -4 мм рт.ст. приток крови возрастает на 20-30%. Но дальнейшее снижение давления уже не вызывает прироста притока крови, так как при таком низком давлении спадаются вены, находящиеся в грудной полости.Прирост центрального венозного давления всего на 1 мм рт.ст. приведет к снижению притока на 14%. И, к примеру, при давлении крови в правом предсердии равном 7 мм рт.ст. венозный возврат теоретически может снизиться до 0. Но этому обычно препятствуют механизмы рефлекторной регуляции гемодинамики. Снижение притока крови приводит к проявлению компенсаторных реакций как через барорецепторы артерий, так и путем возбуждения сосудодвигательных центров в условиях гипоксии мозга.
Результатом этих воздействий будут рефлекторные реакции, приводящие к сужению сосудов - уменьшению сосудистого русла (здесь «сработает» система венозного депо) и возрастанию поступления крови к сердцу. Но при этом необходимо учитывать и состояние гемодинамики самого миокарда. Допустимое давление в правом предсердии не может быть выше 100-120 мм вод.ст., так как это приведет к необратимому ухудшению функционального состояния миокарда.
Слайд 26
Нарушение возбудимости и проводимости
Среди прочих механизмов патологии кровообращения,
обусловленной недостаточностью сердца, нарушение возбудимости и проводимости его происходят
особенно часто. Основной их причиной является патология в элементах проводящей системы, клетках синусного узла (нарушается возбудимость и автоматизм) или путях проведения импульсов от узлов к миокарду желудочков (нарушение проводимости), ионные изменения.
Слайд 27
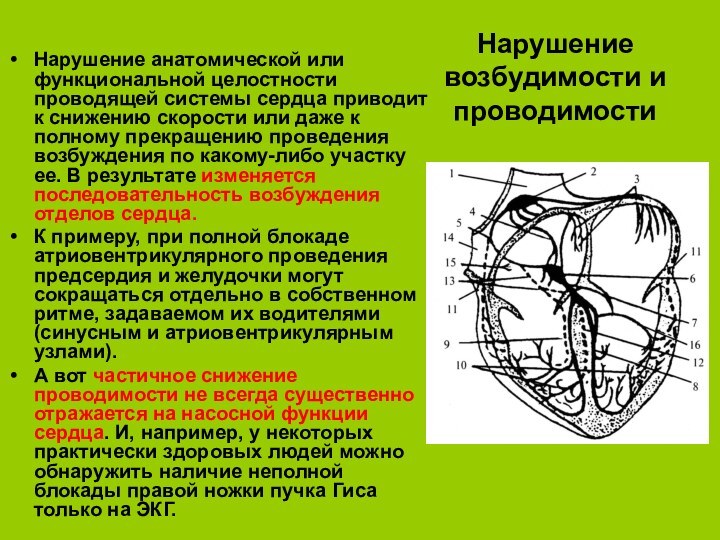
Нарушение возбудимости и проводимости
Нарушение анатомической или функциональной целостности
проводящей системы сердца приводит к снижению скорости или даже
к полному прекращению проведения возбуждения по какому-либо участку ее. В результате изменяется последовательность возбуждения отделов сердца.К примеру, при полной блокаде атриовентрикулярного проведения предсердия и желудочки могут сокращаться отдельно в собственном ритме, задаваемом их водителями (синусным и атриовентрикулярным узлами).
А вот частичное снижение проводимости не всегда существенно отражается на насосной функции сердца. И, например, у некоторых практически здоровых людей можно обнаружить наличие неполной блокады правой ножки пучка Гиса только на ЭКГ.
Слайд 28
Аберрантность
При нарушении возбудимости и проводимости проявляется еще одно
физиологическое свойство миокарда - аберрантность.
Аберрантность это патологическое проведение
импульсов по предсердиям и желудочкам. Оно возникает в тех случаях, когда импульс, поступающий в соответствующий отдел сердца, застает один или несколько пучков проводящей системы в состоянии рефрактерности. А это, естественно, изменяет направленность и скорость распространения возбуждения. К примеру, при блокаде правой ножки пучка Гиса возбуждение своевременно к миокарду правого желудочка поступать не может. В результате к правому желудочку и правой половине межжелудочковой перегородки возбуждение поступает необычным путем: от сократимых миоцитов левого желудочка. И при этом возбуждение в правом желудочке начинается позже, чем в левом, то запаздывает и начало его сокращения.
Слайд 29
Механизмы нарушения ритма сердца
Можно выделить три основных механизма
изменения ритмичности в водителях сердечного ритма:
1) увеличение или уменьшение
скорости спонтанной деполяризации,2) колебания порога возбудимости,
3) колебания уровня потенциала покоя.
Слайд 30
I. Нарушение образования импульсов.
Основные причины этого:
усиление или угнетение
автоматизма клеток синусного узла,
усиление автоматизма латентных водителей ритма,
возникновение автоматизма
в поврежденных сократительных клетках,замедление реполяризации клеточных мембран,
асинхронная реполяризация,
частичная деполяризация некоторых клеток и возникновение местной разности потенциалов.
Слайд 31
II. Нарушение проведения импульсов.
Физиологических механизмов, приводящих к нарушению
проведения импульсов, много. В качестве основных можно выделить следующие:
состояние
рефрактерности,анатомические (органические) повреждения и дефекты проводящей системы,
частичная деполяризация клеточных мембран,
неполная реполяризация (гипополяризация) клеточных мембран,
снижение возбудимости,
изменение характера электрического ответа клеточных мембран,
скрытое проведение потенциала действия,
супернормальное проведение импульсов.
Слайд 32
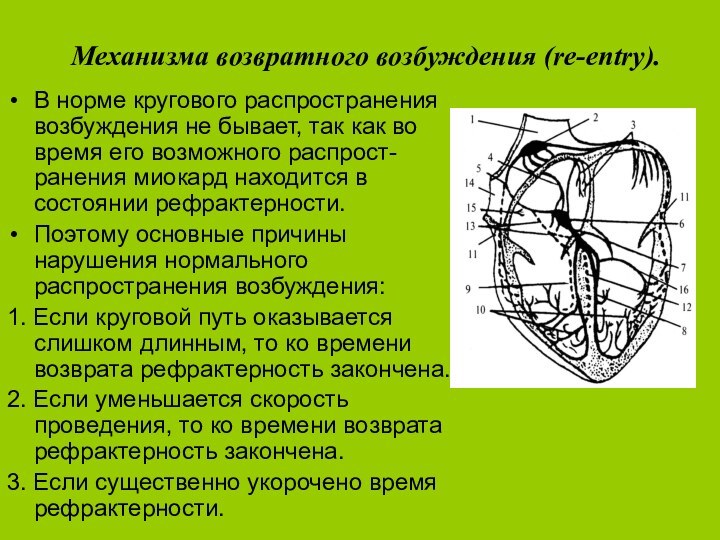
Механизма возвратного возбуждения (re-entry).
В норме кругового распространения возбуждения
не бывает, так как во время его возможного распрост-ранения
миокард находится в состоянии рефрактерности.Поэтому основные причины нарушения нормального распространения возбуждения:
1. Если круговой путь оказывается слишком длинным, то ко времени возврата рефрактерность закончена.
2. Если уменьшается скорость проведения, то ко времени возврата рефрактерность закончена.
3. Если существенно укорочено время рефрактерности.
Слайд 33
Механизма возвратного возбуждения (re-entry).
Причиной появления повторного входа
волны возбуждения или возвратного (re-entry) возбуждения может быть локальное
нарушение проведения импульсов (результат инфаркта, развития склеротической бляшки, рубца и т.п.). При этом место возвратного возбуждения должно быть возбудимым, иначе из-за рефрактерности миокарда пришедшая сюда "окольным" путем волна была бы также приостановлена.В ряде случаев АВ-блокада проведения возбуждения также может способствовать возникновению re-entry с участием АВ-узла.
Слайд 34
Условия возникновения возвратного возбуждения (re-entry).
К примеру,
эти условия возникают при:
удлинении пути при дилатации сердца;
уменьшении скорости
проведения (при блокаде волокон Пуркинье, ишемии миокарда, гиперкалиемии, и. т.д)укорочении рефрактерности, например, под влиянием норадреналина.
Слайд 35
Гипоксия миокарда и эктопический ритмогенез
Источник эктопической активности может
появиться и в зоне ишемии миокарда. Наиболее частой причиной
его является рециркуляция возбуждения. К примеру, распространяющийся как обычно по миокарду ПД спадает при попадании на ишемизированный участок, находящийся в состоянии рефрактерности. Поэтому после завершения рефрактерного периода эта зона может быть возбуждена поступающим сюда новым потенциалом действия, идущим в противоположном направлении, скорость распространения которого была меньше.
Слайд 36
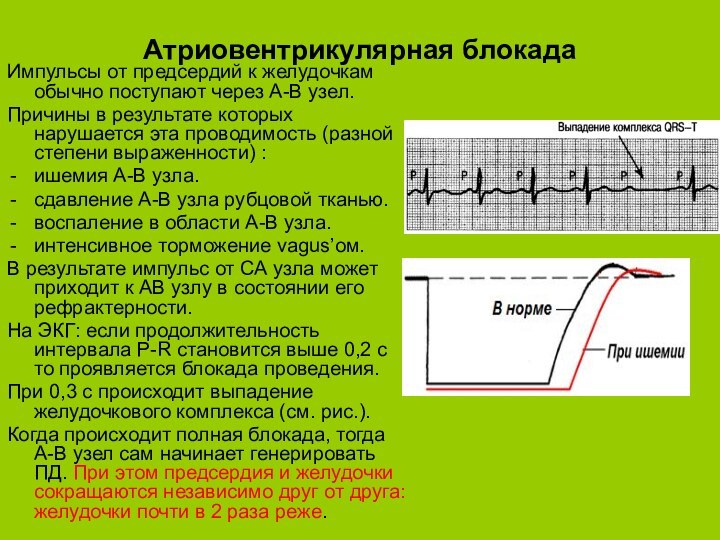
Атриовентрикулярная блокада
Импульсы от предсердий к желудочкам обычно поступают
через А-В узел.
Причины в результате которых нарушается эта
проводимость (разной степени выраженности) :ишемия А-В узла.
сдавление А-В узла рубцовой тканью.
воспаление в области А-В узла.
интенсивное торможение vagus’ом.
В результате импульс от СА узла может приходит к АВ узлу в состоянии его рефрактерности.
На ЭКГ: если продолжительность интервала P-R становится выше 0,2 с то проявляется блокада проведения.
При 0,3 с происходит выпадение желудочкового комплекса (см. рис.).
Когда происходит полная блокада, тогда А-В узел сам начинает генерировать ПД. При этом предсердия и желудочки сокращаются независимо друг от друга: желудочки почти в 2 раза реже.