- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Стволовые клетки
Содержание
- 3. ЭмбриональныеФетальныеСК пуповинной кровиСК взрослого человека
- 4. Человеческий эмбрион (6 дней после оплодотврения) Плюрипотентные
- 5. Эритроциты – первые специализированные клетки, полученные из
- 6. Нобелевский комитет назвал нового лауреата Нобелевской премии
- 7. Американские ученые обнаружили, что искусственное оплодотворение нарушают
- 8. Индуцированные стволовые клетки (иСК) — стволовые клетки) — стволовые клетки, полученные из
- 9. В настоящее время существует три пути перепрограммирования
- 10. 1. Что такое индуцированные плюрипотентные стволовые клетки?
- 11. Индуцированные плюрипотентные стволовые клетки - вид плюрипотентных
- 12. Считают, что индуцированные плюрипотентные стволовые клетки
- 13. Схема получения индуцированных плюрипотентных клеток. (1)
- 14. 2. Плюрипотентные стволовые клетки
- 15. Стволовые клетки имеют 2 важные характеристики,
- 17. 1. Тотипотентные стволовые клетки получают из слияния
- 18. Иерархия стволовых клеток: сначала тотипотентная клетка становится
- 19. 3. Перепрограммирование соматических клеток
- 20. Основной метод перепрограммирования для получения iPS-клеток -
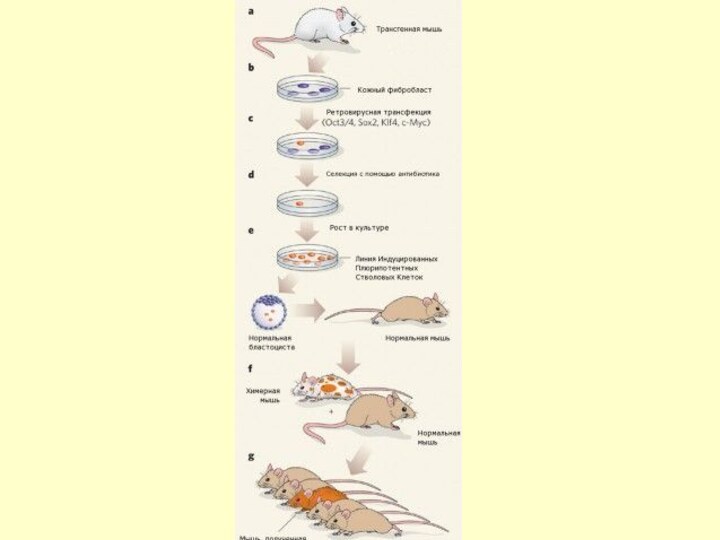
- 21. 4. Первые iPS-клетки
- 22. Индуцированные плюрипотентные стволовые клетки впервые были получены
- 23. 5. Следующее поколение iPS-клеток
- 24. В июне 2007 группа Яманака опубликовала статью,
- 26. 6. Подтверждение принципа
- 27. Мыши, больные человеческой серповидноклеточной анемией, были вылечены
- 28. 7. Индуцированные плюрипотентные стволовые клетки человека
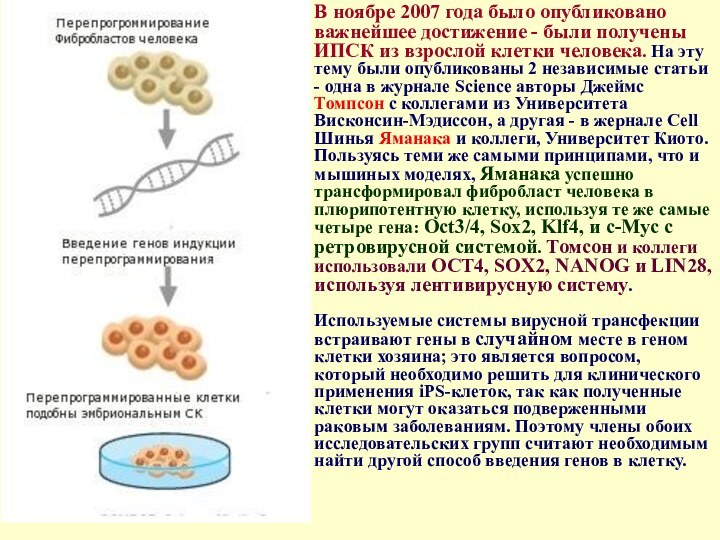
- 29. В ноябре 2007 года было опубликовано важнейшее
- 30. 8. Гены индукции
- 31. Ключевые гены для индукции генерации iPS-клеток.
- 32. * Семейство Sox: Семейство генов Sox,
- 33. * Nanog: в ЭСК Nanog, наряду
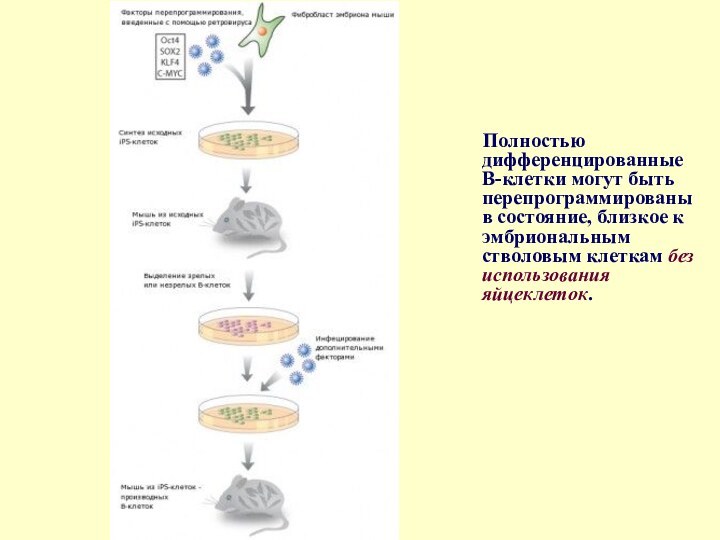
- 34. 9. Полностью дифференцированные В-клетки перепрограммированы в iPS-клетки
- 35. Ранее сообщалось о создании индуцированных плюрипотентных клеток
- 36. Jacob Hanna и его коллеги начали
- 37. Полностью дифференцированные В-клетки могут быть перепрограммированы в
- 38. 10. Перепрограммирование клеток печени и желудка мышей
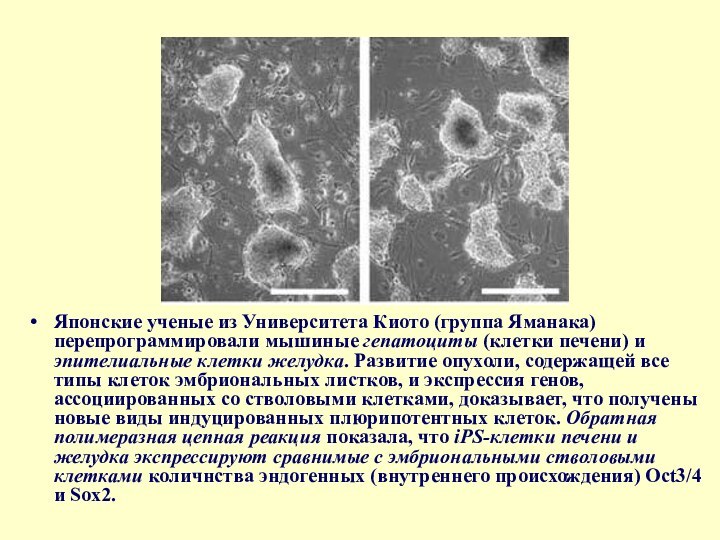
- 39. Японские ученые из Университета Киото (группа Яманака)
- 40. Ученые использовали тот же набор генов
- 41. 11. Перепрограммирование без генетической модуляции: фантазия или реальность?
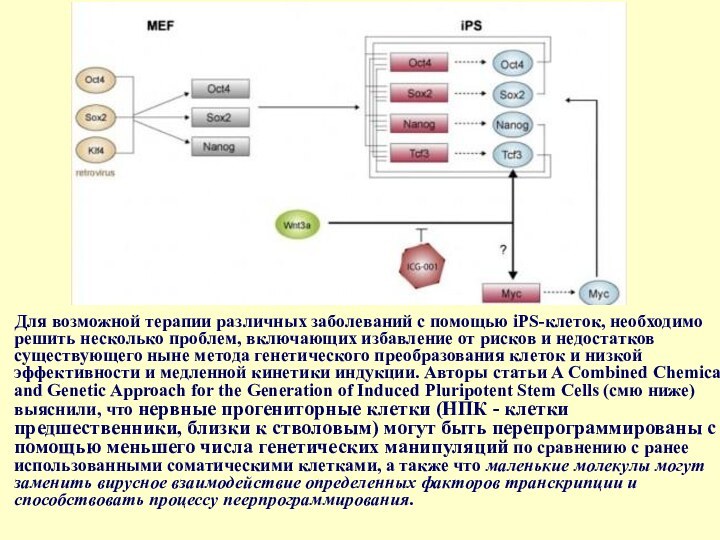
- 42. Для возможной терапии различных заболеваний с помощью
- 43. 12. Чем же так важны индуцированные плюрипотентные клетки?
- 44. Получение индуцированных плюрипотентных стволовых клеток из дифференцированных
- 45. Пример Авторы недавней статьи получили iPS-клетки из
- 47. Возможности и проблемы использования человеческих плюрипотентных стволовых
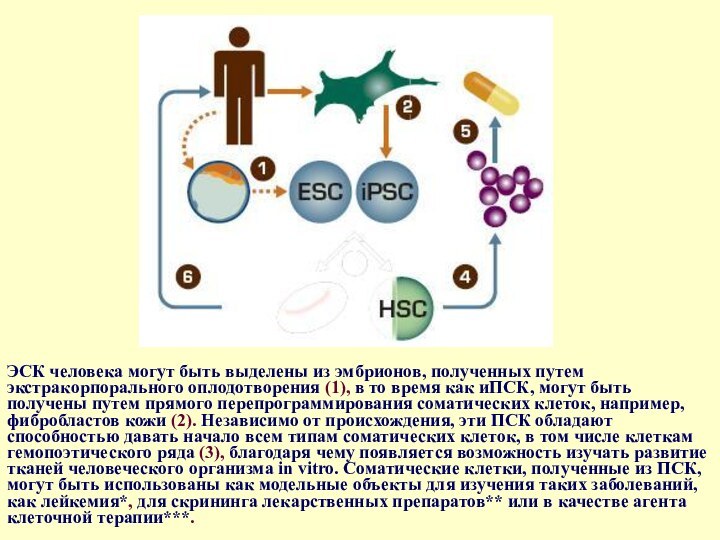
- 48. ЭСК человека могут быть выделены из эмбрионов,
- 49. Области применения стволовых клетокИспользование человеческих ПСК для
- 50. Терапевтическое применение человеческих ПСК Считается, что аутологичные
- 51. Основная задача этого пилотного испытания –
- 52. О перспективах
- 53. Продвижение методов лечения, основанных на ПСК человека,
- 54. Как образуется кожа? Стволовые клетки, находящиеся в
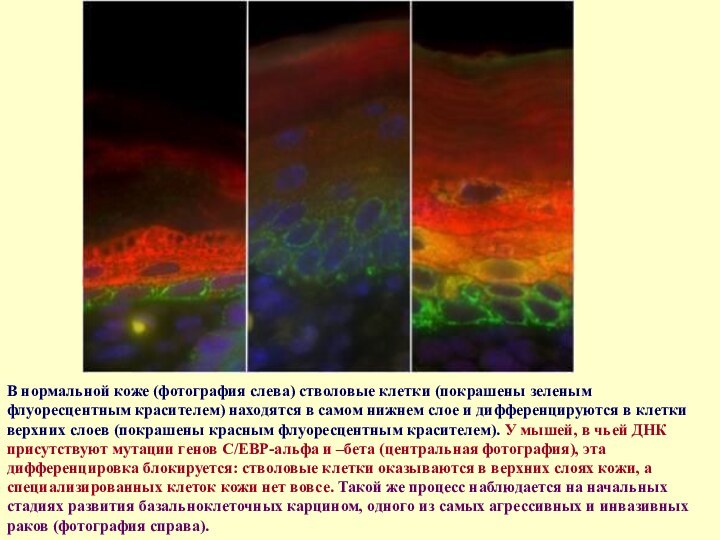
- 55. В нормальной коже (фотография слева) стволовые клетки
- 56. Когда в коже присутствует белок C/EBP-бета, потерявший
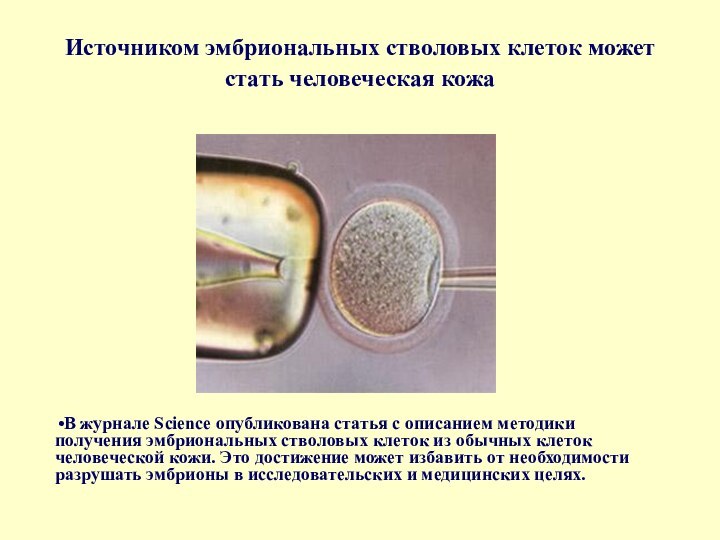
- 57. Источником эмбриональных стволовых клеток может стать человеческая
- 58. Разработали методику, при которой донорская эмбриональная стволовая
- 59. Клетки кожи, превращенные таким образом в ЭСК
- 60. Китайцы впервые вырастили мышат из «притворяющихся» клеток
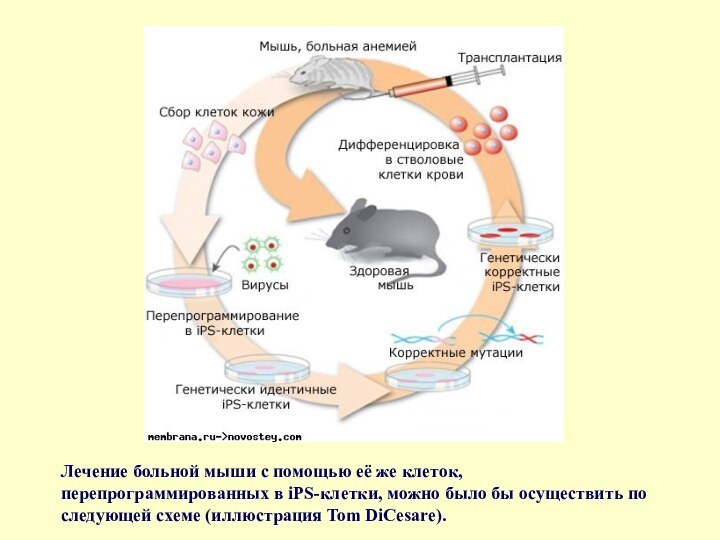
- 61. Лечение больной мыши с помощью её же
- 62. iPS-клетки — разновидность "взрослых" стволовых клеток. Индуцированными
- 63. С самого начала было ясно, что вроде
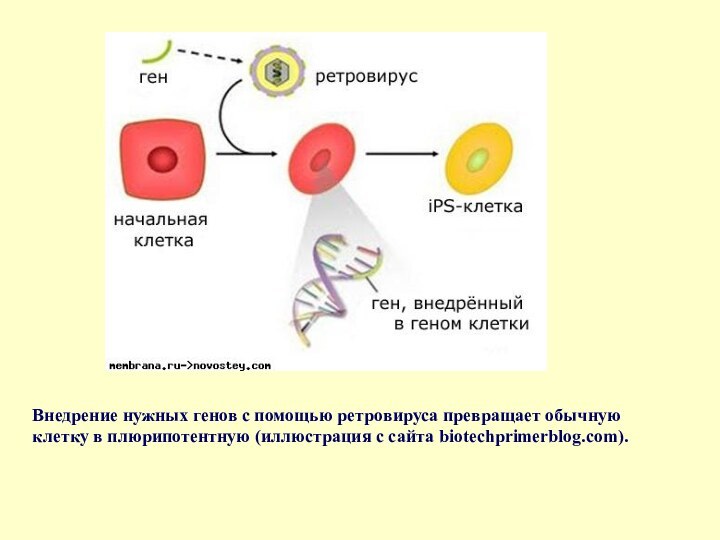
- 64. Внедрение нужных генов с помощью ретровируса превращает обычную клетку в плюрипотентную (иллюстрация с сайта biotechprimerblog.com).
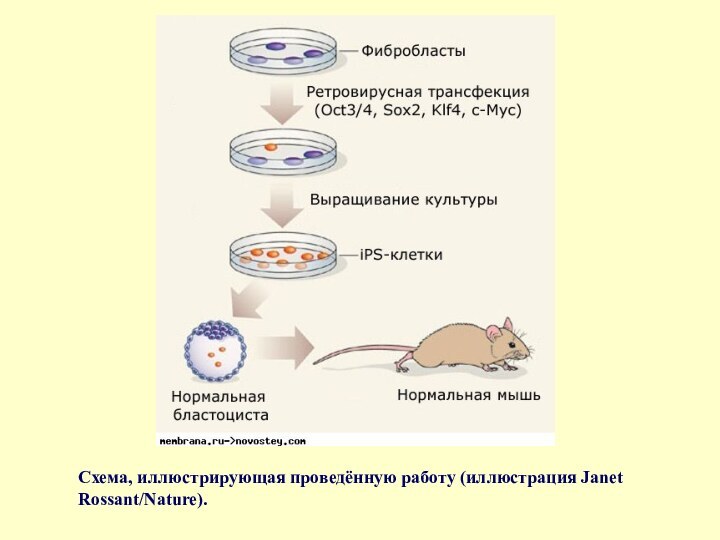
- 65. Схема, иллюстрирующая проведённую работу (иллюстрация Janet Rossant/Nature).
- 66. Следующим шагом было создание тетраплоидного эмбриона (для
- 67. Однако для полной уверенности были проведены ДНК-тесты,
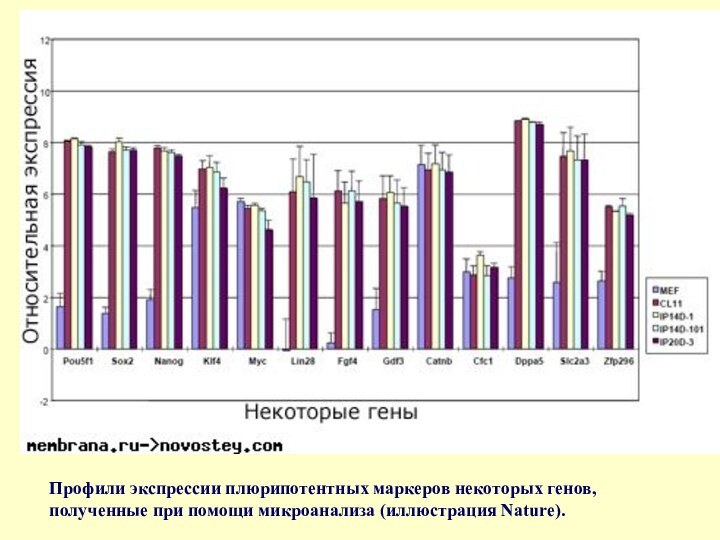
- 68. Профили экспрессии плюрипотентных маркеров некоторых генов, полученные при помощи микроанализа (иллюстрация Nature).
- 69. Кариотипический анализ iPS-клеток показал, что примерно у
- 70. К моменту выхода статьи у учёных было
- 71. Впрочем, не всё так уж и плохо.
- 72. Яманака тоже продолжает свои исследования. Недавно он
- 73. То, что разница есть, никто уже не
- 74. Если даже попробовать осуществить такой же процесс
- 75. Ученые разработали новый метод получения стволовых клеток
- 76. Американские ученые разработали новый метод получения стволовых
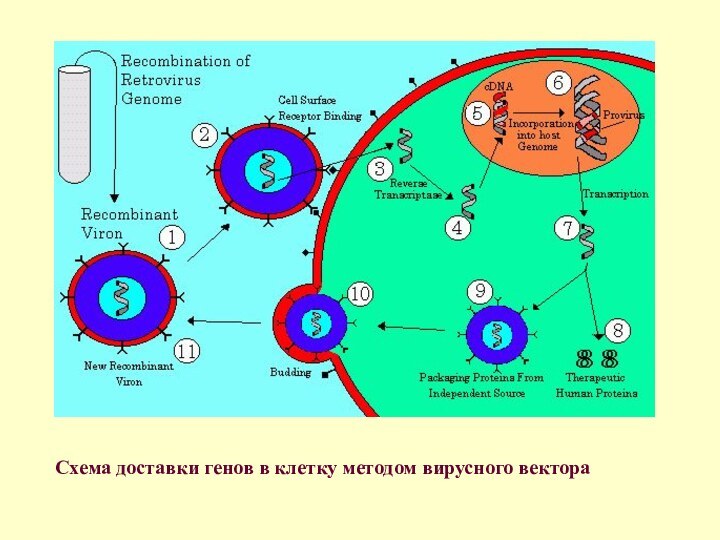
- 77. Схема доставки генов в клетку методом вирусного вектора
- 78. Экспрессия собственных (эндогенных) эмбриональных генов в колониях полученных
- 79. Ученые отмечают очень низкую эффективность аденовирусного перепрограммирования
- 80. ЭТИКАСразу две независимые группы исследователей опубликовали в
- 81. На сегодняшний день большую часть эмбриональных стволовых
- 82. «Эта процедура проводилась сотни тысяч раз, — говорит
- 83. Следующий этап — получение человеческих ЭСК. Для начала
- 84. Джениш и Мейсснер разрешили эту щекотливую ситуацию,
- 85. Скачать презентацию
- 86. Похожие презентации













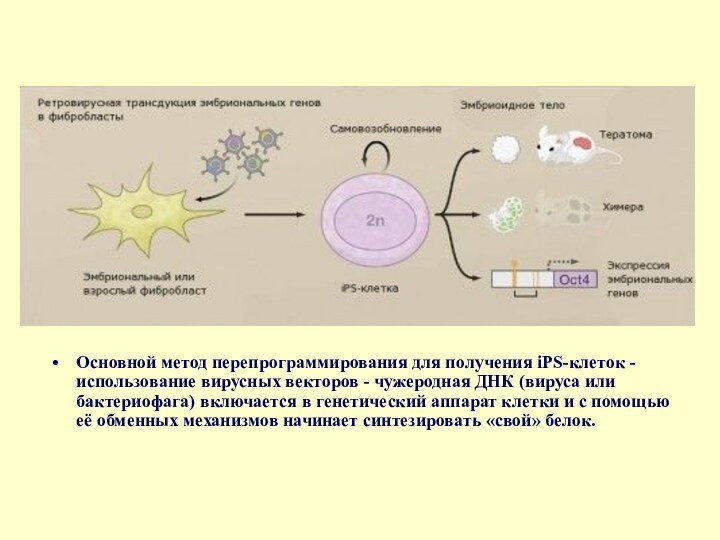












































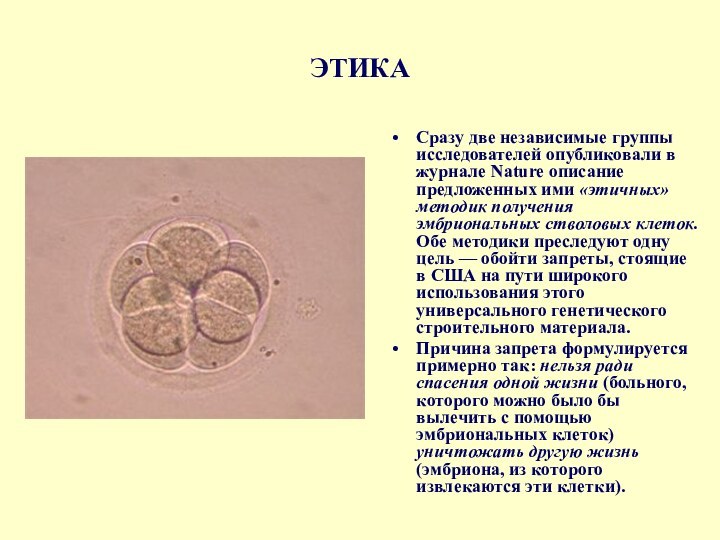





Слайд 4
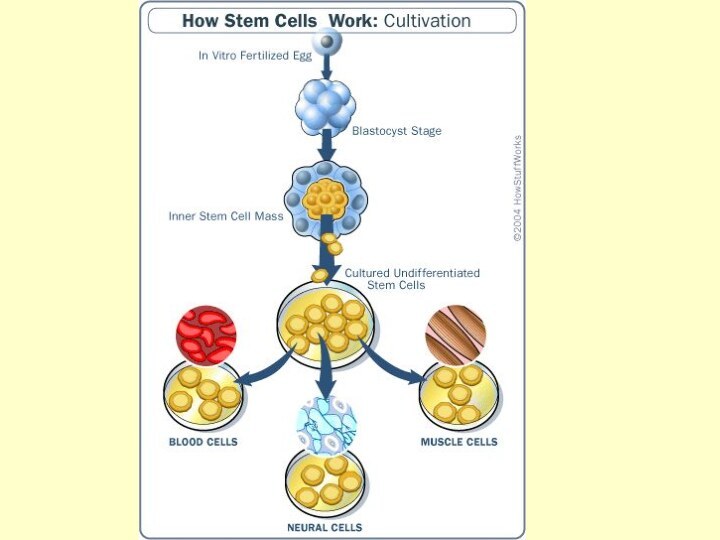
Человеческий эмбрион (6 дней после оплодотврения)
Плюрипотентные зародышевые
клетки, полученные из крови пуповины человека
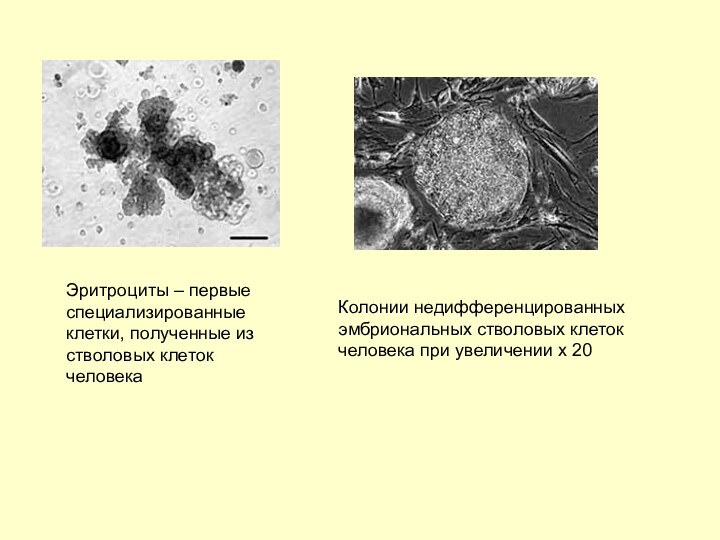
мозга человека (электронная микрофотография)Слайд 5 Эритроциты – первые специализированные клетки, полученные из стволовых
клеток человека
Колонии недифференцированных эмбриональных стволовых клеток человека при
увеличении х 20 Слайд 6 Нобелевский комитет назвал нового лауреата Нобелевской премии по
медицине и физиологии. Наиболее престижную научную премию получил 85-летний
британский эмбриолог Роберт Эдвардс, разработавший технологию экстракорпорального оплодотворения (ЭКО). Проще говоря, ЭКО - это «зачатие в пробирке».Исследования Эдвардса и его соавтора, врача Патрика Стептоу, скончавшегося в 1988 году, сделали возможным лечение бесплодия, от которого страдают около 10% пар по всему миру и позволили миллионам семей обзавестись потомством.
Слайд 7 Американские ученые обнаружили, что искусственное оплодотворение нарушают работу
генов, ответственных за обмен веществ и транспорт питательных соединений
(нутриентов) в плацентах мышей. Результаты исследования помогают понять, почему "дети из пробирки" чаще страдают обменными нарушениями, такими как ожирение, артериальная гипертония и повышенный уровень глюкозы в кровиСлайд 8 Индуцированные стволовые клетки (иСК) — стволовые клетки) — стволовые клетки, полученные из каких-либо
иных (соматических) — стволовые клетки, полученные из каких-либо иных (соматических, репродуктивных) — стволовые клетки,
полученные из каких-либо иных (соматических, репродуктивных или плюрипотентных) — стволовые клетки, полученные из каких-либо иных (соматических, репродуктивных или плюрипотентных) клеток путём эпигенетического перепрограммирования.В зависимости от степени дедифференцировки клетки при перепрограммировании различают:
индуцированные тотипотентные,
индуцированные плюрипотентные стволовые клетки (ИПСК) и
получаемые так называемым прямым перепрограммированиемполучаемые так называемым прямым перепрограммированием или каким-либо иным способом индуцированные прогениторныеполучаемые так называемым прямым перепрограммированием или каким-либо иным способом индуцированные прогениторные (мультипотентные или унипотентные) стволовые клетки, иногда называемые также индуцированными соматическими стволовыми клетками (ИССК).
Слайд 9 В настоящее время существует три пути перепрограммирования соматических
клеток в плюрипотентные стволовые клетки:
пересадка ядер, взятых из соматических
клеток, в оплодотворенную яйцеклетку, из которой предварительно удалено ядрослияние соматических клеток с плюрипотентными стволовыми клетками;
модификация соматической клетки, индуцирующая её превращение в стволовую клетку, с помощью: генетического материала, кодирующего белковые репрограммирующие факторы; рекомбинантных белков; микроРНК, синтетической самореплицирующейся полицистронной РНК и низкомолекулярных биологически активных веществ.
Слайд 11 Индуцированные плюрипотентные стволовые клетки - вид плюрипотентных стволовых
клеток, искусственно полученных из неплюрипотентных клеток, обычно из взрослых
спматических клеток, путем "вынужденной" индукции (процесс запуска транскрипции гена или белка вследствие действия определенного фактора-индуктора) определенных генов. Этот процесс осуществляется путем трансфекции (процесс переноса генетического материала в клетку с помощью вирусных векторов) определенных генов стволовых клеток в неплюрипотентную клетку человека, такую как фибробласт, с помощью вирусных векторов (ретровирусов).Слайд 12 Считают, что индуцированные плюрипотентные стволовые клетки (iPS-клетки) идентичны
натуральным плюрипотентным стволовым клеткам, таким как эмбриональные стволовые клетки
(стволовые клетки, полученные из внутренней клеточной массы бластоцисты - эмбриона на ранней стадии развития), по многим показателям, таким как экспрессия определенных генов и белков стволовых клеток, места (паттерны) метилирования хроматина, время удвоения, формирование эмбриоидных тел (агрегаты эмбриональных стволовых клеток, образующиеся после помещения этих клеток в культуру), формирование тератомы (опухоли из клеток всех трех эмбриональных слоев), формирование жизнеспособных химер (животных, состоящих из клеточных клонов двух разных типов: клеток исходного родительского генотипа и iPS-клеткок) и способность дифференцироваться, однако в полной мере их идентичность с натуральными плюрипотентными стволовыми клетками все еще оценивается. Впервые iPS-клетки были синтезированы их клеток мыши в 2006 году, а из клеток человека - в 2007. Это открытие является прорывом в исследовании стволовых клеток, так как оно позволяет получать плюрипотентные стволовые клетки без использования эмбрионов.
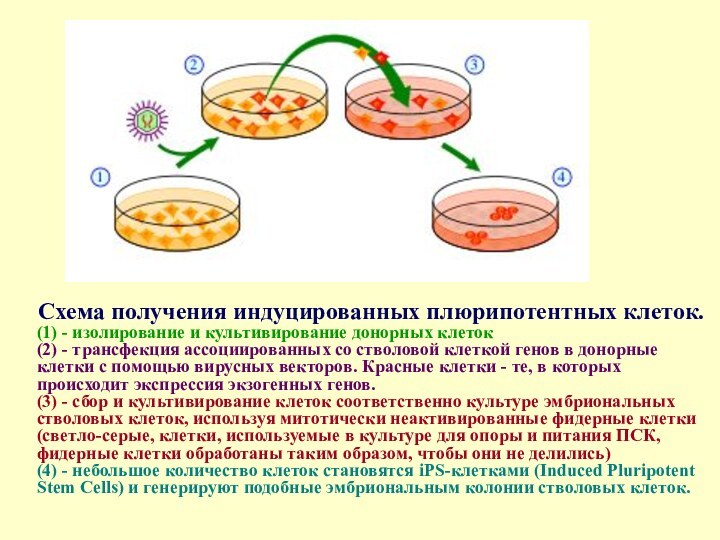
Слайд 13
Схема получения индуцированных плюрипотентных клеток.
(1) - изолирование
и культивирование донорных клеток (2) - трансфекция ассоциированных со стволовой
клеткой генов в донорные клетки с помощью вирусных векторов. Красные клетки - те, в которых происходит экспрессия экзогенных генов. (3) - сбор и культивирование клеток соответственно культуре эмбриональных стволовых клеток, используя митотически неактивированные фидерные клетки (светло-серые, клетки, используемые в культуре для опоры и питания ПСК, фидерные клетки обработаны таким образом, чтобы они не делились) (4) - небольшое количество клеток становятся iPS-клетками (Induced Pluripotent Stem Cells) и генерируют подобные эмбриональным колонии стволовых клеток.Слайд 15 Стволовые клетки имеют 2 важные характеристики, которые
отличают их от других клеток.
Во-первых, они являются неспециализированными
клетками, которые возобновляют сами себя в течение долгого времени путем клеточного деления.Во-вторых, при определенных физиологических или экспериментальных условиях они могут быть индуцированы для превращения в клетки со специальными функциями, такие как клетки сердечной мышцы или инсулин-синтезирующие клетки поджелудочной железы.
Стволовые клетки различаются своей потентностью - спектром возможных направлений дифференцировки.
Слайд 17 1. Тотипотентные стволовые клетки получают из слияния яйцеклетки
и сперматозоида. Клетки, полученные в результате нескольких первых делений
оплодотворенной яйцеклетки также являются тотипотентными. Эти клетки могут диференцироваться в эмбриональные и экстраэмбриональные (например, клетки плаценты) типы клеток.2. Плюрипотентные клетки происходят от тотипотентных клеток и могут дифференцироваться в любой из трех зародышевых слоев (эндодерма, мезодерма, эктодерма).
3. Мультипотентные стволовые клетки могут производить лишь клетки из близких семейств (например, гематопоэтические стволовые клетки дифференцируются только в красные клетки крови, белые клетки крови, тромбоциты и т.д.)
4. Унипотентные клетки производят только один тип клеток, но имеют свойство само возобновления, что и отличает их от не-стволовых клеток (например, мышечные стволовые клетки).
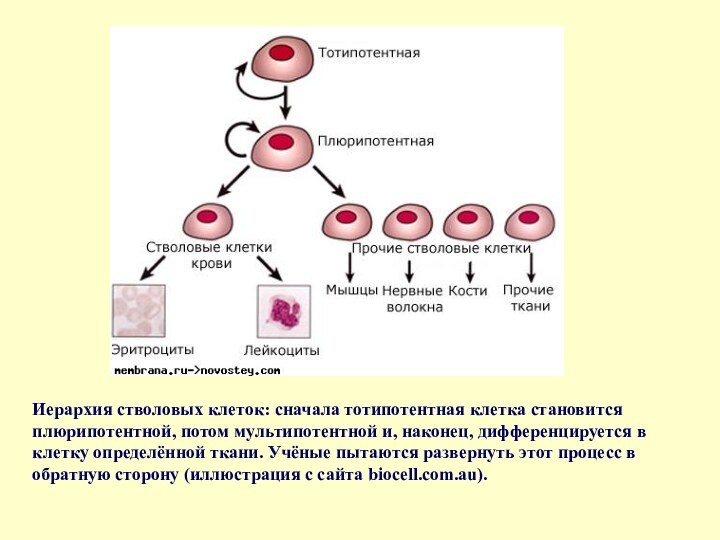
Слайд 18 Иерархия стволовых клеток: сначала тотипотентная клетка становится плюрипотентной,
потом мультипотентной и, наконец, дифференцируется в клетку определённой ткани.
Учёные пытаются развернуть этот процесс в обратную сторону (иллюстрация с сайта biocell.com.au).Слайд 20 Основной метод перепрограммирования для получения iPS-клеток - использование
вирусных векторов - чужеродная ДНК (вируса или бактериофага) включается
в генетический аппарат клетки и с помощью её обменных механизмов начинает синтезировать «свой» белок.Слайд 22 Индуцированные плюрипотентные стволовые клетки впервые были получены командой
Шинья Яманака (Shinya Yamanaka) в Университете Киото, Япония в
2006 году. Яманака определил гены, которые особенно активны в эмбриональных стволовых клетках, и использовала ретровирусы для трансфекции некоторых из этих генов в фибробласт мыши. Таким образом, были выделены 4 ключевых гена плюрипотентности: Oct-3/4, SOX2, c-Myc, и Klf4. Однако эти линии iPS-клеток демонстрировали ошибки при метилировании ДНК при сравнении с местами, где это происходит в обычных эмбриональных стволовых клетках. Также не удалось получить жизнеспособные химерные организмы при введении этих iPS-клеток в развивающиеся эмбрионы.Слайд 24 В июне 2007 группа Яманака опубликовала статью, наряду
еще с двумя другими независимыми группами ученых из Гарварда,
MIT (Rudolf Jaenisch, Marius Wernig) и Университета Калифорнии, Лос Анжесес (James Thomson), в которой было описано успешное перепрограммирование мышиного фибробласта в iPS-клетку а также получение жизнеспособной химерной мыши. Эти клеточные линии были также получены с помощью вирусного внедрения в ДНК тех же четырех плюрипотентных факторов, но на этот раз ученые выбрали другой маркер для детектирования. Вместо Fbx15 они использовали Nanog, который является важным геном в эмбриональных стволовых клетках. Места метилирования ДНК и получение жизнеспособных химер показали, что Nanog - основной определяющий плюрипотентность фактор. К сожалению, один из четырех использованных генов (c-Myc) онкогенный, и у 20% химерных мышей развился рак. Как сообщает Scientific American, Яманака показал, что возможно создание iPS-клеток и без использования c-Myc. Процесс занимает больше времени, и его производительность ниже, но у полученных химер не развился рак. Это подтверждает и Мариус Верниг в своей статье.Слайд 27 Мыши, больные человеческой серповидноклеточной анемией, были вылечены с
помощью репрограммированных клеток своей кожи.
Как сообщает Science Express
online от 6 декабря 2007, исследование было проведено в лаборатории профессора Whitehead Рудольфа Джениша.
Это первое подтверждение принципа терапевтического применения индуцированных плюрипотентных стволовых клеток. Слайд 29 В ноябре 2007 года было опубликовано важнейшее достижение
- были получены ИПСК из взрослой клетки человека. На
эту тему были опубликованы 2 независимые статьи - одна в журнале Science авторы Джеймс Томпсон с коллегами из Университета Висконсин-Мэдиссон, а другая - в жернале Cell Шинья Яманака и коллеги, Университет Киото. Пользуясь теми же самыми принципами, что и мышиных моделях, Яманака успешно трансформировал фибробласт человека в плюрипотентную клетку, используя те же самые четыре гена: Oct3/4, Sox2, Klf4, и c-Myc с ретровирусной системой. Томсон и коллеги использовали OCT4, SOX2, NANOG и LIN28, используя лентивирусную систему. Используемые системы вирусной трансфекции встраивают гены в случайном месте в геном клетки хозяина; это является вопросом, который необходимо решить для клинического применения iPS-клеток, так как полученные клетки могут оказаться подверженными раковым заболеваниям. Поэтому члены обоих исследовательских групп считают необходимым найти другой способ введения генов в клетку.Слайд 31 Ключевые гены для индукции генерации iPS-клеток. Oct-3/4 и определенные
члены семейства Sox генов (Sox1, Sox2, Sox3, and Sox15)
являются ключевыми регуляторами транскрипции, вовлеченными в процесс индукции. Без этих генов индукция невозможна. Однако определили, что некоторые гены, включая членов семейства Klf (Klf1, Klf2, Klf4, и Klf5), семейства Myc (C-myc, L-myc, and N-myc), Nanog, и LIN28 увеличивают эффективность индукции. * Oct-3/4 (Pou5f1): Oct-3/4 - один из членов семейства октамерных ("Oct") факторов транскрипции, играет ключевую роль в поддержании плюрипотентности. Отсутствие Oct-3/4 в Oct-3/4+ клетках, таких как бластомеры и эмбриональные стволовые клетки, приводит к спонтанному дифференцированию трофобласт (клетки наружного клеточного слоя бластоцисты млекопитающих, через который проходят питательные вещества от материнского организма), таким образом, присутствие Oct-3/4 повышает плюрипотентность и потенциал для дифференцирования эмбриональных стволовых клеток (ЭСК). Различные другие гены из семейства "Oct", включая ближайших родственников Oct-3/4, включая Oct1 и Oct6, не вызывают индукцию, что говорит о уникальности генов Oct-3/4 для процесса индукции.Слайд 32 * Семейство Sox: Семейство генов Sox, как и
Oct-3/4, связано с поддержанием плюрипотентности, однако оно связано с
мультипотентными и унипотентными стволовыми клетками, в отличие от Oct-3/4, которые экспрессируются только лишь в плюрипотентных клетках. Изначально Яманака и др., Джениш и др. и Томпсон и др. использовали Sox2 в качестве гена индукции, было обнаружено, что на процесс индукции влияют и другие гены. Sox1 дает ИПСК приблизительно с той же эффективностью, что Sox2, а гены Sox3, Sox15 и Sox18 также производят iPS-клетки, но с меньшей эффективностью. * Семейство Klf: в качестве фактора генерации мышиных ИПСК, Klf4 был впервые объявлен группой Яманака и подтвержден группой Джениша. Яманака продемонсрировал, что он является фактором генерации ИПСК человека. Было также определено, что Klf2 и Klf4 способны продуцировать ИПСК, Klf1 и Klf5 тоже, однако не с такой эффективностью. * Семейство Myc: Семейство генов Myc - прото-онкогены, влекущие за собой рак. Команды Яманака и Джениша показали, что c-Myc является фактором генерации iPS-клеток мышей, и Яманака продемонстрировал, что это фактор синтеза iPS-клеток человека. Однако команды Томпсона и Яманака и неопубликованная работа из Института Джона Хопкинса сообщили, что c-Myc является необязательным для синтеза iPS-клеток. Использование c-Myc в клинической терапии нежелательно, так как 25% мышей, которым пересадили индуцированные с помощью c-Myc ПСК, развили смертельные тератомы.Слайд 33 * Nanog: в ЭСК Nanog, наряду с Oct-3/4
and Sox2 необходим для промотирования плюрипотентности. Использование Nanog в
качестве одного из факторов привело к созданию линий iPS-клеток второго поколения, которые дают возможность получать жизнеспособные химерные организмы. * LIN28: LIN28 является mRNA-связывающим белком, экспрессирующимся в ЭСК и эмбриональных клетках карциномы, ассоциированный с дифференциацией и пролиферацией. Томпсон и др. показал, что он является фактором синтеза iPS-клеток, однако он необязательный.Слайд 35 Ранее сообщалось о создании индуцированных плюрипотентных клеток из
фибробластов. Однако фибробласты являются не полностью дифференцированными клетками, и,
следовательно, их легче конвертировать в IPS-клетки.В-клетки – клетки иммунной системы, связывающиеся со специфическими антигенами, такими как белки бактерий, вирусов или микроорганизмов. В отличие от фибробластов, в геноме В-клеток имеются специфические участки ДНК, которые вырезаются при терминальной дифференцировке. «Раз участки ДНК были вырезаны, их невозможно вернуть назад, - рассказал Джейкоб Ханна, ведущий автор исследования, - поэтому, анализируя геном, мы можем быть уверены, что IPS-клетки получены именно из дифференцированных клеток».
Слайд 36 Jacob Hanna и его коллеги начали свои эксперименты
с создания IPS-клеток из незрелых В-клеток. С помощью методики,
используемой для репрограммирования фибробластов, исследователи репрограммировали незрелые В-клетки, трансфецируя их ретровирусами, содержащими четыре гена (Oct4, Sox2, c-Myc и Klf4). Чтобы подтолкнуть репрограммирование зрелых В-клеток необходим еще один фактор ССААЕ/enhancer-binding-protein-a (C/EBPa). Полученные из зрелых и незрелых В-клеток IPS-клетки, также как и репрограммированные фибробласты, могут быть использованы для создания мышей. В геноме мышей, полученных из репрограммированных зрелых В-клеток, отсутствуют те же фрагменты ДНК, что и в геноме зрелых В-лимфоцитов. Этот факт доказывает, что исследователям удалось успешно репрограммировать терминально дифференцированные клетки.Слайд 37 Полностью дифференцированные В-клетки могут быть перепрограммированы в состояние,
близкое к эмбриональным стволовым клеткам без использования яйцеклеток.
Слайд 39 Японские ученые из Университета Киото (группа Яманака) перепрограммировали
мышиные гепатоциты (клетки печени) и эпителиальные клетки желудка. Развитие
опухоли, содержащей все типы клеток эмбриональных листков, и экспрессия генов, ассоциированных со стволовыми клетками, доказывает, что получены новые виды индуцированных плюрипотентных клеток. Обратная полимеразная цепная реакция показала, что iPS-клетки печени и желудка экспрессируют сравнимые с эмбриональными стволовыми клетками количнства эндогенных (внутреннего происхождения) Oct3/4 и Sox2.Слайд 40 Ученые использовали тот же набор генов (Oct 3/4,
Sox2, Klf4 и c-Myc), однако, когда c-Myc был исключен,
эффективность индуцирования понизилась совсем не так драматично, как в случае фибробластов. Также было показано, что место встраивания в ДНК генов, которые несут ретровирусные векторы, не имеет принципиального значения. Получение iPS-клеток из гепатоцитов и эпителия желудка является шагом вперед в получении индуцированных плюрипотентных клеток, так как количество случаев возникновения опухолей у мышей, которым вводились эти клетки, заметно уменьшилось (сначала сообщалось об отсутствии случаев развития рака, однако, впоследствии эти данные были скорректированы). Это говорит о том, что со временем будут получены пациент-специфичные iPS-клетки, которые будут использоваться в терапевтических целях для восстановления поврежденных тканей, и они не будут вызывать рак у пациента. Все это приблизит человека еще на шаг к победе над самой разрушительной болезнью - старением.Слайд 42 Для возможной терапии различных заболеваний с помощью iPS-клеток,
необходимо решить несколько проблем, включающих избавление от рисков и
недостатков существующего ныне метода генетического преобразования клеток и низкой эффективности и медленной кинетики индукции. Авторы статьи A Combined Chemical and Genetic Approach for the Generation of Induced Pluripotent Stem Cells (смю ниже) выяснили, что нервные прогениторные клетки (НПК - клетки предшественники, близки к стволовым) могут быть перепрограммированы с помощью меньшего числа генетических манипуляций по сравнению с ранее использованными соматическими клетками, а также что маленькие молекулы могут заменить вирусное взаимодействие определенных факторов транскрипции и способствовать процессу пеерпрограммирования.Слайд 44 Получение индуцированных плюрипотентных стволовых клеток из дифференцированных клеток
человека является одним из важнейших прорывов в области изучения
и применения стволовых клеток.Этот подход дает возможность использовать собственные ткани пациента и, таким образом, решает проблему отторжения пересаженных тканей, избавляя от необходимости принимать иммунодепрессанты. Это значит, что в скором времени можно будет заменить поврежденную или пораженную ткань человека на точно такую же ткань этого пациента, только здоровую. Это решит проблему терапии множества болезней.
Слайд 45
Пример
Авторы недавней статьи получили iPS-клетки из фибробластов 82-летней
женщины, больной наследственной формой бокового амиотрофического склероза (болезнь Шарко).
Эти пациент-специфичные клетки были успешно перепрограммированы в моторные нейроны - тип клеток, разрушающийся при этом заболевании. После преодоления возникновения новообразований при использовании iPS-клеточной терапии у людей, больных неизлечимыми заболеваниями, такими как болезнь Шарко, появится возможность преодолеть заболевание и продолжать жить здоровыми. А самое главное - у человека появился реальный шанс избавиться от старения. При должном уровне диагностики будет не сложно выявлять возрастные нарушения работы органов и уже на самом начальном этапе исправлять эти нарушения с помощью клеточной терапии. Таким образом, можно поддерживать организм в "молодом" состоянии на протяжении очень длительного времени, что фактически отменяет старение.Слайд 47 Возможности и проблемы использования человеческих плюрипотентных стволовых клеток
Человеческие плюрипотентные ЭСК, выделенные из позднего эпибласта, были впервые
получены в 1998 г., что стало величайшим открытием биологии за последнее десятилетие. Недавно был совершен другой прорыв в науке: прямое перепрограммирование дифференцированных человеческих соматических клеток в так называемые индуцированные ПСК (иПСК) посредством усиленной экспрессии генов плюрипотентности. Применение иПСК вместо ЭСК снимает этические ограничения на использование эмбрионального материала. Перепрограммирование является захватывающим процессом, изучение которого, несомненно, будет продолжаться для
регулирования клеточной программы,
развития понимания биологии стволовых клеток,
борьбы с онкологическими заболеваниями и старением.
Слайд 48 ЭСК человека могут быть выделены из эмбрионов, полученных
путем экстракорпорального оплодотворения (1), в то время как иПСК,
могут быть получены путем прямого перепрограммирования соматических клеток, например, фибробластов кожи (2). Независимо от происхождения, эти ПСК обладают способностью давать начало всем типам соматических клеток, в том числе клеткам гемопоэтического ряда (3), благодаря чему появляется возможность изучать развитие тканей человеческого организма in vitro. Соматические клетки, полученные из ПСК, могут быть использованы как модельные объекты для изучения таких заболеваний, как лейкемия*, для скрининга лекарственных препаратов** или в качестве агента клеточной терапии***.
Слайд 49
Области применения стволовых клеток
Использование человеческих ПСК для исследования
онтогенеза гемопоэтических клеток (ГСК)
Использование человеческих ПСК для изучения заболеваний
системы кроветворения и онкогенеза Терапевтическое применение человеческих ПСК
Слайд 50
Терапевтическое применение человеческих ПСК
Считается, что аутологичные клетки пациента
могут быть получены, подвержены в случае необходимости генетической репарации,
индуцированы к дифференциации в терапевтически значимые типы клеток и затем трансплантированы для замены или улучшения качества поврежденных клеток или тканей. Полученные из ПСК гемопоэтические стволовые клетки могут быть полезны тем, кто нуждается в трансплантации костного мозга, поскольку поиск подходящего донора остается главным препятствием таких операций. В отличие от традиционных трансплантаций костного мозга, КСК, дифференцированные из иПСК от одного здорового донора, могут быть введены нескольким реципиентам. При этом они не будут содержать лимфоцитов и, следовательно, не будут провоцировать развитие реакции трансплантат против хозяина (РТПХ). Дополнительными клиническими преимуществами таких КСК является индукция толерантности к солидным тканевым трансплантатам и препятствие развитию аутоиммунных реакций. На сегодняшний день полученные из плюрипотентных клеток ГСК еще не вошли в клиническую практику, и в настоящее время можно говорить лишь о прогентирных глиальных клетках (предшественниках олигодендроцитов), полученных из ЭСК и проходящих клинические испытания в терапии повреждений костного мозга. Эти испытания проводит американская биотехнологическая корпорация Geron, лидер в экспериментальной терапии травм спинного мозга.Слайд 51 Основная задача этого пилотного испытания – оценить безопасность
применения таких клеток, поскольку остаточные недифференцированные ПСК могут присутствовать
в любом лекарственном препарате, произведенном на основе ПСК, и спровоцировать у реципиента появление тератом – доброкачественных опухолей, состоящих из различных дифференцированных соматических клеток. По этой причине первостепенное внимание уделяется тщательной очистке дифференцированных клеток. С целью повышения безопасности клетки можно инкапсулировать или подвергать облучению накануне трансплантации, но это приведет к существенному снижению эффективности и увеличению продолжительности лечения. В то же время, эритроциты, полученные из человеческих ПСК, не теряют своей функциональной активности при облучении, уничтожающем оставшиеся в культуре недифференцированные стволовые клетки. Терапевтические эффекты облученных эритроидных клеток неизбежно будут транзиторными, как и в случае с традиционным переливанием крови. Однако сочетание запросов клинической практики, отсутствия ограничений по HLA-совместимости и возможности достичь безопасности самой процедуры посредством облучения, вполне вероятно, будут способствовать тому, что эритроциты, полученные из ПСК, станут одним из первых успешных событий в клинической практике. В действительности их крупномасштабное производство вполне осуществимо, и консорциум во главе с Шотландской Государственной Службой Переливания Крови нацелен на производство клинически значимых универсальных донорских эритроцитов.Слайд 53 Продвижение методов лечения, основанных на ПСК человека, сталкивается
с рядом трудностей, такими как
финансовые ограничения на получение
и использование генетически модифицированных клеток, неопределенность перспектив по вопросу интеллектуальной собственности,
неразвитость регуляторной базы в сфере таких методов лечения.
Ученые пытаются найти безопасные и эффективные методы производства специфических для пациентов ЭСК или иПСК, а также их эффективной последующей дифференцировки в пригодные для трансплантации клетки. В других публикациях авторы ставят вопрос о том, равноценны ли человеческие иПСК обыкновенным ЭСК (имеются доказательства, что такие различия существуют и это требует дальнейшего изучения), а также обращают внимание на недостаток данных долгосрочных клинических испытаний. Однако, несмотря на то, что эти трудности, вместе взятые, могут быть препятствием на пути продвижения новой технологии, каждая из них по отдельности может быть преодолена. Следует вспомнить, что от первого этапа разработки моноклональных антител до их успешного широкомасштабного применения в клинической практике прошло несколько десятилетий. При достаточном количестве времени и финансовых вложений технология, основанная на использовании ПСК человека, может совершить революционный переворот в регенеративной медицине.
Слайд 54
Как образуется кожа?
Стволовые клетки, находящиеся в тканях
нашего организма, обладают уникальной способностью: при делении они дают
начало не только специализированным клеткам ткани, но и новым стволовым клеткам. У млекопитающих, в частности, у человека и мыши, самый нижний (базальный) слой кожи содержит стволовые клетки кожи, которые могут развиваться в специализированные клетки более верхних слоев. Исследователи из European Molecular Biology Laboratory (EMBL) в Италии и из испанского Centro de Investigaciones Energéticas, Medioambientales y Tecnologicas (CIEMAT) обнаружили два ключевых белка, необходимых для запуска дифференцировки стволовых клеток кожи. Результаты работы, опубликованные 13 сентября в он-лайн версии журнала Nature Cell Biology, проливают свет не только на базовые механизмы образования кожи, но и на механизмы развития рака кожи и других эпителиальных раков.Слайд 55 В нормальной коже (фотография слева) стволовые клетки (покрашены
зеленым флуоресцентным красителем) находятся в самом нижнем слое и
дифференцируются в клетки верхних слоев (покрашены красным флуоресцентным красителем). У мышей, в чьей ДНК присутствуют мутации генов C/EBP-альфа и –бета (центральная фотография), эта дифференцировка блокируется: стволовые клетки оказываются в верхних слоях кожи, а специализированных клеток кожи нет вовсе. Такой же процесс наблюдается на начальных стадиях развития базальноклеточных карцином, одного из самых агрессивных и инвазивных раков (фотография справа).Слайд 56 Когда в коже присутствует белок C/EBP-бета, потерявший способность
взаимодействовать с белком E2F (одна из молекул, контролирующих клеточный
цикл), клетки кожи начинают дифференцироваться аномально, поскольку в них не происходит окончательного выключения «программы стволовости». Такие клетки (окрашены в желто-зеленый цвет, поскольку в них выявляется как маркер стволовых, так и маркер дифференцированных клеток) находятся на промежуточной стадии между стволовыми и нормальными специализированными клетками кожи, при этом они продолжают активно делиться.Слайд 57 Источником эмбриональных стволовых клеток может стать человеческая кожа
В журнале Science опубликована статья с описанием методики получения
эмбриональных стволовых клеток из обычных клеток человеческой кожи. Это достижение может избавить от необходимости разрушать эмбрионы в исследовательских и медицинских целях.Слайд 58 Разработали методику, при которой донорская эмбриональная стволовая клетка
(ЭСК) "сливается" с клеткой кожи реципиента. Компоненты ЭСК как
бы "перепрограммируют" механизмы работы клетки кожи, которая начинает проявлять свойства, аналогичные свойствам ЭСК.Как именно работает механизм "перепрограммирования" ученым пока неясно. Однако полученные клетки ведут себя так же, как ЭСК. В частности, они порождают опухоли-тератомы при имплантации лабораторным мышам — это классический тест на выявление истинных ЭСК. Также эти клетки демонстрируют способность к практически неограниченному делению в культуре — еще один признак стволовых клеток.
И все же, одна серьезная трудность с "искусственными" ЭСК остается — у них имеется два комплекта хромосом, полученных от двух клеток — донорской ЭСК и исходной клетки кожи. Такие клетки нельзя использовать для исследования и лечения заболеваний. Тогда стали перед самым слиянием удалять из эмбриональной клетки ядро, содержащее "лишний" комплект хромосом.
Слайд 59 Клетки кожи, превращенные таким образом в ЭСК и
избавленные от лишнего генетического багажа, можно использовать для медицинских
целей. Генетически они тождественны клеткам реципиента, поскольку не содержат генов донора. Более того, такие клетки сами могут использоваться для перепрограммирования других клеток в ЭСК. Это позволяет в перспективе вовсе отказаться от использования настоящих ЭСК, полученных путем разрушения эмбрионов.Тем самым может быть решена серьезная этическая проблема. Многие религиозные организации заявляют о недопустимости терапевтического клонирования, то есть искусственного создания человеческих эмбрионов с целью выделения из них ЭСК. Например, католическая церковь считает убийством разрушение эмбриона и даже просто оплодотворенной яйцеклетки. В то же время многие ученые указывают на то, что ЭСК могут принести избавление от многих неизлечимых до сих пор заболеваний. Правда, пока сфера применения ЭСК в медицине крайне ограничена. Данная коллизия науки и этики уже вызвала появление ряда работ, цель которых — найти способы получения ЭСК без использования человеческих эмбрионов.
Слайд 61 Лечение больной мыши с помощью её же клеток,
перепрограммированных в iPS-клетки, можно было бы осуществить по следующей
схеме (иллюстрация Tom DiCesare).Слайд 62 iPS-клетки — разновидность "взрослых" стволовых клеток. Индуцированными их
называют потому, что клетки эти заставили притворяться эмбриональными стволовыми
(ЭСК), искусственно включив экспрессию определённых генов, а плюрипотентными — так как они могут преобразовываться в клетки любой ткани будущего организма. iPS-клетки можно считать искусственно созданной этической заменой обычным ЭСК, которые можно заполучить, лишь разрушив эмбрион. Они были созданы в 2006 году группой профессора Синя Яманака из университета Киото. Это открытие показало, что (пусть пока только в теории) человека можно лечить его собственными клетками, выращивая из индуцированных плюрипотентных отдельные ткани и даже целые органы.Слайд 63 С самого начала было ясно, что вроде бы
есть у iPS-клеток возможность вырасти и в полноценное здоровое
млекопитающее (так же как и у эмбриональных стволовых клеток). Однако никому ранее не удавалось это сделать. Учёные многих стран долгое время тренировались на мышах. Две последние публикации в журналах Nature и Cell Stem Cell свидетельствуют о том, что им это наконец-то удалось. Первое масштабное достижение было получено группой специалистов под руководством Ци Чжоу из Института зоологии Китайской академии наук (Institute of Zoology Chinese Academy of Sciences) и Фани Цзэн (Fanyi Zeng) из университета Цзяо Туна в Шанхае. Раньше они клонировали животных, теперь же решили заняться теми самыми индуцированными плюрипотентными стволовыми клетками.Они, так же как и Яманака, использовали вирусные векторы, чтобы "приклеить" к фибробластам – клеткам соединительной ткани мышей – четыре гена и перепрограммировать их таким образом в плюрипотентные. Фибробласты были получены от эмбрионов на поздней стадии развития. Для того чтобы определить, что же они в результате получили, китайцы первым делом провели основные тесты, позволяющие сравнить iPS-клетки с эмбриональными аналогами (определялось наличие особых поверхностных маркеров).
Слайд 64 Внедрение нужных генов с помощью ретровируса превращает обычную
клетку в плюрипотентную (иллюстрация с сайта biotechprimerblog.com).
Слайд 66 Следующим шагом было создание тетраплоидного эмбриона (для этого
учёные "смешали" две клетки оплодотворённого эмбриона, находящегося на ранней
стадии развития). Эта "оболочка" является своего рода колыбелью для будущего организма, из неё развивается плацента и некоторые другие важные клетки. Однако для появления собственно тела необходимы клетки эмбриональные.Далее в эмбрион с четырьмя наборами хромосом были имплантированы iPS-клетки (как мы уже знаем, являющиеся искусственной заменой эмбриональным). Они запустили процесс развития. После всех этих манипуляций плод вживили суррогатной матери, а спустя 20 дней родился мышонок. Уже по внешним данным было ясно, что новорождённое животное (чёрный цвет шерсти) носит гены мыши, от которой были получены индуцированные плюрипотентные клетки (тоже чёрный окрас), а не той, из клеток которой были получены тетраплоидные эмбрионы (белый окрас).
Слайд 67 Однако для полной уверенности были проведены ДНК-тесты, подтвердившие,
что мышонок по имени Сяо-Сяо (Xiao Xiao), или "малюсенький",
вырос именно из iPS-клеток (среди всех отпрысков максимальная схожесть с "родителем" составила около 95%). Эксперт по клонированию Рудольф Джаниш из MIT рассказывает, что он и его коллеги пытались проделать похожий эксперимент в 2007 году. Однако они смогли создать лишь эмбрионы на поздней стадии развития. "У меня два объяснения, почему мы не добились успеха. Первое — iPS-клетки не являются плюрипотентными. Второе — мы просто-напросто плохо старались. И сейчас я всё больше склоняюсь ко второму варианту", — говорит Джаниш. Китайцы оказались трудолюбивее. Они выполнили гигантский объём работ: прежде чем получить первого "перепрограммированного" мышонка, им пришлось проанализировать 250 эмбрионов.Слайд 68 Профили экспрессии плюрипотентных маркеров некоторых генов, полученные при
помощи микроанализа (иллюстрация Nature).
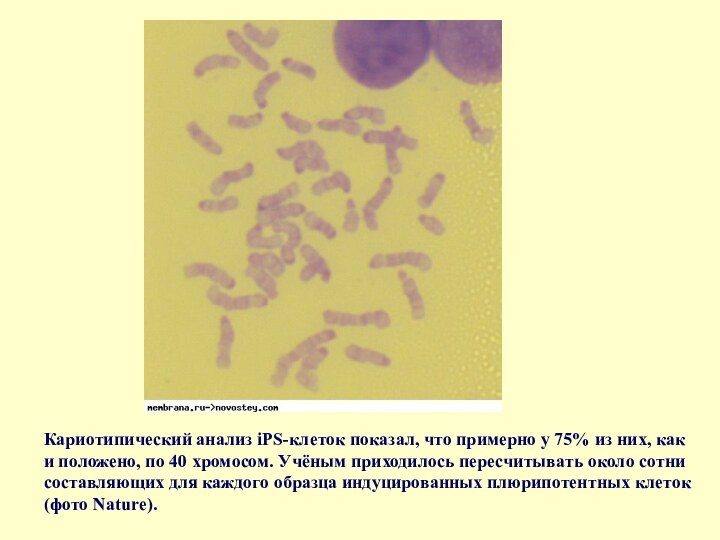
Слайд 69 Кариотипический анализ iPS-клеток показал, что примерно у 75%
из них, как и положено, по 40 хромосом. Учёным
приходилось пересчитывать около сотни составляющих для каждого образца индуцированных плюрипотентных клеток (фото Nature).Слайд 70 К моменту выхода статьи у учёных было 27
новых животных. Зоологи перепробовали массу вариаций различных параметров, но
"рецептом" с самым лучшим выходом оказался тот, что дал 22 живых мышонка из 624 внедрённых эмбрионов. Таким образом, доля успешных попыток составила 3,5% (а это сравнимо с выходом типичных линий ЭСК!). Достижение имеет несомненную научную ценность, однако ещё есть к чему стремиться. Цзэн подчёркивает, что по-прежнему высок уровень смертности и физических недостатков среди животных. Многие новорожденные умерли в первые два дня, большое количество родились с отклонениями в развитии (эти детали в статье отсутствуют, но появятся в следующей публикации).Слайд 71 Впрочем, не всё так уж и плохо. 12
из 27 выживших мышат спарились и дали вполне здоровое
потомство. Сейчас у первой группы китайских учёных несколько сотен грызунов второго поколения и около сотни третьего. Ни у одной особи не были обнаружены какие-либо опухоли (хотя систематических проверок зоологи не проводили). Теперь о второй группе учёных из Национального института биологических наук в Пекине (NIBS). Они тоже преуспели в выращивании мышей из iPS-клеток. Руководил исследованием доктор Шаожун Гао. Исследователи использовали практически такую же технологию, что и предыдущая группа. Только объёмы у них были поменьше: они перенесли индуцированные плюрипотентные клетки в 187 тетраплоидных эмбрионов. Из них родились всего двое мышат, один из которых умер в детстве. Таким образом, эффективность процедуры составила 1,1%, но и это тоже успех. "Шансы заполучить работающую линию клеток невелики, но мы очень старались", — комментирует Гао. Сейчас учёные пытаются подобрать оставшейся в живых мышке пару, чтобы получить потомство.Слайд 72 Яманака тоже продолжает свои исследования. Недавно он и
его коллеги получили индуцированные плюрипотентные стволовые клетки без использования
вирусов (фото с сайта blogbus.com). В дальнейшем оба коллектива рассчитывают понять, в чём же всё-таки принципиальная разница между iPS-клетками и эмбриональными стволовыми клетками мышей.Слайд 73 То, что разница есть, никто уже не сомневается.
Недавно команда исследователей из университета Калифорнии в Лос-Анджелесе обнаружила,
что iPS и ЭСК различаются экспрессией генов. "Только мы пока не можем сказать, что работает лучше – настоящие эмбриональные стволовые клетки или их перепрограммированные собратья", — рассказывает один из авторов работы Кэтрин Плат. Уже сейчас Чжоу и Цзэн могут сказать, что многое определяется временем. Так, колонии индуцированных плюрипотентных клеток, полученные в течение первых 14 дней, гораздо более производительны (по количеству родившихся из них мышат), нежели те, чей "возраст" уже перевалил за 20 или даже 36 дней. Если учёным удастся разобраться, то, возможно, и низкий выход, и высокую смертность, и большое количество физических отклонений можно будет преодолеть. Кроме того, полученные данные можно будет "перенести" и на человека, что позволит понять различия в наших клетках. Отметим, что несмотря ни на что полностью ретранслировать работу на человека не удастся. Хотя бы в силу того, что невозможно создать его тетраплоидный эмбрион. Это также означает, что и о клинических испытаниях индуцированных плюрипотентных клеток (в качестве замены многообещающим ЭСК) пока говорить рано.Слайд 74 Если даже попробовать осуществить такой же процесс с
людьми (что опять же неэтично), то в результате всё
равно получится не тот человек, клетки которого изначально взяли для перепрограммирования (фото с сайта msn.com)."Для нас все эти данные – лишь модель, показывающая возможности перепрограммирования клеток. Мы не рассматриваем нашу нынешнюю работу как первую ступеньку на пути создания из iPS-клеток человека", — говорит Чжоу. Среди прочих планов генетиков: доказать, что существует возможность создать здоровое животное из клеток взрослой мыши (напомним, в данных работах использовались клетки, полученные от эмбрионов на последней стадии развития).
Слайд 75
Ученые разработали новый метод получения стволовых клеток
Аденовирусы —
возбудители банального ОРЗ — могут оказаться серьезными помощниками в изучении стволовых
клетокСлайд 76 Американские ученые разработали новый метод получения стволовых клеток,
который предполагает преобразование соматической клетки в стволовую с помощью аденовирусов. Специально
подготовленные аденовирусы привносят в соматическую клетку необходимый набор эмбриональных генов, которые и запускают процесс омоложения клетки. В отличие от прежних, новая технология не изменяет геном исходной клетки и не вызывает появления опухолей.В области исследования стволовых клеток серьезные усилия ученых направлены на поиск действенных технологий перепрограммирования соматических клеток в плюрипотентные, то есть способные к различной специализации. В течение последних двух-трех лет были определены гены, которые работают в стволовых клетках и определяют экспрессию генома на самых ранних стадиях развития эмбриона. Это гены транскрипционных факторов Oct4, Sox2, Klf4, c-Myc и Nanog и некоторые другие. Если ввести их в соматическую клетку, например в фибробласт, то клетка перерождается и приобретает свойства плюрипотентности. Каким образом можно доставить эти гены в клетку, и не просто доставить, а еще и заставить их там работать?
Сейчас эксплуатируется вирусная и липосомная передача генов. Липосомы с заключенными внутри генами «плюрипотентности» внедряются в клетку, но эффективность встраивания и активации трансгенного материала чрезвычайно низка. Более эффективно использование вирусного носителя или вирусного вектора (см. схему).
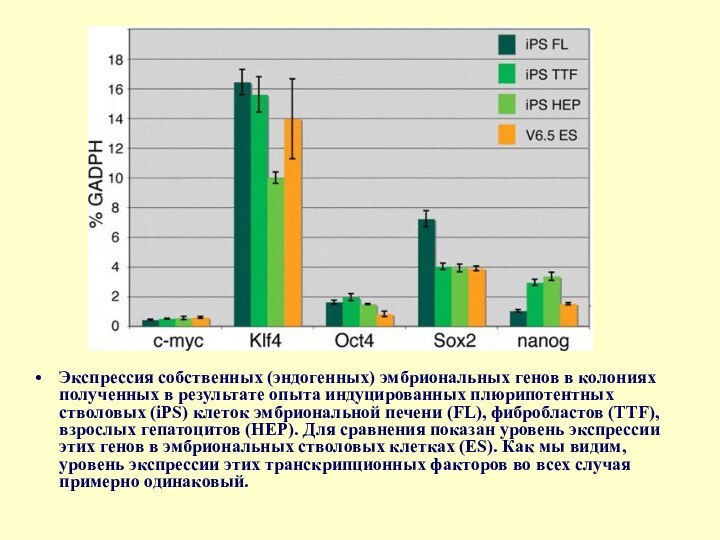
Слайд 78 Экспрессия собственных (эндогенных) эмбриональных генов в колониях полученных в результате
опыта индуцированных плюрипотентных стволовых (iPS) клеток эмбриональной печени (FL), фибробластов (TTF), взрослых
гепатоцитов (HEP). Для сравнения показан уровень экспрессии этих генов в эмбриональных стволовых клетках (ES). Как мы видим, уровень экспрессии этих транскрипционных факторов во всех случая примерно одинаковый.
Слайд 79
Ученые отмечают очень низкую эффективность аденовирусного перепрограммирования клеток:
при ретровирусном переносе 0,01–0,1%, а при аденовирусном — 0,0001–0,001%. Зато
у этого метода есть несколько важнейших преимуществ.Первое из них — ни в одном случае не появилось опухолевых образований, а при ретровирусном переносе клетки очень часто порождают опухоли.
Второе — геном получившейся плюрипотентной клетки не имеет вирусных вставок и потому идентичен геному эмбриональной клетки; это делает возможным полное сравнение работы обоих геномов.
Оба преимущества предполагают широкие возможности для будущих терапевтических разработок. Поэтому в последних строках своего сообщения авторы выразили надежду, что данная работа продолжится, но с использованием человеческих соматических клеток.
Слайд 80
ЭТИКА
Сразу две независимые группы исследователей опубликовали в журнале
Nature описание предложенных ими «этичных» методик получения эмбриональных стволовых
клеток. Обе методики преследуют одну цель — обойти запреты, стоящие в США на пути широкого использования этого универсального генетического строительного материала.Причина запрета формулируется примерно так: нельзя ради спасения одной жизни (больного, которого можно было бы вылечить с помощью эмбриональных клеток) уничтожать другую жизнь (эмбриона, из которого извлекаются эти клетки).
Слайд 81 На сегодняшний день большую часть эмбриональных стволовых клеток
(ЭСК) получают из эмбрионов, остающихся неиспользованными при экстракорпоральном оплодотворении.
Эмбрионы выращиваются в питательном растворе примерно до ста клеток, после чего из них извлекают ЭСК. Эмбрион при этом погибает.Роберт Ланца и его коллеги из компании Advanced Cell Technology считают, что нашли способ избежать гибели эмбриона. Они предлагают брать всего одну клетку на самой ранней стадии развития эмбриона. Собственно, эта процедура уже хорошо известна и называется она «преимплантационная генетическая диагностика». С ее помощью (с согласия будущих родителей) врачи проверяют, нет ли каких-то генетических отклонений у будущего ребенка, зачатого путем экстракорпорального оплодотворения. После этого эмбрион имплантируется в матку, и дальнейшее его развитие, если он приживется, происходит без каких-то отклонений.
Слайд 82 «Эта процедура проводилась сотни тысяч раз, — говорит Ланца, —
так что мы знаем, что она оказывает минимальное или
незначительное действие на эмбрион».Ланца предлагает получать стволовые клетки из клеток-бластомеров. Из эмбриона на восьмиклеточной стадии развития, предшествующей образованию морулы, извлекается одна клетка-бластомер. Затем извлеченная клетка превращается в стволовую. Ланца и его коллеги добились такого превращения, поместив бластомер к уже готовым стволовым клеткам. Будучи помещенной в окружение стволовых клеток и взаимодействуя с ними, клетка-бластомер сама становилась стволовой. После чего она делилась и давала жизнь новой колонии ЭСК.
Небольшие повреждения эмбриона на стадии морулы могут легко компенсироваться, так как бластомеры еще не приобрели специализацию. Опыты, проведенные Ланцой на мышах, показали, что имплантация в матку семиклеточных эмбрионов (с извлеченной клеткой) приводила к рождению здоровых детенышей. Из 47 самок, прошедших такую процедуру, 23 благополучно забеременели и родили — ровно такое же соотношение наблюдалось и в контрольной группе мышей.
Слайд 83 Следующий этап — получение человеческих ЭСК. Для начала Ланца
предлагает использовать нежизнеспособные эмбрионы, отбракованные при преимплантационной генетической диагностике.
За то, что происходит с такими эмбрионами потом, производители стволовых клеток ответственности уже не несут.Слайд 84 Джениш и Мейсснер разрешили эту щекотливую ситуацию, заразив
донорскую клетку вирусом, блокирующим действие гена Cdx2, ответственного за формирование
плаценты. По мнению ученых, после заражения можно с чистой совестью объединять донорскую клетку с яйцеклеткой, поскольку конечный продукт такого объединения нельзя имплантировать в матку, и, следовательно, он не может считаться подлинным эмбрионом. При этом в уже извлеченных из «псевдоэмбриона» стволовых клетках можно полностью восстановить функцию Cdx2, так что сами ЭСК получатся совершенно нормальными.Насколько обеим группам исследователей удалось решить этические и вытекающие из них юридические проблемы, покажет время. Последнее слово за Советом по биоэтике при президенте США.
Другая методика получила название «перенос измененного ядра» (altered nuclear transfer, ANT). Ее предложили Рудольф Джениш) и Александр Мейсснер (Alexander Meissner) из Уайтхедского института биомедицинских исследований при Массачусетском технологическом институте. Она позволяет оригинальным образом обойти проблему уничтожения эмбрионов, полученных в результате клонирования. Такие эмбрионы искусственно создаются в медицинских целях (например, для выращивания нужного типа ткани) путем объединения донорской клетки пациента с яйцеклеткой, у которой удалено собственное ядро. Хотя их и нельзя назвать эмбрионами в полном смысле слова, они могут вполне стать таковыми, если их поместить в матку.