Слайд 2
Наприкінці XX, початку XXI століття у зв’язку зі
значиним ростом арсеналу нових лікарських засобів постало питання щодо
недостатності та недостовірності характеристик ефективності, безпеки ЛЗ, а також виникнення фальсифікованої продукції, у зв’язку з чим виникли нові медико-фармацевтичні науки.
у відповідь на терапевтичну неадекватність ЛЗ, що випускаються різноманітними виробниками – біофармація;
просування на ринок товарів та послуг з об’єктивно недоведеною ефективністю і безпечністю призвело до появи доказової фармакотерапії;
Приховування інформації щодо побічної дії ЛЗ, недостатнє відстежування небажаних ПД їх застосування в період після їх реєстрації і виведення на ринок зумовило виникнення наукового напрямку – фармацевтична пильність (фармаконагляд);
Слайд 3
безпідставний ріст вартості ліків, збільшення розриву між ресурсами
лікувальних закладів і витратами на придбання ліків вимагали розробки
методів економічної оцінки цілеспрямованості їх використання для досягнення терапевтичних результатів – фармакоекономіка;
Пріоритет прибутку над запитами людини і суспільства, використання технологій формування попиту і стимулювання збуту шляхом маніпулювання сприйняттям, психікою та споживацькою поведінкою споживачів, зумовиливили необхідність зміни філософії фармацевтичної діяльності і наукової розробки - фармацевтичної біоетики.
Слайд 4
Фармацевтична біоетика – галузь біоетики, що вивчає моральні,
правові, соціальні, екологічні, біологічні і юридичні проблеми, що виникають
при створенні, клінічних випробовувань, реєстрації, виробництві, доведенні до споживача і використанні лекарських препаратів, інших фармацевтичних препаратів і БАД з метою захисту здоров’я населення і окремих людей, якості їх життя, фізичної і психічної недоторканності особистості, захисту людської гідності
Слайд 5
ЗАДАЧІ БІОЕТИКИ
1. Формування:
- біоетичної концепції провізора в системі
«фармацевтичний робітник і суспільство»;
- біоетичних відносин фармацевтичного робітника і
пацієнта;
- основ взаємодії фармацевтичних і медичних робітників в галузі лікарської терапії і профілактики захворювань;
- деонтологічних і етичних основ відносин з колегами.
2. Забезпечення провізорів основними міжнароднми і національними документами, пов’язаними з фармацевтичною біоетикой;
3. Ознайомлення провізоров з проблемою формування прав споживачів фармацевтичної допомоги і їх захисту.
Слайд 6
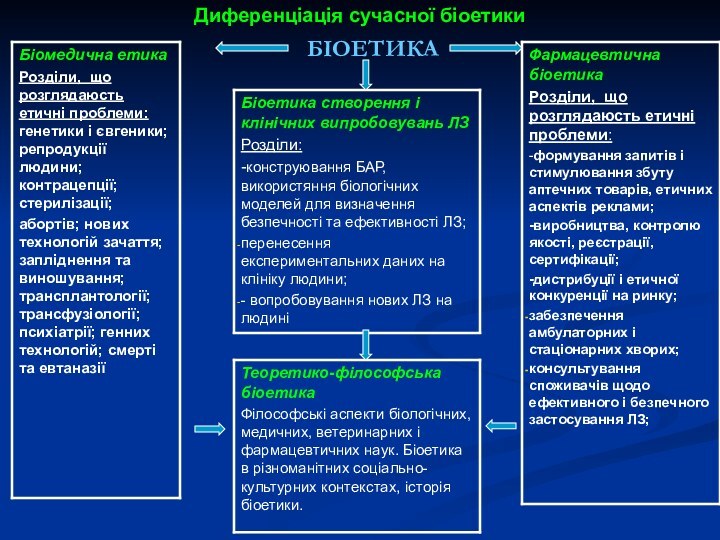
Диференціація сучасної біоетики
БІОЕТИКА
Слайд 7
ХАРАКТЕРИСТИКА СУЧАСНОГО ЛІКАРСЬКОГО РИНКУ З ПОЗИЦІЇ БІОЕТИКИ ТА
ЗХИСТУ ПРАВ СПОЖИВАЧІВ.
ФАРМАКОНАГЛЯД
В даний час:
найбільш тревожною є недостатня і
недостовірна характеристика ефективності, безпеки і економічної доцільності ЛЗ, що просуваються на фармацевтичному ринку;
з багатьох тисяч циркулюючих в Україні ЛЗ, понад 85% не відповідають сучасним вимогам.
Слайд 8
Групування ЛЗ за ступенем доведеності ефективності і характеристикою
безпечності ЛЗ
1. Категорія А – ЛЗ, ефективність і безпечністьсть
яких доведена в результаті порівняльних рандомізованих багатоцентрових досліджень з математичною обробкою отриманих результатів.
2. Категорія В – ЛЗ, охарактеризовані в рандомізованих контролюємих дослідженнях, в заключній стадії яких кількість хворих недостатня для розрахунку достовірності отриманих результатів.
3. Категорія С – ЛЗ, дані про які отримані в дослідженнях, що проводились як контролюємі, але не рандомізовані.
4. Категорія D – ЛЗ, рекомендації до застосування яких базуються на дискусії експертів, в результаті якої було досягнуто консенсусу. NB!!! Категорія доведеності D є недостатньою.
Слайд 9
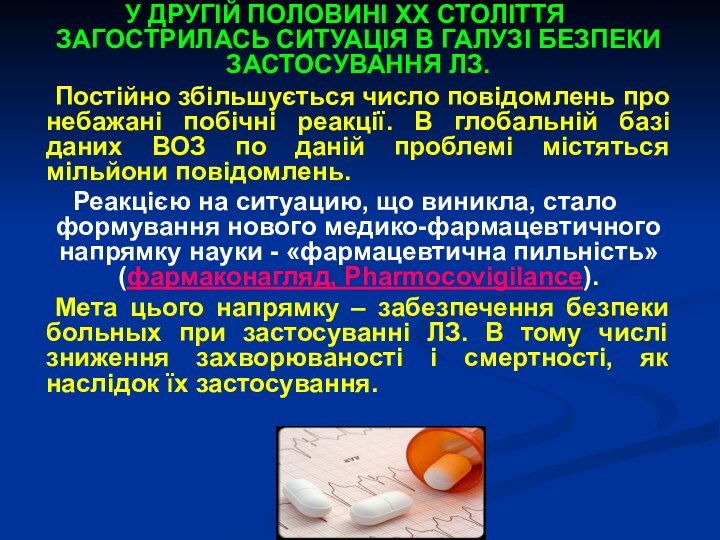
У ДРУГІЙ ПОЛОВИНІ XX СТОЛІТТЯ ЗАГОСТРИЛАСЬ СИТУАЦІЯ В
ГАЛУЗІ БЕЗПЕКИ ЗАСТОСУВАННЯ ЛЗ.
Постійно збільшується число повідомлень про небажані
побічні реакції. В глобальній базі даних ВОЗ по даній проблемі містяться мільйони повідомлень.
Реакцією на ситуацию, що виникла, стало формування нового медико-фармацевтичного напрямку науки - «фармацевтична пильність» (фармаконагляд, Pharmocovigilance).
Мета цього напрямку – забезпечення безпеки больных при застосуванні ЛЗ. В тому числі зниження захворюваності і смертності, як наслідок їх застосування.
Слайд 10
ЗАДАЧАМИ ФАРМАКОНАГЛЯДУ
є системне рішення, що забезпечує:
створення національної
служби фармаконагляду;
навчання та підготовка спеціалістів охорони здоров’я в галузі
оцінки співвідношення користь/ризик і раціонального використання ЛЗ;
зміна стереотипів у роботі лікарів з метою зменшення непотрібного і нераціонального призначення ЛЗ (поліпрогмазія);
зміна ставлення хворих до
необґрунтованого застосування ліків, особливо, самолікування;
реалізацію освітніх та інформаційних програм для медичних і фармацевтичних робітників і населення;
виявлення і вивчення НПР.
Слайд 11
ОБ’ЄКТОМ ВИВЧЕННЯ ФАРМАКОНАГЛЯДУ Є:
недостатня вивченість ЛЗ;
недостатня інформованість медичних
і фармацевтичних роботників і споживачів фармацевтичної допомоги;
спотворення і утаємничення
інформації про НПР;
медині помилки;
застосування неякісних і фальсифікованих препаратів;
використання ЛЗ за невивченими і недозволеними показаннями;
гострі і хронічні отруєння ЛЗ;
смертність, викликана ЛЗ;
злвживання ЛЗ;
неблагоприємна взаємодія ЛЗ з хімічними властивостями, іншими ЛЗ і продуктами харчування.
Слайд 12
Ким здійснюється фармаконагляд в Україні?
п. 1.3. Здійснення нагляду
за побічними реакціями лікарських засобів, дозволених до медичного застосування, покладено
МЗ України на ГП «державний єкспертній центр МОЗ Украины».
(Наказ МОЗ Украины
от 27.12.2006г. №898 п.1.3)
Слайд 13
Действующая система фармаконадзора в Украине Приказ МЗ №
898 от 27.12.06 г.
Міністерство охорони здоров’я Украины
Державний експертный центр
Керівництво
післярегістраціонного надзора
Регіональні відділення Управління післяреєстраційного нагляду
? ? ? ? ?
Метод спонтанних повідомлень
Слайд 14
Структура Управління післяреєстраційного нагляду
Слайд 15
Основні напрямки роботи системи фармаконагляду в Україні
Інформаційне і
методичне забезпечення системи охорони здоров’я з питань безпечності ЛЗ
(в тому числі, розробка і проведення спеціалізованих і загальних тренінгових програм, курсів. За останні 2 роки в тренінгах взяло участь 28 459 чол.)
Здійснення збору, аналізу і узагальнення інформації щодо безпечності і ефективності застосування ЛЗ, отриманої від лікарів, виробників, міжнародних організацій
Здійснення контролю за функціонуванням ФН в системі охорони здоров’я і виробництва ЛЗ
Підготовка пропозицій для МЗ щодо повної чи часткової заборони медичного застосування ЛЗ, внесенні додатків чи змін в інструкції щодо медичного застосування ЛЗ
Проведення спеціалізованої експертної оцінки перереєстраційних матеріалів по безпечності ЛЗ
Слайд 16
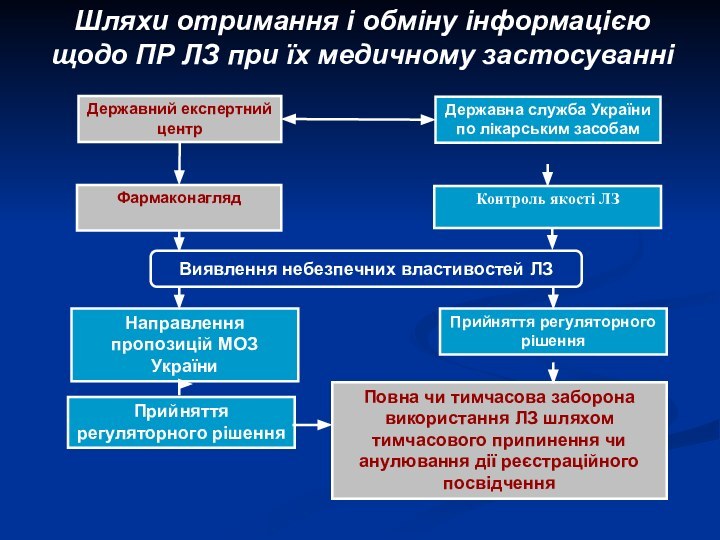
Шляхи отримання і обміну інформацією щодо ПР ЛЗ
при їх медичному застосуванні
Слайд 17
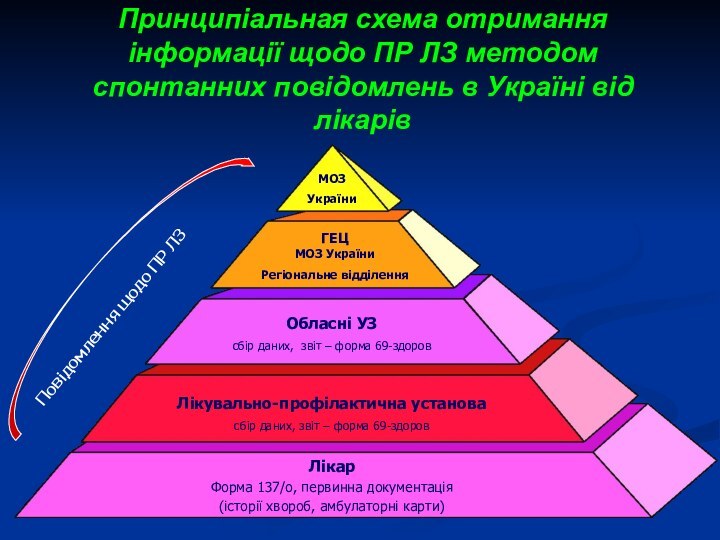
Принципіальная схема отримання інформації щодо ПР ЛЗ методом
спонтанних повідомлень в Україні від лікарів
Слайд 19
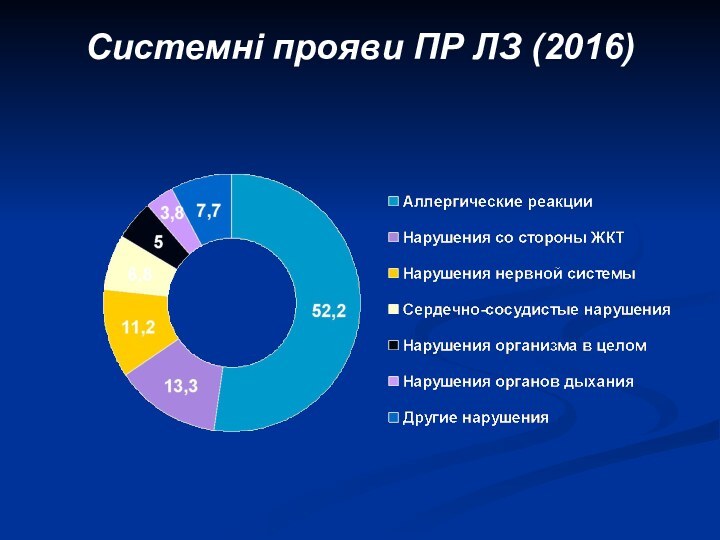
Розподіл ПР ЛЗ за ступенем серйозності (2010)
79,5% –
несерйозні ПР
20,5% – серйозні ПР
7,3% випадків ПР стали причиною
госпіталізації пацієнтів
5,2% віпадків ПР призвели до тимчасової недієздатності
4,7% – загрожували життю пацієнтів
3,9% – призвели до подовження госпіталізації пацієнтів
0,1% – скінчились летально
Слайд 20
Критерії оцінки безпеки ЛЗ
Частота ПР
Співвідношення кількості непередбачених
до передбачених ПР, серйозних до несерйозних ПР
Розповсюдженість ПР серед
випадків захворювань
Формування і підтвердження сигналу
Співвідношення користь/ризик
Слайд 21
Частота ПР
Більше 10% - дуже часті, які потребують
обов’язкового проведення профілю безпечності ЛЗ або негайного прийняття відповідних
регуляторних рішень
1-10% - часті, що потребують або проведення вивчення профілю безпечності ЛЗ, або надання планів управління ризиками, або внесення обмежень/попереджень в інструкцію для медичного застосування
0,1-1% - нечастіе
0,01-0,1% - рідкісні
Менше за 0,01% - найрідкісніші
Слайд 22
Причини, за якими вносяться зміни і доповнення в
інформацію щодо безпечності ЛЗ при проведенні експертизи перереєстраційних матеріалів
І.
Узагальнене уявлення інформації в інструкції щодо медичного застосування (представлені синдроми, якщо існує інформація щодо їх симптоматичних проявів)
ІІ. Виявлення непередбачуваних ПР через формування і підтвердження сигналу
ІІІ. Невідповідність даних, наданих в повідомленнях інформації з безпечності, інструкції з медичного застосування
ІV. Невідповідність даних безпечности в PSURе сучасної інформації з безпеки, або тої, яка відображена в інструкції з медичного застосування
Слайд 23
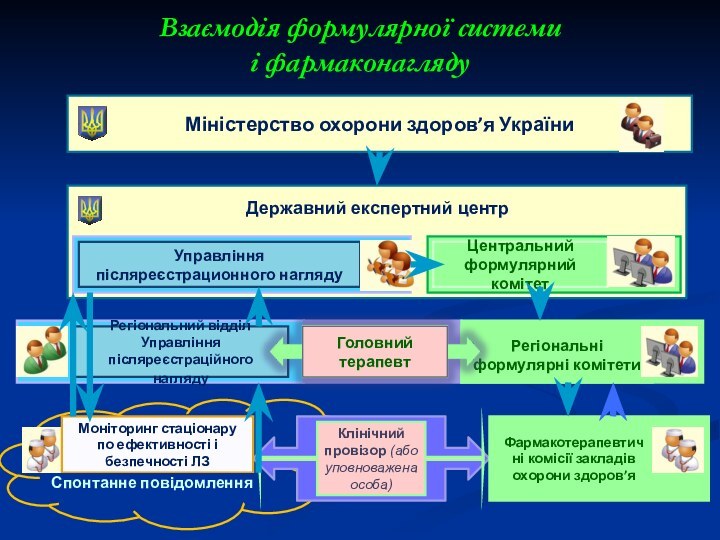
Взаємодія формулярної системи
і фармаконагляду
Міністерство охорони здоров’я України
Державний
експертний центр
Управління післяреєстрационного нагляду
Регіональний відділ Управління післяреєстраційного нагляду
Центральний
формулярний комітет
Регіональні формулярні комітети
Моніторинг стаціонару по ефективності і безпечності ЛЗ
Спонтанне повідомлення
Клінічний
провізор (або уповноважена особа)
Фармакотерапевтичні комісії закладів охорони здоров’я