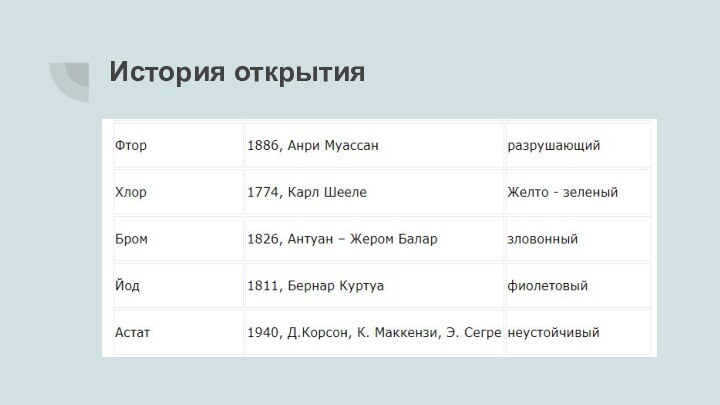
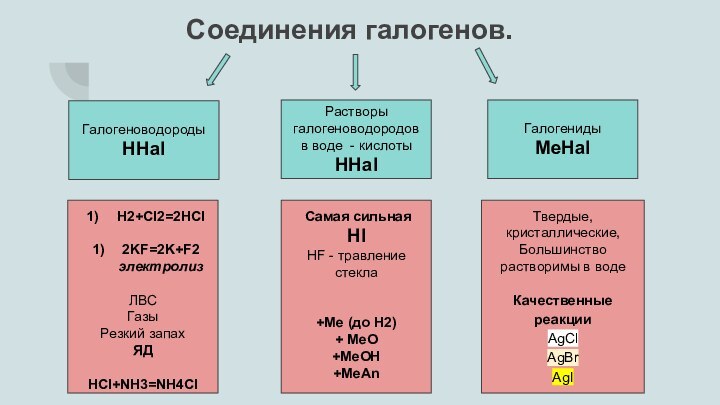
Слайд 3
Положение в периодической системе.
Найдите ошибки в тексте!
Галогены, то
есть рождающие соли, занимают главную подгруппу 5 группы Периодической
таблицы химических элементов.
Их объединяет сходное строение внешнего уровня, на котором находится по 6 электронов.
Их высшая валентность равна 2.
Формула высшего оксида Э2О4
Все они очень сильные окислители, так как до завершения внешнего уровня не хватает 1 электрона. Характерная степень окисления –1, но в соединениях с кислородом (кроме фтора) проявляют положительные степени окисления: +1, +3, +5, +7.
Но и среди галогенов имеются различия, обусловленные зарядом их ядер. Так с увеличением заряда ядра, увеличивается радиус атома, уменьшаются неметаллические свойства и окислительные способности.
Слайд 4
Строение молекул простых веществ
Сколько неспаренных электронов содержит атом
хлора?
Cl
Сколько общих электронных пар содержит молекула хлора?
Cl
Cl Cl - Cl
Молекулярная кристаллическая решетка
Слайд 5
Физические свойства
F2
Cl2
Br2
I2
At ?
Ts ?
Газ желтого цвета
Газ желто-зеленого
цвета
Жидкость Коричнево-красного цвета
Кристаллы темно-серого цвета
Астат может иметь темный или
блестящий вид и может быть полупроводником
Теннессин будет летучим металлом, который не образует анионов и не достигает высоких степеней окисления
Слайд 6
Химические свойства
Взаимодействие с металлами
При взаимодействии галогенов с металлами
образуются соли: фториды, хлориды, бромиды, иодиды.
Фтор реагирует со всеми
металлами (даже с золотом и платиной), с большинством — при обычных условиях:
Ca+F2=CaF2 2Au+3F2=2AuF3
Остальные галогены реагируют с металлами при нагревании:
2Fe+3Cl2=2FeCl3 Cu+Br2= CuBr2
Слайд 7
Химические свойства
2. Взаимодействие с водородом
В реакциях галогенов с
водородом образуются газообразные галогеноводороды. Фтор взаимодействует с водородом со
взрывом с образованием фтороводорода: H2+F2=2HF .
Смесь хлора с водородом взрывается только при поджигании или освещении. В результате реакции образуется хлороводород: H2+Cl2=2HCl .
Бром начинает реагировать с водородом только при нагревании, и реакция происходит без взрыва. Продукт реакции — бромоводород: H2+Br2=2HBr .
Реакция йода с водородом идёт медленно даже при нагревании. Йод с водородом образуют газ йодоводород: H2+I2=2HI .
Снижение химической активности веществ в ряду: фтор — хлор — бром — йод.
Все галогеноводороды хорошо растворяются в воде. Их растворы представляют собой кислоты: HF — плавиковая, HCl — соляная, HBr — бромоводородная, HI — йодоводородная.
Сила кислот в этом ряду увеличивается. Самая слабая из них — плавиковая кислота, самая сильная — йодоводородная.
Слайд 8
Химические свойства
3. Вытеснение галогенов друг другом из солей
В
реакциях галогенов с галогенидами проявляется следующая закономерность: более активный
галоген вытесняет менее активный из его солей. Так, хлор взаимодействует с водными растворами бромидов и иодидов, выступая в этих реакциях окислителем:
2KBr+Cl2=Br2+2KCl 2NaI+Cl2=I2+2NaCl
Бром способен вытеснить иод из иодидов, а с хлоридами не реагирует:
2KI+Br2=I2+2KBr
У иода способность вытеснять другие галогены отсутствует, так как его окислительные свойства в ряду галогенов самые слабые.
Реакции фтора с водными растворами солей невозможны по причине его взаимодействия с водой.
Слайд 9
Получение галогенов
1. Электролиз растворов и расплавов галогенидов:
2NaCl =
Cl2+ 2Na
2NaCl + 2H2O = Cl2+ H2+ 2NaOH
2KF = 2K + F2 (единственный способ получения F2)
2. Окисление галогенводородов:
Лабораторный способ получения хлора
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
Лабораторный способ для получения хлора, брома, йода
MnO2 + 4HHal = MnHal2 + Hal2 + 2 H2O
3. Промышленный способ – окисление хлором (для брома и йода):
2KBr+Cl2=2KCl+Br2 2KI + Cl2=2KCl + I2
Слайд 10
ДЗ
Выберите, с какими из веществ будет реагировать фтор,
запишите уравнения реакций:
CaO
Mg
H2
KCl
H2O
Расставьте степени окисления: HBr HIO3
OF2 HBrO Cl2 AlCl3
Какую массу хлора можно получить при электролизе расплава 900г соли хлорида натрия, если в ней содержится 39% примесей?