- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Газообразные вещества
Содержание
- 2. Агрегатные состояния вещества
- 3. Что такое газ?Газ (газообразное состояние) (от нидерл. gas) —
- 4. Моля́рный объём NA = 6,022…×1023 Это число
- 5. Воздух -естественная смесь газов (главным образом азота и кислорода — 98-99 % в сумме, а также аргона, углекислого газа, воды, водорода), образующая земную атмосферу. Таблица состава воздуха:
- 6. Водород Самый лёгкий газ, он легче
- 7. Получение водорода1. Крекинг и риформинг углеводородов в процессе
- 8. Кислород При нормальных условиях кислород — это газ без
- 9. Кислород и озон1. В настоящее время в
- 10. Оксид углерода(IV)Оксид углерода(IV) (углекислый газ, диоксид углерода,
- 12. Аммиа́к NH3 - нитрид водорода, аммиакпри нормальных
- 13. Этилен по ИЮПАК: Этен (этилен) —
- 14. ПолиэтиленПолимеризация- процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения
- 15. МетанСН4 Основная часть природного газа
- 16. Другие представители газовИнертные газы
- 17. Скачать презентацию
- 18. Похожие презентации
Агрегатные состояния вещества










Слайд 4
Моля́рный объём
NA = 6,022…×1023
Это число Авогадро
в честь итальянского химика Амедео Авогадро. Это универсальная постоянная
для мельчайших частиц любого вещества.Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моле железа (Fe), молекул в 1 моле воды H2O и т. д.
Согласно закону Авогадро,
1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л. При нормальных условиях большинство газов близки к идеальным.
объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Слайд 5
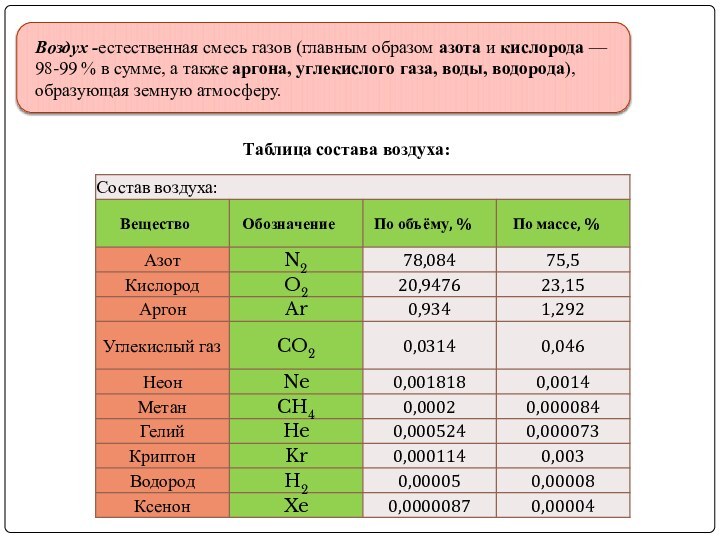
Воздух -естественная смесь газов (главным образом азота и кислорода — 98-99 % в
сумме, а также аргона, углекислого газа, воды, водорода), образующая земную атмосферу.
Таблица состава воздуха:
Слайд 6
Водород
Самый лёгкий газ, он легче воздуха
в 14,5 раз.
Как самые лёгкие, молекулы
водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса.
Опыт: Получение водорода
Опыт: Взрыв гремучего газа
Слайд 7
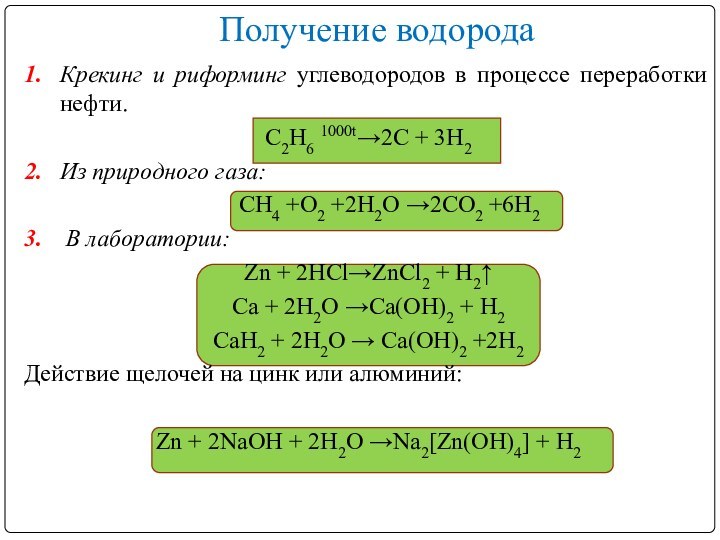
Получение водорода
1. Крекинг и риформинг углеводородов в процессе переработки
нефти.
С2Н6 1000t→2C + 3H2
2. Из природного газа:
CH4 +O2
+2H2O →2CO2 +6H23. В лаборатории:
Zn + 2HCl→ZnCl2 + H2↑
Ca + 2H2O →Ca(OH)2 + H2
CaH2 + 2H2O → Ca(OH)2 +2H2
Действие щелочей на цинк или алюминий:
Zn + 2NaOH + 2H2O →Na2[Zn(OH)4] + H2
Слайд 8
Кислород
При нормальных условиях кислород — это газ без цвета,
вкуса и запаха.
1 л его имеет массу 1,429 г.
Немного
тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте (2,78 мл/100 г при 25 °C).
Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C).
Является парамагнетиком — вещества, которые намагничиваются во внешнем магнитном поле в направлении внешнего магнитного поля и имеют положительную магнитную восприимчивость.
Опыт: Получение кислорода
Слайд 9
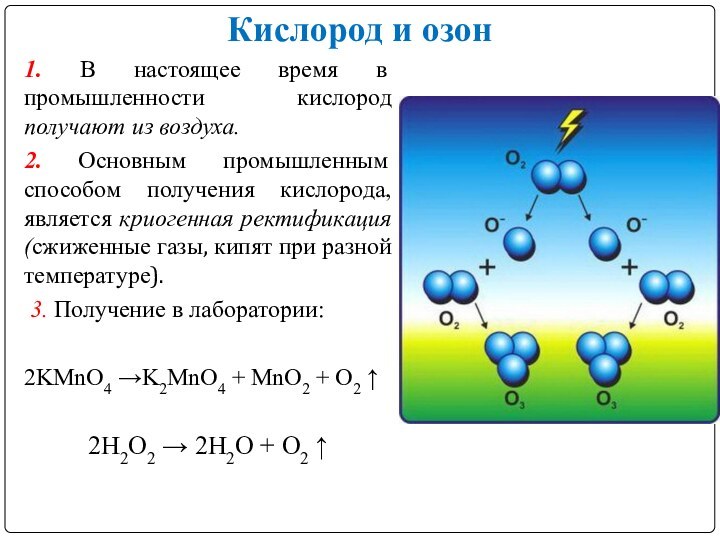
Кислород и озон
1. В настоящее время в промышленности
кислород получают из воздуха.
2. Основным промышленным способом получения
кислорода, является криогенная ректификация (сжиженные газы, кипят при разной температуре). 3. Получение в лаборатории:
2KMnO4 →K2MnO4 + MnO2 + О2 ↑
2H2O2 → 2Н2О + О2 ↑
Слайд 10
Оксид углерода(IV)
Оксид углерода(IV) (углекислый газ, диоксид углерода, двуокись
углерода, угольный ангидрид) — CO2
бесцветный газ (в нормальных условиях),
без запаха, со слегка кисловатым вкусом.
тяжелее воздуха,
растворим в воде,
при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда».
при атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С.
Углекислый газ образуется при гниении и горении органических веществ.
Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С).
Опыт: Получение СО2 и его свойства
Опыт: взаимодействие «сухого льда» с водой
CaCO3 + 2HCl →CaCl2 + CO2 + H2O
Слайд 12
Аммиа́к
NH3 - нитрид водорода, аммиак
при нормальных условиях —
бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Аммиак
почти вдвое легче воздухаII класс опасности (высокоопасные вещества).
Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Получение:
1. В лаборатории аммиак получают взаимодействием щелочей с солями аммония:
NH4Cl + NaOH = NaCl + H2O + NH3↑
2. В промышленности:
3H2 + N2 = 2NH3
Опыт: Свойства аммиака
Слайд 13
Этилен
по ИЮПАК:
Этен (этилен) — органическое
химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином).
При нормальных условиях — бесцветный горючий газ со слабым запахом.
Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях).
Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Играет чрезвычайно важную роль в промышленности.
Получение:
СН3−СН3 → СН2=СН2 + Н2
В лаборатории: из этилового спирта.
Опыт : Получение этилена и его горение
Слайд 14
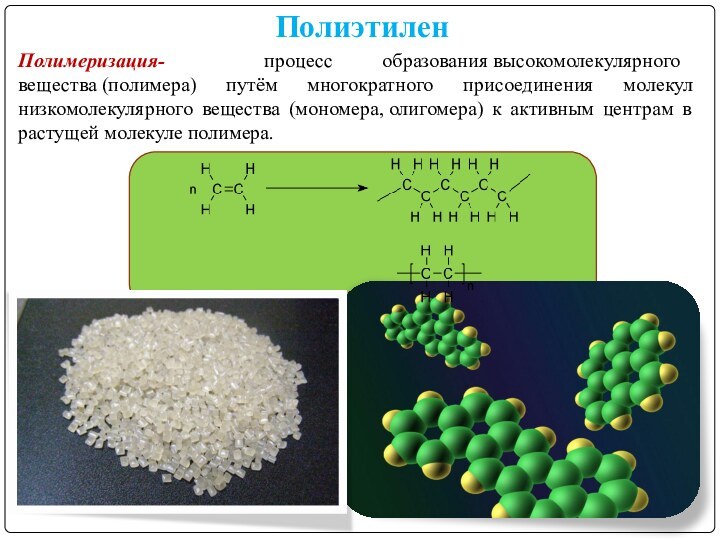
Полиэтилен
Полимеризация- процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул
низкомолекулярного вещества (мономера, олигомера) к активным центрам в растущей молекуле
полимера.
Слайд 15
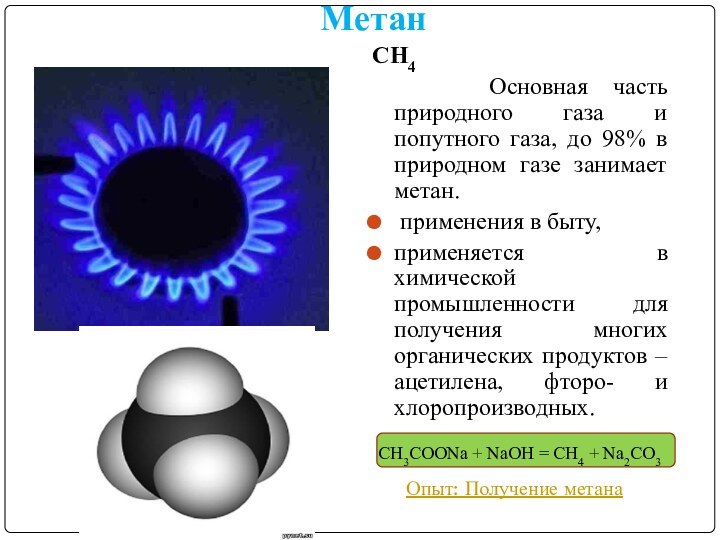
Метан
СН4
Основная часть природного газа и
попутного газа, до 98% в природном газе занимает метан.
применения в быту,
применяется в химической промышленности для получения многих органических продуктов – ацетилена, фторо- и хлоропроизводных.
Опыт: Получение метана
CH3COONa + NaOH = CH4 + Na2CO3