- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химические свойства кислот в свете ТЭД
Содержание
- 2. Кислоты вокруг насКаждый, кто занимается спортом, знает,
- 3. Некоторые голожаберные морские моллюски, защищаясь, выделяют из
- 4. Иботеновая кислотаКислоты вокруг нас
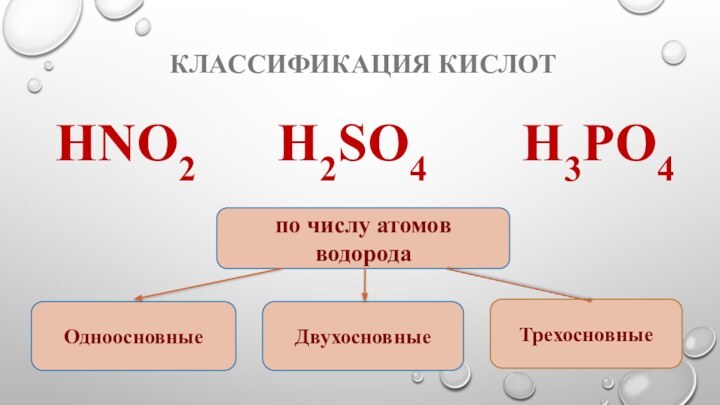
- 5. Классификация кислотHNO2 H2SO4 Н3PO4по числу атомов водородаОдноосновныеТрехосновныеДвухосновные
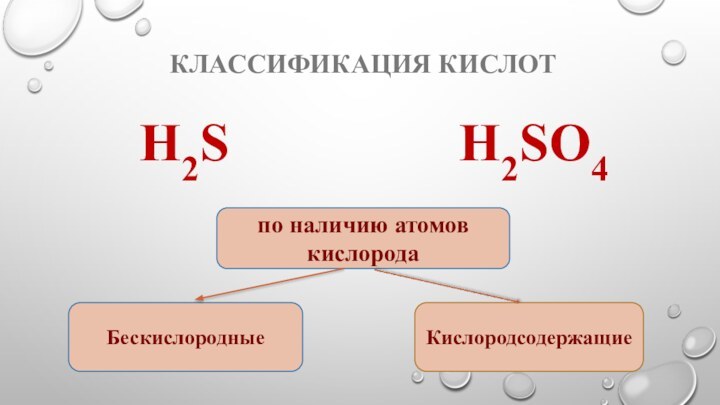
- 6. Классификация кислотH2S Н2SO4по наличию атомов кислородаБескислородныеКислородсодержащие
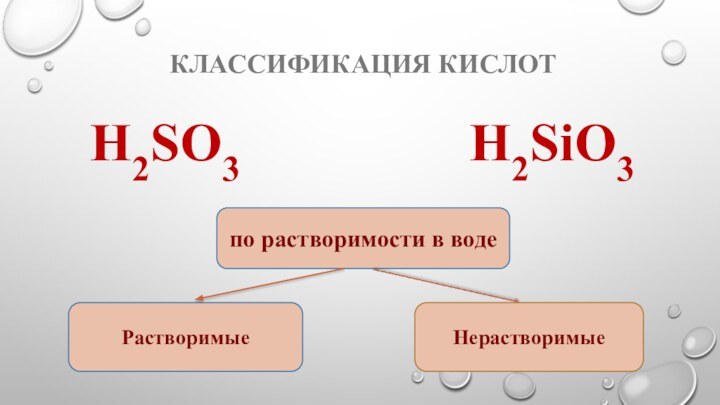
- 7. Классификация кислотH2SO3 Н2SiO3по растворимости в водеРастворимыеНерастворимые
- 8. HCl HNO3 H2SO4 H3PO4 →
- 9. HCl → Н+ + Cl-H3PO4 → 3H+
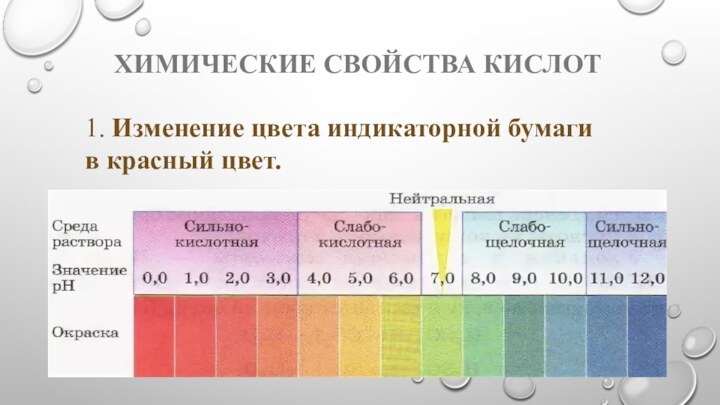
- 11. Химические свойства кислот1. Изменение цвета индикаторной бумаги в красный цвет.
- 12. Химические свойства кислот2. Взаимодействие (вз-е) с Ме,
- 13. Химические свойства кислот3. Вз-е с оксидами металлов: CaO + HNO3 →
- 14. Химические свойства кислот4. Вз-е с основаниями:
- 15. Химические свойства кислот5. Вз-е с солями (реакция
- 16. Химические свойства кислот6. Нерастворимые кислоты при нагревании
- 17. Скачать презентацию
- 18. Похожие презентации
Кислоты вокруг насКаждый, кто занимается спортом, знает, что такое жжение в мышцах после тренировки. При выполнении упражнений выделяется молочная кислота.












Слайд 3 Некоторые голожаберные морские моллюски, защищаясь, выделяют из своих
желез серную кислоту, воздействующую на кожные покровы и органы
обидчика.Тропический паук педипальпида, спасаясь от своих врагов, стреляет в них струйкой жидкости, состоящей на 84% из уксусной кислоты.
Кислоты вокруг нас
Слайд 5
Классификация кислот
HNO2 H2SO4
Н3PO4
по числу атомов водорода
Одноосновные
Трехосновные
Двухосновные
Слайд 8
HCl
HNO3
H2SO4
H3PO4
→ Н+
+ Cl-
→ H+ + NO3 –
→ 2H+ + SO4 2- → 3H+ + PO43-
Дайте характеристику кислотам:
Кислота, когда здорова,
Угостить друзей готова
Тем, что ей дала природа,
Катионом водорода!
Слайд 9
HCl → Н+ + Cl-
H3PO4 → 3H+ +
PO43-
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ В СВЕТЕ ТЭД
Учитель химии
МОУ «СОШ №32»
г.
СаранскаНуянзина М.И.
Слайд 12
Химические свойства кислот
2. Взаимодействие (вз-е) с Ме, стоящими
в ряду
напряжений до водорода
(искл. H2SiO3, HNO3; образующаяся соль должна
быть растворима в воде):
Zn + HCl →
Слайд 14
Химические свойства кислот
4. Вз-е с основаниями:
а)
растворимыми:
NaOH + H2SO4 →
б) нерастворимыми:Fe(OH)3 + H2SO4 →
- реакция нейтрализации
Слайд 15
Химические свойства кислот
5. Вз-е с солями (реакция осуществима,
если
в результате выпадает осадок или выделяется
газ):BaCl2 + H2SO4 →
Na2CO3 + HCl →





























