- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Стратегия решения олимпиадных задач по химии. Часть 3
Содержание
- 2. В руде содержится 58% оксида марганца (IV).
- 3. В руде содержится 58% оксида марганца (IV).
- 4. Чему равны массовые доли (%) изотопов неона 20Ne
- 5. Чему равны массовые доли (%) изотопов неона 20Ne
- 6. Смесь медного купороса CuSO4 ∙ 5H2O и
- 7. Смесь медного купороса CuSO4 ∙ 5H2O и
- 8. В смеси газообразных СО и СОг массовое
- 10. Кристаллогидрат сульфата марганца (II) содержит 24,66% марганца. Какую формулу имеет кристаллогидрат?
- 11. Кристаллогидрат сульфата марганца (II) содержит 24,66% марганца.
- 12. Газовые законыЗависимость между давлением и объемом идеального
- 13. Газовые законыЗависимость свойств идеальных газов от температуры
- 14. Газовые законыЗапись объединенного газового закона pV/T= = const может
- 15. Газовые законыОдно из следствий объединенного газового закона:
- 16. В замкнутом сосуде емкостью 1,5 л
- 17. В замкнутом сосуде емкостью 1,5 л находится
- 18. Химик, определявший атомную массу нового элемента
- 19. РЕШЕНИЕПредположим, что при температуре 250о С вещества А,
- 20. К 20 мл смеси ацетилена и
- 21. К 20 мл смеси ацетилена и азота
- 22. В контактный аппарат для окисления сернистого
- 23. В контактный аппарат для окисления сернистого газа
- 24. В эвдиометре взорвали смесь 500 мл
- 25. РЕШЕНИЕ:
- 26. После проведения реакции в смеси двух
- 27. После проведения реакции в смеси двух газов
- 28. Вычислите относительную плотность по азоту смеси
- 29. Вычислите относительную плотность по азоту смеси газов,
- 30. Специальный сосуд по очереди заполняли газами
- 31. Специальный сосуд по очереди заполняли газами (при
- 32. Скачать презентацию
- 33. Похожие презентации
В руде содержится 58% оксида марганца (IV). Каково содержание марганца в руде, если в МnО2 оно составляет 63,2%.































Слайд 2 В руде содержится 58% оксида марганца (IV). Каково
содержание марганца в руде, если в МnО2 оно составляет 63,2%.
Слайд 3 В руде содержится 58% оксида марганца (IV). Каково
содержание марганца в руде, если в МnО2 оно составляет 63,2%.
РЕШЕНИЕ:Массовая доля марганца в руде равна 0,58-0,632 = 0,366, т. е. 36,6%.
Слайд 4 Чему равны массовые доли (%) изотопов неона 20Ne и 22Ne
в природном газе, имеющем среднюю относительную атомную массу 20,2
?Слайд 5 Чему равны массовые доли (%) изотопов неона 20Ne и 22Ne
в природном газе, имеющем среднюю относительную атомную массу 20,2
?РЕШЕНИЕ:
Примем за х число атомов 20Ne в каждых 100 атомах природного неона, тогда число атомов 22Ne будет (100 - х). Масса атомов 20Ne равна 20х, а масса атомов 22Ne = 22-(100-х)
20x + 22 (100-x) = 20,2 100.
Из уравнения находим х = 90 (атомов 20Ne) и 100 - 90=10 (атомов 22Ne). Таким образом, массовая доля 20Ne составляет 90%, а массовая доля 22Ne – 10%.
Слайд 6 Смесь медного купороса CuSO4 ∙ 5H2O и кристаллов
соды Na2CO3 ∙10H2O содержит 38% связанной воды. Рассчитайте, чему
равны массовые доли (%) каждого из веществ смеси.Слайд 7 Смесь медного купороса CuSO4 ∙ 5H2O и кристаллов
соды Na2CO3 ∙10H2O содержит 38% связанной воды. Рассчитайте, чему
равны массовые доли (%) каждого из веществ смеси.РЕШЕНИЕ:
Обозначим через х массовую долю медного купороса в смеси. Тогда в смеси массой m имеется тх г медного купороса и (т-тх) г соды. М(Н2О) = 18; M(CuSO4 ∙ 5H2O) = 250; M(Na2CO3 ∙ 10Н2О) = 286. Масса воды в m г смеси составляет (0,38 т) г. Масса воды в тх (г) CuSO4 ∙ 5H2O равна
а масса воды в (m-тх) г Na2CO3 ∙ 10Н2О равна (m-тх)
Исходя из того, что масса воды в смеси равна сумме масс воды, входящей в состав медного купороса и соды, запишем уравнение
0,38m = 0,36mх + 0,63m-0,б3mх:;
0,63mх-0,36mх = 0,63m-0,38m;
0,27mх = 0,25m;
Состав смеси в процентах: 92,5% CuSO4 ∙ 5H2O и 100-92,5 = 7,5% Na2CO3 ∙ 10H2O
Слайд 8 В смеси газообразных СО и СОг массовое отношение
С : О равно 1:2. а) Рассчитайте массовые доли газов в процентах. б)
Рассчитайте состав смеси по объему в процентах. в) Укажите соотношения С:О, при которых оба газа одновременно не могут присутствовать.Слайд 10 Кристаллогидрат сульфата марганца (II) содержит 24,66% марганца. Какую
формулу имеет кристаллогидрат?
Слайд 11 Кристаллогидрат сульфата марганца (II) содержит 24,66% марганца. Какую
формулу имеет кристаллогидрат?
РЕШЕНИЕ:
M(MnSO4) = 151; M(Mn)=55; х - число молей
Н2О в одном моле кристаллогидрата MnSO4∙H2O.24,66% соответствует 55 г, 100% соответствует (151 + 18x) г, x = 4. Формула вещества MnSO4 ∙ 4H2O.
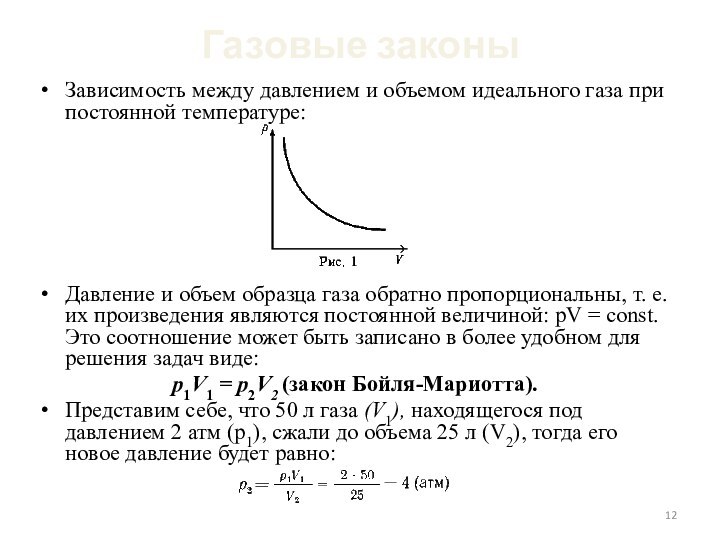
Слайд 12
Газовые законы
Зависимость между давлением и объемом идеального газа
при постоянной температуре:
Давление и объем образца газа обратно пропорциональны,
т. е. их произведения являются постоянной величиной: pV = const. Это соотношение может быть записано в более удобном для решения задач виде:p1V1 = p2V2 (закон Бойля-Мариотта).
Представим себе, что 50 л газа (V1), находящегося под давлением 2 атм (p1), сжали до объема 25 л (V2), тогда его новое давление будет равно:
Слайд 13
Газовые законы
Зависимость свойств идеальных газов от температуры определяется
законом Гей-Люссака: объем газа прямо пропорционален его абсолютной температуре
(при постоянной массе: V = kT, где k - коэффициент пропорциональности). Это соотношение записывается обычно в более удобной форме для решения задач:Например, если 100 л газа, находящегося при температуре 300К, нагревают до 400К, не меняя давления, то при более высокой температуре новый объем газа будет равен
Слайд 14
Газовые законы
Запись объединенного газового закона pV/T= = const может быть
преобразована в уравнение Менделеева-Клапейрона:
где R - универсальная газовая постоянная, a ν - число
молей газа.Уравнение Менделеева-Клапейрона позволяет проводить самые разнообразные вычисления. Например, можно определить число молей газа при давлении 3 атм и температуре 400К, занимающих объем 70 л:
Слайд 15
Газовые законы
Одно из следствий объединенного газового закона: в
равных объемах различных газов при одинаковой температуре и давлении
содержится одинаковое число молекул. Это закон Авогадро.Из закона Авогадро в свою очередь вытекает также важное следствие: массы двух одинаковых объемов различных газов (естественно, при одинаковых давлении и температуре) относятся как их молекулярные массы:
m1/m2 = M1/M2 (m1 и m2 - массы двух газов);
M1IM2 представляет собой относительную плотность.
Закон Авогадро применим только к идеальным газам. При нормальных условиях трудно сжимаемые газы (водород, гелий, азот, неон, аргон) можно считать идеальными. У оксида углерода (IV), аммиака, оксида серы (IV) отклонения от идеальности наблюдаются уже при нормальных условиях и возрастают с ростом давления и понижением температуры.
Слайд 16 В замкнутом сосуде емкостью 1,5 л находится
смесь сероводорода с избытком кислорода при температуре 27oС и
давлении 623,2 мм рт. ст. Найдите суммарное количество веществ в сосуде.Слайд 17 В замкнутом сосуде емкостью 1,5 л находится смесь
сероводорода с избытком кислорода при температуре 27oС и давлении
623,2 мм рт. ст. Найдите суммарное количество веществ в сосуде.РЕШЕНИЕ:
Слайд 18 Химик, определявший атомную массу нового элемента X
в середине XIX в., воспользовался следующим методом: он получал
четыре соединения, содержащие элемент X (А, Б, В и Г), и определял массовую долю элемента (%) в каждом из них. В сосуд, из которого предварительно был откачан воздух, он помещал каждое соединение, переведенное в газообразное состояние при 250oС, и устанавливал при этом давление паров вещества 1,013·105 Па. По разности масс пустого и полного сосудов определялась масса газообразного вещества. Аналогичная процедура проводилась с азотом. В результате можно было составить такую таблицу:Определите вероятную атомную массу элемента X.
Слайд 19
РЕШЕНИЕ
Предположим, что при температуре 250о С вещества А, Б,
В, Г являются идеальными газами. Тогда по закону Авогадро
Масса
элемента X в 1 моль вещества А, Б, В и Г (г/моль):М(А) .0,973 = 35,45;
М(Б) .0,689 = 70,91;
М (В).0,851 = 177,17;
М(Г).0,922= 141,78
Поскольку в молекуле вещества должно быть целое число атомов элемента X, нужно найти наибольший общий делитель полученных величин. Он составляет 35,44 г/моль, и это число можно считать вероятной атомной массой элемента X.
Слайд 20 К 20 мл смеси ацетилена и азота
прибавили 60 мл кислорода. После реакции объем смеси оказался
равным 56 мл. Определить процентный состав (по объему) исходной газовой смеси.Слайд 21 К 20 мл смеси ацетилена и азота прибавили
60 мл кислорода. После реакции объем смеси оказался равным
56 мл. Определить процентный состав (по объему) исходной газовой смеси.РЕШЕНИЕ:
Слайд 22 В контактный аппарат для окисления сернистого газа
подают смесь воздуха с 10% сернистого газа. Определить процентный
состав газов, выходящих из контактного аппарата, если сернистый газ окисляется полностью.Слайд 23 В контактный аппарат для окисления сернистого газа подают
смесь воздуха с 10% сернистого газа. Определить процентный состав
газов, выходящих из контактного аппарата, если сернистый газ окисляется полностью.РЕШЕНИЕ:
Слайд 24 В эвдиометре взорвали смесь 500 мл воздуха
с 20 мл смеси этана и бутана, плотность по
водороду которой равна 17,8. Определить состав образовавшейся смеси. Как изменится давление в эвдиометре, если до реакции условия были нормальными?Слайд 26 После проведения реакции в смеси двух газов
(с исходной плотностью по воздуху 1,048) ее плотность по
воздуху увеличилась до 1,310. При пропускании продуктов реакции через раствор гидроксида натрия их объем уменьшается вдвое, а плотность остатка по гелию составляет 8,000. Определите качественный и количественный состав (в объемных %) исходной газовой смеси и состав смеси после реакции.Слайд 27 После проведения реакции в смеси двух газов (с
исходной плотностью по воздуху 1,048) ее плотность по воздуху
увеличилась до 1,310. При пропускании продуктов реакции через раствор гидроксида натрия их объем уменьшается вдвое, а плотность остатка по гелию составляет 8,000. Определите качественный и количественный состав (в объемных %) исходной газовой смеси и состав смеси после реакции.РЕШЕНИЕ:
Молярная масса остатка составляет 8 · 4 = 32 (г/моль), что может соответствовать кислороду – O2.
Поскольку этот газ составлял ровно половину от продуктов реакции, то для х – мол. масса второго газа имеем (х+32)/2=1,31· 29, откуда х = 1,31 · 29 · 2 – 32 = 43,98 (г/моль), что может соответствовать газам CO2, N2O, C3H8. Раствором щелочи может поглощаться CO2. Тогда в смеси после реакции могут быть CO2 и O2 – (избыток) (1:1). Такая смесь может образоваться после взаимодействия CO и O2 (в избытке O2): 2CO + O2 = 2 CO2. Тогда исходная газовая смесь – CO и O2 в соотношении 2:(1+2=3), или 40% CO и 60 % O2. Состав смеси после реакции : CO2 (50%), O2 (50%). Реакция поглощения CO2: 2NaOH + CO2 = Na2CO3 + H2O.
Слайд 28 Вычислите относительную плотность по азоту смеси газов,
состоящих из пентена и углекислого газа, если в этой
смеси на три атома углерода приходится один атом кислорода.Слайд 29 Вычислите относительную плотность по азоту смеси газов, состоящих
из пентена и углекислого газа, если в этой смеси
на три атома углерода приходится один атом кислорода.РЕШЕНИЕ:
Пусть х моль пентена и у моль углекислого газа.
Тогда (5х + у) – 3
2у - 1; 5х + у = 6у; 5х = 5у; х = у
Допустим, 1 моль пентена и 1 моль углекислого газа.
М(C5H10) = 70 г/моль; М(СО2) = 44 г/моль;
2 моль смеси – 114 г
1 моль смеси – М;
М(смеси) = 57 г/моль Относительная плотность смеси по азоту
57 : 28 = 2, 04
Слайд 30 Специальный сосуд по очереди заполняли газами (при
н.у.) и взвешивали. Масса сосуда, заполненного углекислым газом, азотом
и неизвестным газом А, составляла: 48,8 г; 45,6 г; 48 г. Определите молярную массу неизвестного газа А.Слайд 31 Специальный сосуд по очереди заполняли газами (при н.у.)
и взвешивали. Масса сосуда, заполненного углекислым газом, азотом и
неизвестным газом А, составляла: 48,8 г; 45,6 г; 48 г. Определите молярную массу неизвестного газа А.РЕШЕНИЕ:
Обозначим через х массу сосуда, через у количество газа в сосуде. Так как газы занимали один и тот же объем, их количества одинаковы. Выразим через у массы углекислого газа и азота:
m(CO2) = 44 y
m(N2) = 28 y
Составим систему уравнений, учитывая, что масса сосуда, заполненного газом, равна сумме масс сосуда и газа:
x + 44·y = 48,8
x + 28·y = 45,6
x =40; у = 0,2
Вычислим массу неизвестного газа:
m(A) = 48 г – 40 г = 8 г Вычислим молярную массу неизвестного газа:
М(А) = 8 г / 0,2 моль = 40 г/моль





























