III периода, VI группы, главной подгруппы.
Заряд ядра атома
серы равен +16.В ядре атома серы 16 протонов, 16 нейтронов.
В атоме серы 16 электронов.
Электронное строение атома серы
На внешнем уровне в атоме 6 электронов.
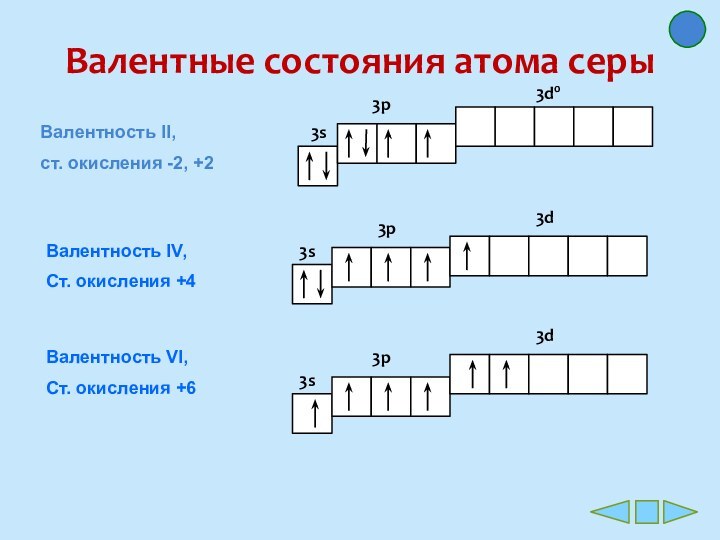
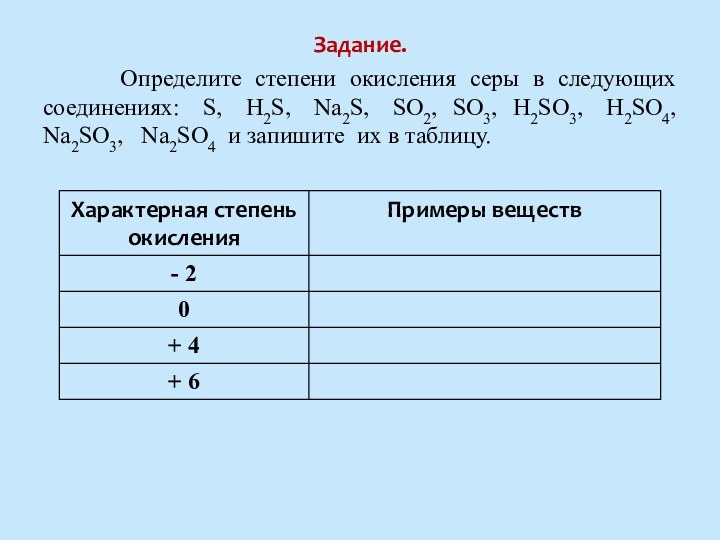
Степень окисления атома серы низшая равна -2 , высшая равна +6
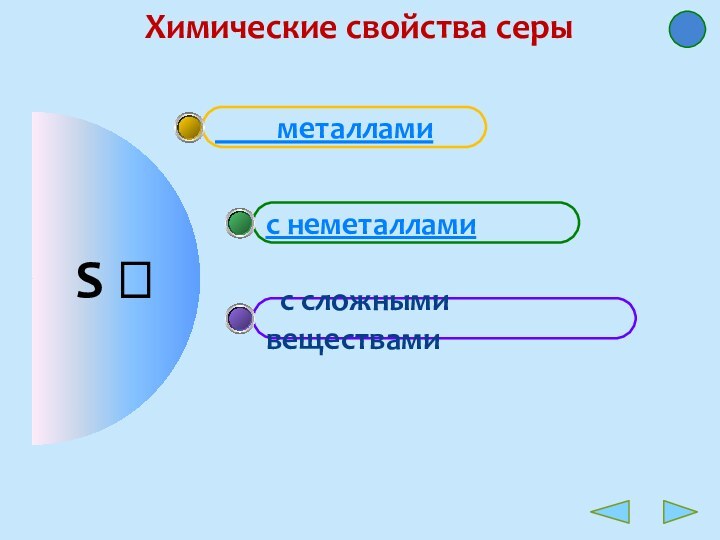
Простое вещество сера являетcя неметаллом.
Формула высшего оксида серы SO3 , его характер кислотный .
Формула гидроксида серы H2SO4 , его характер кислотный .
Поставьте пропущенные слова
1s2
2s2
3s2
3p4
2p6
















![Презентация Сложение и вычитание вида []+4,[]-4](/img/tmb/13/1211537/0b7d6257d82936c4e7e89b84d23349cb-210x.jpg)



























