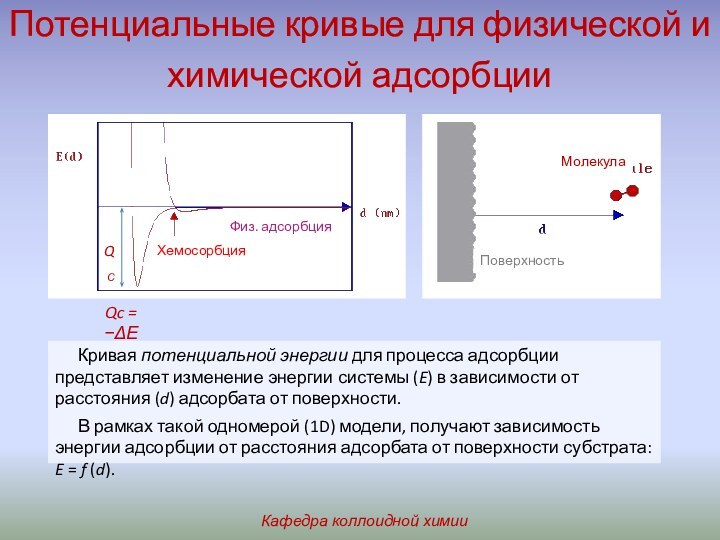
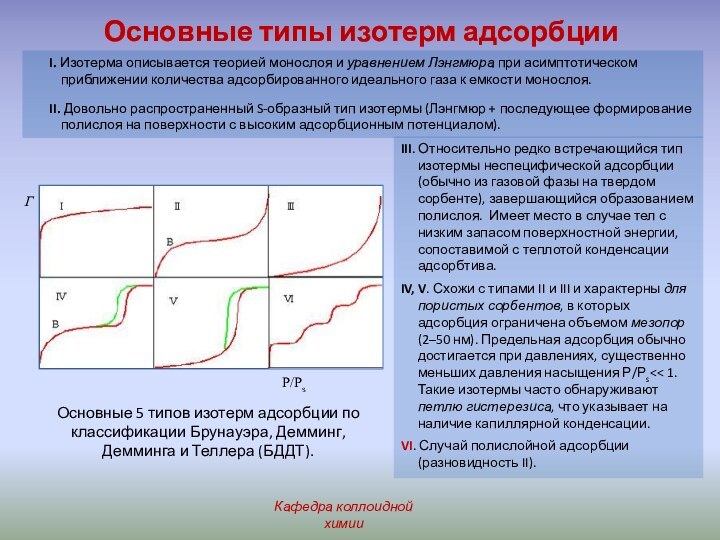
адсорбентом (субстратом или субфазой). Вещество, молекулы которого способны адсорбироваться,
– адсорбтивом, а адсорбированное вещество – адсорбатом. Процесс, обратный А, называют десорбцией.Природа сил, участвующих в А, может быть очень разной.
Простейшим и наиболее универсальным видом взаимодействия является неспецифическое дисперсионное (ван-дер-ваальсово) притяжение, обусловленное флуктуациями электронной плотности во взаимодействующих системах. Оно повышается с ростом поляризуемости контактирующих фаз-партнеров.
Если на поверхности адсорбента и/или в его молкулах имеются ионы, диполи , вакантные орбитали и т.д., то появляется большое разнообразие неспецифических и специфических взаимодействий.
Хемосорбция протекает как А, но с образованием новой химической связи между адсорбентом и адсорбатом.
Оба процесса всегда экзотермичны.
Кафедра коллоидной химии